振幅整合脑电图监测不同胎龄早产儿宫外环境下脑发育的多中心观察性研究
振幅整合脑电图多中心研究协作组:程国强 胡勇 庄德义潘新年 汪吉梅邵肖梅
·论著·
振幅整合脑电图监测不同胎龄早产儿宫外环境下脑发育的多中心观察性研究
振幅整合脑电图多中心研究协作组:程国强1,5胡勇2,5庄德义3,5潘新年4,5汪吉梅2,5邵肖梅1
目的 了解宫外生活对28~36周早产儿振幅整合脑电图(aEEG)的影响。方法 以出生时无窒息抢救史早产儿为早产儿组,以胎龄37周出生后正常的新生儿为对照组;早产儿组采用振幅整合脑电图仪分别于生后3 d内,然后每周监测1次直至出院(或最长监测至纠正胎龄37周),对照组于生后第3 d 行aEEG监测。每次连续监测4 h。分析胎龄和纠正胎龄对aEEG成熟过程影响,包括aEEG背景连续性、睡眠-觉醒周期、下边界振幅和带宽。5家参研医院均采用相同品牌和型号的aEEG,研究开始前统一进行操作技术培训,样本的临床和图像数据发送至复旦大学附属儿科医院整理。结果 2008年5月1日至2009年8 月31日5家参研医院符合本文纳入和排除标准的早产儿组135例,对照组20例。早产儿aEEG的成熟度受胎龄和纠正胎龄的影响,随胎龄和纠正胎龄增加,aEEG背景连续性和睡眠-觉醒周期出现的百分比均增加,逐步出现连续性电压(χ2=26.865,P<0.01),≥34周出生的早产儿成熟的睡眠-觉醒周期的出现的百分比均为100%(χ2=192.4,P<0.01);下边界振幅升高(F=11.4,P<0.01),带宽变窄(F=8.731,P<0.01)。纠正胎龄和同出生胎龄的新生儿比较,连续性电压百分比、睡眠-觉醒周期的出现率均显著增加,胎龄>34周的早产儿出生时aEEG均可见明显的睡眠-觉醒周期,而纠正胎龄32周时,睡眠-觉醒周期出现的百分比已达到100%;窄带下界也显著增高;窄带带宽变窄,至34周龄后,纠正胎龄和同出生胎龄新生儿均变化不明显。结论 早产儿aEEG的成熟度与出生胎龄和纠正胎龄相关,宫外生活加速了早产儿脑发育成熟。
早产儿; 振幅整合脑电图; 脑损伤; 脑发育
随着产科和新生儿重症监护技术的提高,早产儿存活率显著增加,但远期神经发育预后不良的发生率并没有相应降低,特别是极低和超低出生体重儿[1]。如何减少这些早产儿神经发育伤残的发生率仍然是新生儿医生面对的主要问题之一。连续监测早产儿脑功能有助于识别发生脑损伤的高危儿和高危因素;早期识别和避免高危因素可防止继发性脑损伤。
振幅整合脑电图(aEEG)可以连续监测脑功能,已经广泛应用于NICU[2]。aEEG背景电活动与神经系统评估结果和常规脑电图具有较好的一致性[3~5]。 有研究报道不同胎龄早产儿aEEG的成熟度与神经发育变化相一致[6~12]。仅少数研究报道了宫外生活对aEEG某一参数成熟度的影响[13~16]。目前认为对aEEG多参数的分析可以提高判断预后的价值[17]。本文以正常足月儿为对照,通过aEEG的4个主要参数探讨临床情况稳定、神经系统发育正常的不同胎龄早产儿aEEG成熟度变化及宫外生活时间对其影响。
1 方法
1.1 早产儿组纳入标准 ①胎龄28~36周;②出生时无窒息抢救史;③生后第3 d,第1、2、3、4周和纠正胎龄36周行头颅B超检查,出院前行头颅MRI检查;④aEEG检查前无应用镇静剂或镇痛药物史。
1.2 早产儿组排除标准 ①行头颅B超和MRI检查确定存在缺氧缺血性脑病(HIE)、脑室内出血(IVH)和脑室周白质软化(PVL);②存在惊厥或代谢性疾病;③血培养阳性的败血症和中枢神经系统感染;④染色体疾病或先天性畸形。
1.3 对照组纳入标准 ①母婴同室或新生儿室的胎龄37周新生儿;②出生时无窒息抢救史;③出生后正常的新生儿;④家长愿意配合完成aEEG监测的新生儿。
1.4 参研医院 本研究为复旦大学附属儿科医院(我院)牵头组织的多中心研究,其他参研究医院如下:复旦大学附属妇产科医院、广西壮族自治区妇幼保健院、福建省厦门市第一医院和上海市第一妇幼保健院。
1.5 胎龄的确定 评定胎龄以末次月经周期和(或)通过围生期胎儿B超或(和)采用Ballard评分。纠正胎龄=出生胎龄+生后日龄。
1.6 质量控制 5家参研医院均使用由上海交通大学生物医学工程系、上海健尔医疗器械公司和我院共同研制的CFM3000样机,研究实施过程仪器的稳定性由上海健尔医疗器械公司维护调试。由复旦大学附属儿科医院对其他参研单位的有关人员集中进行操作技术培训。每一个分中心有专人收集和管理资料。收集的临床和图像数据发送至我院整理。
1.7 aEEG监测方法 采用一次性电极,描记前清洁头皮;接通电源,校正仪器;电极放置于双顶骨(相当于10-20国际电极安放法电极位置的P3和P4)处,两电极点距离为75 mm,参考电极放置距头顶中央25 mm额中线上)[18]。于生后3 d内进行第1次监测,然后每周监测1次直至出院(或最长监测至纠正胎龄37周),每次连续监测4 h。描记期间对各种可能导致aEEG变化的事件进行记录:如喂奶、更换尿布、静脉穿刺或注射药物等。
1.8 aEEG图形分析 按照文献[9~11]描述的方法对aEEG图形按背景连续性、睡眠-觉醒周期(周期性)、下边界振幅和带宽4个方面行成熟性评估。
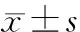
2 结果

2.2 各胎龄早产儿出生时aEEG特征及与同纠正胎龄时aEEG的比较
2.2.1 各胎龄早产儿出生时aEEG特征 表2显示,随着出生胎龄的增大,早产儿的aEEG背景逐渐成熟。表现为:

表1 各胎龄新生儿的一般资料

GA/weeksWeight/gM/F(n/n)Vaginal/CS(n/n)Apgarscore28(n=10)1299±1328/24/67.9±0.829(n=11)1375±2225/66/58.6±1.430(n=14)1550±4029/57/78.2±1.331(n=16)1543±2648/88/89.0±1.232(n=18)1625±34112/610/88.7±1.433(n=16)1776±25513/310/69.2±1.134(n=20)1899±2729/119/119.1±1.135(n=16)2096±2799/77/99.1±1.236(n=14)2464±45510/46/89.6±0.637(n=20)3005±35812/811/99.5±0.4
Notes GA: gestational age; M/F: male/female; CS: cesarean section
①aEEG图形不连续电压逐渐减少,逐步出现了连续性电压(χ2=26.865,P<0.01);②周期性出现的百分比增加,≥34周出生的早产儿,均出现成熟的周期性(χ2=192.4,P<0.01);③下边界振幅随胎龄增大而呈逐渐上升趋势(F=11.4,P<0.01)和带宽逐渐变窄(F=8.731,P<0.01)。
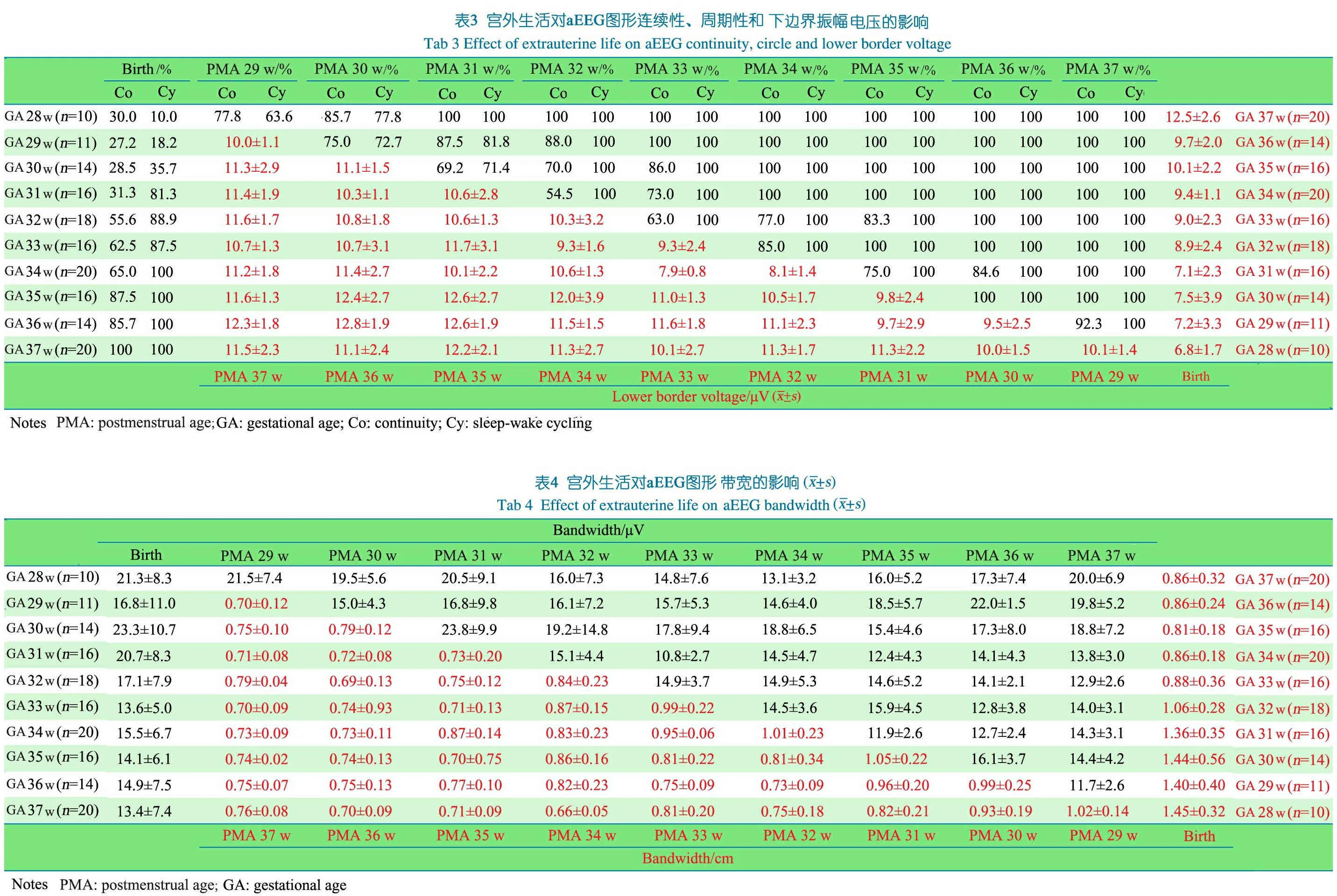
2.2.2 纠正胎龄时aEEG与同胎龄早产儿出生时aEEG的比较 表2显示,①随着出生后纠正胎龄的增加,aEEG的背景活动也逐渐成熟,各纠正胎龄早产儿均比同胎龄早产儿出生时aEEG连续性电压的百分比明显增加;②周期性明显的aEEG图形的百分比显著增加,胎龄>34周的早产儿出生时aEEG均可见周期性出现的百分比为100%,纠正胎龄32周周期性出现的百分比达100%;③下半界振幅纠正胎龄早产儿明显高于同胎龄早产儿出生时;④早产儿出生后aEEG图形带宽逐渐变窄,纠正胎龄与同胎龄早产儿出生时aEEG带宽在胎龄32周前差异有统计学意义。
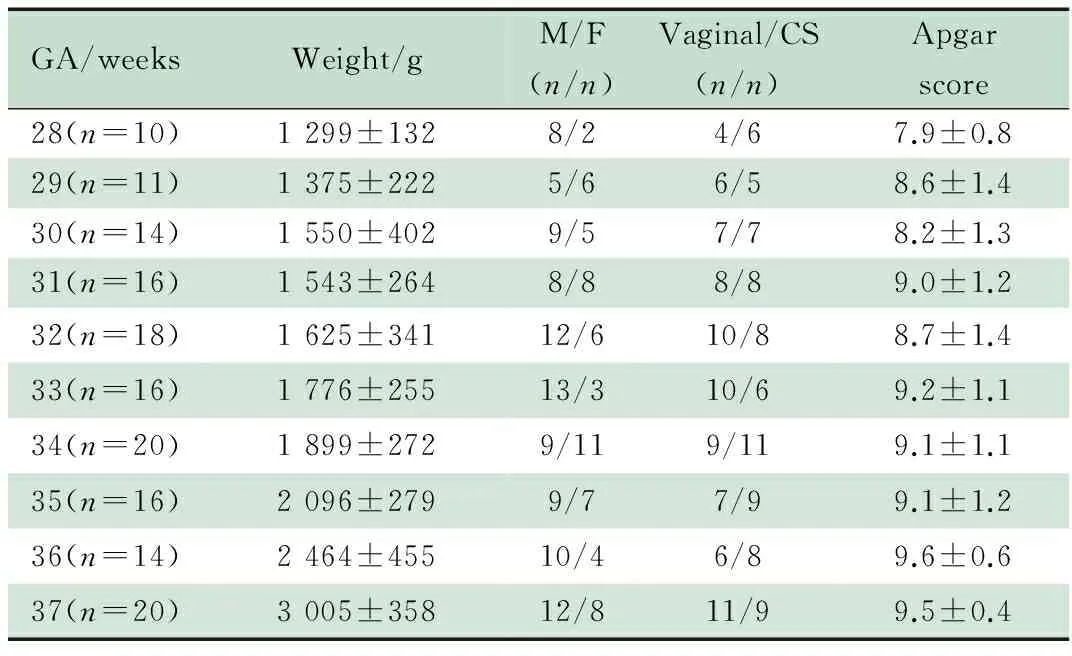
2.3 出生后宫外生活对早产儿aEEG成熟过程的影响(表3)
2.3.1 连续性 出生胎龄越小,出现连续性电压的纠正胎龄越早。如同样达到纠正胎龄31周时,出生胎龄28、29、30和31周的早产儿出现连续性电压的百分比分别为100%、87.5%、69.2%和31.3%。
2.3.2 周期性 出生胎龄越小,出现明显周期性的纠正胎龄越早,如同样达到纠正胎龄31周时,出生胎龄28、29、30和31周的早产儿出现周期性的百分比分别为100%、81.8%、71.4%和81.3%。
2.3.3 下边界振幅 不同胎龄出生的早产儿随着纠正胎龄的增加,下边界振幅均呈升高趋势。达到同一纠正胎龄时,出生胎龄越小的早产儿,aEEG下边界振幅升高越明显。如达到纠正胎龄32周时,出生胎龄28、29、30、31和32周早产儿,下边界振幅分别为11.3、11.1、10.5、8.1和8.9 μV。纠正胎龄越接近足月,不同出生胎龄的下边界振幅相近。
2.3.4 带宽 不同胎龄早产儿出生后随着PMA的增加,带宽逐渐变窄。达到同一纠正胎龄时,出生胎龄越小的早产儿,带宽越窄,如达到纠正胎龄32周时,出生胎龄28、29、30、31和32周早产儿,窄带带宽分别为:0.75、0.73、0.81、1.01和1.06 cm。纠正胎龄越接近足月儿,不同出生胎龄的带宽相近。
3 讨论
既往研究分别评价了出生胎龄和纠正胎龄对aEEG连续性、周期性、下边界振幅或带宽的影响[6~15],但有关宫外生活对早产儿aEEG的4个参数影响的研究很少[16]。为最大程度的发挥aEEG在早产儿脑损伤及其评价预后方面的价值,应该对aEEG更多的参数进行研究,特别是宫外生活对不同胎龄早产儿脑发育的影响。本研究结果表明,相对正常早产儿aEEG连续性、周期性、下边界电压和带宽成熟均与胎龄和纠正胎龄有关;宫外生活对不同胎龄的早产儿影响不同,出生胎龄越小,受宫外生活的影响越大,表现为脑发育加速越明显。这一结果与文献报道的有关宫外生活对早产儿aEEG不同参数的影响结果相一致[13~16]。
连续性是判断脑发育成熟度的重要参数之一。多篇文献[9,14,19]研究结果表明早产儿随胎龄增加aEEG连续性的百分比逐渐增加。本研究结果表明,出生胎龄越小,宫外生活对脑发育的影响越大,表现为aEEG成熟加速,与Soubasi等[16]研究结果一致。
aEEG图形的周期性变化,类似于早期的睡眠-觉醒周期变化。本研究表明随胎龄和纠正胎龄的增加,周期性的发育逐渐成熟,与Sisman等[13]有关周期性的研究结果一致。对胎龄24~27周早产儿行常规EEG的研究也表明存在睡眠/活动睡眠和清醒间断性变化[20,21]。对胎龄<30周早产儿aEEG的研究也表明存在周期性变化[8],甚至胎龄24周的早产儿也可看到周期性变化[6]。周期性的存在和睡眠期间最小振幅的增加提示早产儿预后良好[11]。
常规EEG电活动的振幅随成熟度增加逐渐降低[22]。Hellström-Westas等[11]发表了不同胎龄和纠正胎龄aEEG振幅的参考值,随胎龄和纠正胎龄增加,下边界逐渐增加,上边界逐渐减少。本文对下边界和带宽的研究与上述参考值相似,特别是随胎龄和纠正胎龄的增加,带宽逐渐变窄。
有关出生后aEEG成熟加速的机制仍不清楚,Soubasi等[16]和Klebermass等[14]推测可能与发育支持护理有关,该2项研究中大多数早产儿都给予发育支持护理。给予早产儿按摩,常规脑电图连续性百分比显著增加[23],其他的研究提示多种环境因素可影响早产儿和足月儿睡眠,如母乳喂养、噪音、光线、喂养方式、袋鼠护理和环境温度等[24~29]。多数研究均证实减少这些干扰因素,安静睡眠和活动睡眠增加。给予嘌呤类药物如氨茶碱等由于其中枢兴奋效应也可以加速脑的成熟过程[30]。本研究纳入的多数早产儿均没有给予发育支持护理,同样也观察到脑发育成熟加速现象。可以认为出生后脑发育成熟加速仅代表未成熟脑对宫外环境的一种适应性变化,这种成熟加速并不总是有益的。Scherjon等[31]推测在特定的环境状态下存在脑个体发育,加速或延迟这一过程都可能对将来的认知功能产生影响。
本研究的不足和局限性,①本研究为前瞻性多中心观察性研究,研究期间纳入的早产儿分析病例为非连续样本,造成非连续样本的原因主要来自于各参研医院没有指定专门医生负责符合纳入标准病例的aEEG检测。②未纳入<28周的早产儿。在中国由于考虑到远期预后的情况,多数父母亲对胎龄<28周的早产儿救治不积极,相关研究中包含胎龄<28周的早产儿,呈现随胎龄和纠正胎龄的增加,脑发育成熟度增加。③缺乏远期随访数据,新生儿早期进行头颅B超和MRI检查仅能代表稳定的、相对正常的早产儿[32]。
[1]Allen MC. Neurodevelopmental outcomes of preterm infants. Curr Opin Neurol, 2008,21(2):123-128
[2]Tao JD, Mathur AM. Using amplitude-integrated EEG in neonatal intensive care. J Perinatol, 2010,30:S73-81
[3]Hellström-Westas L. Comparison between tape-recorded and amplitude-integrated EEG monitoring in sick newborn infants. Acta Paediatr,1992,81(10):812-819
[4]Shellhaas RA, Gallagher PR, Clancy RR. Assessment of neonatal electroencephalography (EEG) background by conventional and two amplitude-integrated EEG classification systems. J Pediatr, 2008,153(3):369-374
[5]Clancy RR, Dicker L, Cho S, et al. Agreement between long-term neonatal background classification by conventional and amplitude-integrated EEG. J Clin Neurophysiol, 2011 ,28(1):1-9
[6]Hellström-Westas L, Rosén I, Svenningsen NW. Cerebral function monitoring during the first week of life in extremely small low birthweight (ESLBW) infants. Neuropediatrics, 1991,22(1):27-32
[7]Thornberg E, Thiringer K. Normal pattern of the cerebral function monitor trace in term and preterm neonates. Acta Paediatr Scand,1990,79(1):20-25
[8]Kuhle S, Klebermass K, Olischar M, et al. Sleep-wake cycles in preterm infants below 30 weeks of gestational age. Preliminary results of a prospective amplitudeintegrated EEG study. Wien Klin Wochenschr, 2001,113(7-8):219-223
[9]Olischar M, Klebermass K, Kuhle S, et al. Reference values for amplitude-integrated electroencephalographic activity in preterminfants younger than 30 weeks′ gestational age. Pediatrics, 2004,113(1 Pt 1):e61-66
[10]Burdjalov VF, Baumgart S, Spitzer AR. Cerebral function monitoring: a new scoring system for the evaluation of brain maturation in neonates. Pediatrics, 2003,112(4):855-861
[11]Hellström-Westas L, Rosén I, De Vries LS, et al. Amplitude- integrated EEG:classification and interpretation in preterm and term infants. Neoreviews, 2006;,7:e76-87
[12]Zhang D, Liu Y, Hou X, et al. Reference values for amplitude-integrated EEGs in infants from preterm to 3.5 months of age. Pediatrics,2011,127(5):e1280-1287
[13]Sisman J, Campbell DE, Brion LP. Amplitude-integrated EEG in preterm infants: maturation of background pattern and amplitude voltage with postmenstrual age and gestational age. J Perinatol, 2005,25(6):391-396
[14]Klebermass K, Kuhle S, Olischar M, et al. Intra- and extrauterine maturation of amplitude-integrated electroencephalographic activity in preterm infants younger than 30 weeks of gestation. Biol Neonate, 2006,89(2):120-125
[15]Herbertz S, Pulzer F, Gebauer C, et al. The effect of maturation and sedation on amplitude-integrated electroencephalogram of the preterm neonate: results of a prospective study. Acta Paediatr, 2006,95(11):1394-1399
[16]Soubasi V, Mitsakis K, Nakas CT, et al. The influence of extrauterine life on the aEEG maturation in normal preterm infants. Early Hum Dev, 2009,85(12):761-765
[17]van Sweden B, Koenderink M, Windau C, et al. Long-term EEG monitoring in the early premature: developmental and chronobiological aspects. Electroencephalogr Clin Neurophysiol, 1991,79(2):94-100
[18]Hellström-Westas L, Rosén I. Continuous brain-function monitoring: state of the art in clinical practice. Semin Fetal Neonatal Med, 2006,11(6):503-511
[19]Connell JA, Oozeer R, Dubowitz V. Continuous 4-channel EEG monitoring: a guide to interpretation, with normal values, in preterm infants. Neuropediatrics, 1987,18(3):138-145
[20]Scher MS, Johnson MW, Holditch-Davis D. Cyclicity of neonatal sleep behaviors at 25 to 30 weeks′ postconceptional age. Pediatr Res, 2005,57(6):879-882
[21]Vecchierini MF, d′Allest AM, Verpillat P. EEG patterns in 10 extreme premature neonates with normal neurological outcome: qualitative and quantitative data. Brain Dev, 2003,25(5):330-337
[22]Vecchierini MF, Andre M, d′Allest AM. Normal EEG of premature infants born between 24 and 30 weeks gestational age: terminology, definitions and maturation aspects. Neurophysiol Clin, 2007,37(5):311-323
[23]Guzzetta A, D′Acunto MG, Carotenuto M, et al. The effects of preterm infant massage on brain electrical activity. Dev Med Child Neurol, 2011,53(S4):46-51
[24]Zahr LK, de Traversay J. Premature infant responses to noise reduction by earmuffs:effects on behavioral and physiologic measures. J Perinatol, 1995,15(6):448-455
[25]Feldman R, Eidelman AI. Skin-to-skin contact (Kangaroo Care) accelerates autonomic and neurobehavioural maturation in preterm infants. Dev Med Child Neurol, 2003,45(4):274-281
[26]Anderson JW, Johnstone BM, Remley DT. Breast-feeding and cognitive development:a meta-analysis. Am J Clin Nutr, 1999,70(4):525-535
[27]Rao MR, Hediger ML, Levine RJ, et al. Effect of breastfeeding on cognitive development of infants bornsmall for gestational age. Acta Paediatr, 2002,91(3):267-274
[28]Myers MM, Fifer WP, Schaeffer L, et al. Effects of sleep positioning and time after feeding on the organization of sleep/wake states in prematurely born infants. Sleep, 1998,21(4):343-349
[29]Eggermont JJ, Komiya H. Moderate noise trauma in juvenile cats results in profound cortical topographic map changes in adulthood. Hear Res, 2000,142(1-2):89-101
[30]Lee HJ, Kim HS, Kim SY, et al. Effects of postnatal age and aminophylline on the maturation of amplitude-integrated electroencephalography activity in preterm infants. Neonatology, 2010,98(3):245-253
[31]Scherjon S, Briet J, Oosting H, et al. The discrepancy between maturation of visualevoked potentials and cognitive outcome at five years in very preterm infants with and without hemodynamic signs of fetal brain-sparing. Pediatrics, 2000,105(2):385-391
[32]Santos RS, Araújo AP, Porto MA. Early diagnosis of abnormal development of preterm newborns: assessment instruments. J Pediatr (Rio J),2008,84(4):289-299
(本文编辑:张崇凡)
Effect of amplitude integrated electroencephalogram on monitoring extrauterine life in preterm infants
Multi-centreCooperativeGroupofAmplitudeIntegratedElectroencephalogram:CHENGGuo-qiang1,5,HUYong2,5,ZHUANGDe-yi3,5,PANXin-nian4,5,WANGJi-mei2,5,SHAOXiao-mei1
(1DepartmentofNeonatology,Children′sHospital,FudanUniversity,theKeyLaboratory,MinistryofHealth,Shanghai201102; 2ShanghaiFirstMaternityandInfantHospital,TongjiUniversity,Shanghai200040; 3theFirstHospital,Xiamen,Fujian361003; 4MaternalandChildHealthHospital,Nanning530003,China; 5Co-firstauthor)
SHAO Xiao-mei,E-mail:xiaomei_shao@163.com
ObjectiveTo investigate the effect of amplitude integrated electroencephalogram (aEEG) on monitoring extrauterine life in healthy preterm infants with 28 to 36 weeks gestational age (GA).Methods The trail group was the preterm neonates without asphyxia, and the control group was the normal term neonates with GA over 37 weeks. Weekly aEEG recordings were performed on the trail group starting within 3 days after birth until discharged or up to 37 weeks postmenstrual age (PMA). In the control group, aEEG recording was performed on the third day after birth. All the aEEG recordings were continuously monitored for at least 4 hours. Analysis the influence of GA and PMA on the maturation process of aEEG patterns, including the continuity of background potential, the sleep-wake cycling (SWC), the lower border voltage a the bandwidth. The 5 hospitals in research used the same aEEG monitor brand, and received the unified operation training before the study. The data of clinical characteristics and aEEG images were analyzed by Children′s Hospital of Fudan University.ResultsFrom May 1, 2008 to August 31, 2009, 135 preterm infants and 20 term infants from 5 hospitals met the inclusion and exclusion criteria. With the increasing GA and PMA, the proportions of aEEG continuity and cycling increased, and appeared the continuous voltage gradually(χ2=26.865,P<0.01), almost all the preterm with GA≥34 weeks had the mature SWC (χ2=192.4,P<0.01), the lower border of narrow bandwidth was increased (F=11.4,P<0.01) and the bandwidth narrowing down(F=8.731,P<0.01). Compared with the infants with the same GA, the aEEG tracing showed significant increase in the proportions of continuity, the occurrence rate of SWC, the lower border and narrowing bandwidth. The preterm infants with GA≥34 weeks had significant SWC at birth, while the percentage of cycling had reached 100% in the infants with the PMA of 32 weeks. After a PMA of 34 weeks, there was no significant difference between the two groups.ConclusionThe maturity of aEEG patterns for preterm infants is related to GA and PMA. The extrauterine life accelerates brain maturation in preterm infants.
Preterm infants; Amplitude integrated electroencephalogram; Brain injury; Brain development
1 复旦大学附属儿科医院新生儿科,卫生部重点实验室 上海, 201102;2 同济大学附属上海市第一妇婴保健院(现工作于上海市儿童医院) 上海,200040;3 福建省厦门市第一医院 厦门, 361003;4 广西壮族自治区妇幼保健院 南宁,530003;5 共同第一作者
邵肖梅,E-mail:xiaomei_shao@163.com
10.3969/j.issn.1673-5501.2015.02.006
2014-12-22
2015-04-03)

