棘白菌素类药物的药动学和药效学指导临床用药优化
夏 迪, 施 毅关键词: 棘白菌素; 卡泊芬净; 米卡芬净; 阿尼芬净; 药动学; 药效学中图分类号:R978.5 文献标志码:A 文章编号:1009-7708(2015)04-0383-04
·综述·
棘白菌素类药物的药动学和药效学指导临床用药优化
夏 迪, 施 毅关键词: 棘白菌素; 卡泊芬净; 米卡芬净; 阿尼芬净; 药动学; 药效学中图分类号:R978.5 文献标志码:A 文章编号:1009-7708(2015)04-0383-04
免疫抑制人群的增加、抗菌药物的广泛应用、重症监护病房患者生存率的提高、诊断方法的改进等因素使诊断为真菌感染患者的数量显著增加。在抗真菌治疗过程中,多种宿主和医源性因素均会影响疾病的转归,其中药物选择、给药剂量和给药时间是众多因素的重要部分。因此,充分了解抗真菌药物的药动学和药效学特点,实现用药优化具有重要的临床意义。
抗真菌药物研究在过去的10年中发展迅速,使得侵袭性真菌感染的治疗有了多种选择。棘白菌素类是新近问世的一类抗真菌药物,美国感染病协会(IDSA)将其推荐用于既往使用过唑类药物或危重患者念珠菌感染的一线治疗和预防[1],也可用于两性霉素B及唑类药物耐药或不能耐受的侵袭性曲霉感染的二线治疗[2]。棘白菌素类药物对绝大部分念珠菌有良好的抗菌活性,尤其是光滑念珠菌,后者已成为念珠菌感染的常见致病菌。有学者认为在送检标本菌种及药敏结果出来之前,棘白菌素类可作为念珠菌感染的一线用药[3]。本文就该类新型抗真菌药物的药动学、药效学特点进行综述,为该类药物的合理应用提供一定的理论依据。
1 棘白菌素类药物的共同药动学、药效学特点
棘白菌素类抗真菌药物通过抑制真菌细胞壁β-1,3-葡聚糖合成,破坏细胞壁的完整结构,使细胞内外渗透压失衡,对念珠菌具有杀菌作用,对曲霉及肺孢子菌具有抑菌作用[4]。已应用于临床的棘白菌素类药物有卡泊芬净、米卡芬净和阿尼芬净,目前进入我国市场的只有卡泊芬净和米卡芬净2种。
3种棘白菌素类药物均为半合成脂肽类化合物,分子量大,口服生物利用度低,只能通过静脉给药。进入人体后能广泛分布于肝、肾、肺、脾等组织,但尚无相应的人体内分布率数据。脑脊液中浓度低,尿中检测不到有效药物浓度,因此,中枢神经系统和尿路真菌感染不建议使用棘白菌素类。棘白菌素为浓度依赖性药物,且有长效抗真菌后效应,其药物浓度时间曲线下面积(AUC)与最低抑菌浓度(MIC)的比值或血药峰浓度(Cmax)与MIC的比值是预测临床疗效的最佳药动学、药效学参数[5]。较长的清除半衰期和抗真菌后效应,使棘白菌素类只需每天给药1次。见表1。
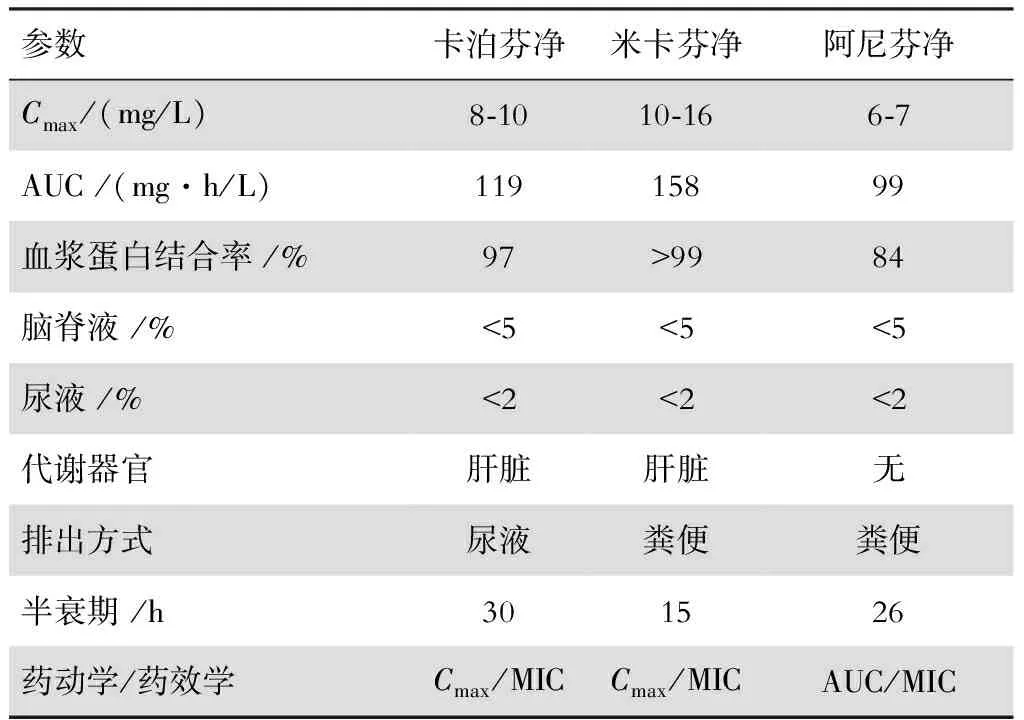
表1 棘白菌素类药物的主要药动学、药效学特点[6]
Cmax:血药峰浓度;AUC:药物浓度时间曲线下面积;MIC:最低抑菌浓度。
2 卡泊芬净的药动学、药效学研究与临床应用
卡泊芬净是第1个批准上市的棘白菌素类抗真菌药物,可用于念珠菌血流感染和其他念珠菌感染,长期发热、中性粒细胞减少患者的经验性抗真菌治疗,以及对其他抗真菌药物耐药或不能耐受的侵袭性曲霉感染。卡泊芬净的早期药效学参数研究发现,血浆药物浓度达1 mg/L是治疗念珠菌感染的有效目标浓度。在一项探索卡泊芬净给药剂量的药动学、药效学研究中,连续14 d给予健康志愿者每日15~70 mg不等的剂量,结果显示仅有70 mg组血药浓度始终在1 mg/L以上,而50 mg组在给药3 d后血药浓度可维持在有效目标浓度以上。进一步研究发现,若首次给药70 mg,之后每日给予50 mg的维持量即可保证血药浓度始终在有效治疗浓度以上[7]。因此,目前卡泊芬净首剂70 mg,次日起每日50 mg维持的临床推荐给药方案治疗念珠菌感染是合理的,首剂负荷能使机体迅速达到有效的稳态血药浓度,维持量则能以最小的剂量保证疗效。
作为浓度依赖性抗真菌药物,增加剂量是否能增加疗效?为此,Betts等[8]在侵袭性念珠菌病成人患者中进行的一项多中心、双盲、随机对照试验中,提高每日卡泊芬净给药剂量至150 mg,并与首次70 mg,之后每日50 mg进行比较,虽然不良反应发生率未增加,但临床疗效也未见明显提高,两组结果相似。研究表明,虽然卡泊芬净体外抗菌作用呈浓度依赖性,但盲目增加给药剂量并不能增加临床获益。Nguyen等[9]证明,卡泊芬净血药浓度与患者体重及血浆白蛋白水平密切相关,体重>75 kg和低蛋白血症的患者,卡泊芬净血浆谷浓度显著降低。有作者建议,当患者体重>80 kg时,给药剂量应增加至70 mg/d。对于年龄超过65岁的老年人,卡泊芬净给药后AUC增加约28%,但尚无进一步研究证实老年人用药需进行剂量调整。
虽然卡泊芬净是唯一被批准用于治疗侵袭性曲霉感染的棘白菌素类药物,但表现为抑菌作用,且总体治疗有效率偏低,因此侵袭性曲霉感染仍不是卡泊芬净的主要适应证。在治疗曲霉等丝状真菌时,卡泊芬净浓度依赖的抑菌作用及各项药动学、药效学参数需要进一步研究确定。
3 米卡芬净的药动学、药效学研究与临床应用
米卡芬净首先在日本上市,2005年经FDA批准,可用于治疗食管念珠菌病和侵袭性念珠菌感染,也可用于预防造血干细胞移植患者念珠菌感染。米卡芬净用药3 d后才能达到稳态血药浓度,且增加剂量未能明显缩短其达稳态浓度的时间,这种特性可能是其首剂无需给予负荷剂量的原因。关于米卡芬净治疗成人念珠菌感染的推荐给药剂量,各个国家和地区存在差异,尚无统一标准。在日本,通常50 mg一次给药,最大剂量可达300 mg/d。在美国,50 mg/d的剂量用于预防造血干细胞移植受者的念珠菌感染,而150 mg/d用于治疗食管念珠菌病。在欧洲,患者体重>40 kg时,预防用药剂量为50 mg/d,治疗侵袭性念珠菌病剂量为100 mg/d,治疗食管念珠菌病剂量也为150 mg/d[10]。血液系统恶性肿瘤患者血浆药物浓度的药动学、药效学研究显示,50 mg/d可有效抑制念珠菌生长,而100 mg/d 的剂量才能清除念珠菌,且每天1次给药与每天2次给药效果相似[10]。因此,在此类高危患者中,可用50 mg/d的剂量预防念珠菌感染,而100~150 mg/d则作为治疗剂量。一项临床研究比较了100 mg/d与150 mg/d 2种剂量的米卡芬净治疗系统性念珠菌感染的疗效,结果两者差异无统计学意义[11]。因此,临床常规推荐100 mg/d治疗播散性念珠菌感染是合理的。但迄今为止,仍缺乏与更高剂量组进行比较的临床试验,例如比较100 mg/d组与推荐的最高剂量300 mg/d组之间的疗效。治疗过程中需根据患者感染部位、病情严重程度、治疗反应性等多方面因素进行适当的剂量调整。
与卡泊芬净类似,患者体重会对米卡芬净药动学参数产生影响。对62例使用米卡芬净患者的药动学参数分析发现,患者体重超过66.3 kg时,米卡芬净血浆清除率增加50%,因此要达到正常体重患者100 mg/d给药剂量下的AUC值,建议该类患者给药剂量需增加至150 mg/d[12]。年龄超过75岁的老年患者使用米卡芬净时,药动学参数与不良反应发生率较年轻患者无显著变化,因此,老年患者用药无需调整剂量[13]。
4 阿尼芬净的药动学、药效学研究与临床应用
阿尼芬净是最近应用于临床的棘白菌素类药物,用于治疗食管念珠菌病、念珠菌血流感染和其他形式的念珠菌感染,对唑类和多烯类耐药的念珠菌属亦有很强的抗菌作用。一次负荷剂量即可达到稳态血药浓度。该药尚未进入我国,国外治疗念珠菌血流感染时建议首日给予负荷剂量200 mg,以后100 mg/d,治疗食管念珠菌病则100 mg负荷剂量后以50 mg/d维持。
对262例真菌感染患者的群体性药动学、药效学分析显示,阿尼芬净的给药方案与体重无关,但药物的AUC值随着患者体重的增加而下降,当患者体重超过150 kg时需考虑是否进行剂量调整[14]。由于阿尼芬净的用药阈值尚未确定,因此增加给药剂量需慎重。阿尼芬净在超过65岁的重症监护病房患者中应用,常规剂量治疗念珠菌血流感染和侵袭性念珠菌感染的有效性和安全性好[15]。
5 器官功能不全患者的临床用药调整
患者若出现器官功能不全往往提示病情危重,尤其是合并真菌感染时,根据药物的药动学、药效学参数特点,合理调整给药剂量对患者预后至关重要,此类患者用药剂量调整见表2。
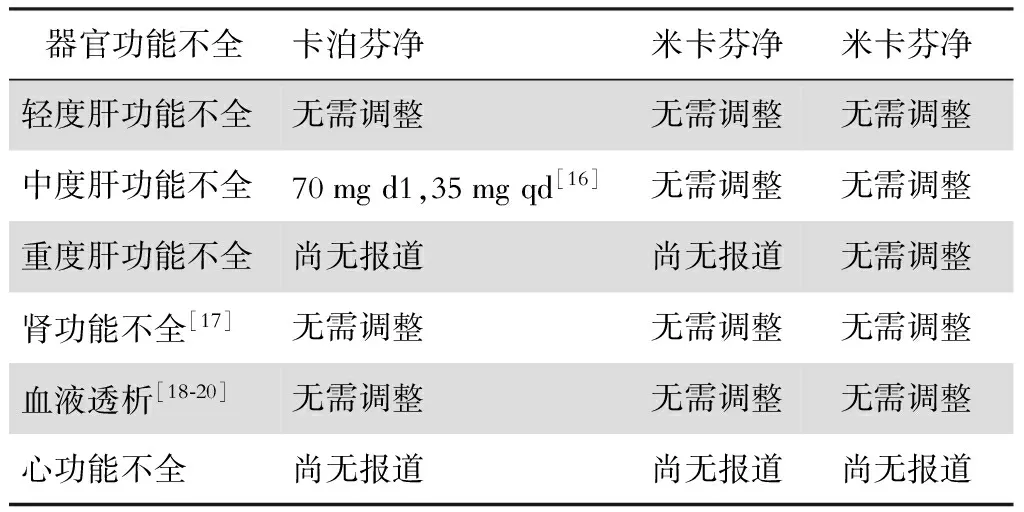
表2 器官功能不全患者使用棘白菌素类药物时的剂量调整
肝功能不全患者真菌感染使用卡泊芬净治疗时,实施剂量调整必须慎重权衡利弊,并建议进行药物监测,但目前国内外尚无卡泊芬净药物监测的范围标准[21]。此外,对于心功能不全患者使用棘白菌素类药物,虽然暂无研究提示需进行剂量调整,但近来已有报道,少数患者使用棘白菌素类药物后心脏指数显著下降[22],并出现血流动力学不稳[23],提示心功能不全患者在使用此类药物时必须进行密切的临床及血流动力学监测。
6 药物相互作用
棘白菌素类药物不是细胞色素P450酶家族的良好底物,且很少经肾脏排泄,因此在临床使用中,药物相互作用少见,是迄今为止安全性最高的一类抗真菌药物,但仍有一些药物相互作用需要注意。总体来说,阿尼芬净的药物间相互作用最少,卡泊芬净相对较多。研究发现卡泊芬净与环孢素合用时,环孢素血药浓度未发生变化,但由于环孢素相关肝细胞摄取卡泊芬净能力下降,卡泊芬净AUC升高约35%,可能导致肝酶暂时性升高,只有在患者获益大于风险时才考虑联合使用[24]。与利福平、卡马西平、苯妥英、地塞米松联合应用时,卡泊芬净血药浓度下降,建议增加剂量至70 mg/d[25]。与他克莫司联合使用时,后者AUC降低约25%,需要监测血药浓度[25]。
米卡芬净与环孢素联用时,米卡芬净的药动学参数不发生变化,但由于其轻度抑制CYP3A酶,而该酶是环孢素代谢的主要酶,导致敏感患者环孢素清除减慢,因此需监测血药浓度[26]。与西罗莫司、硝苯地平联合治疗时,米卡芬净药动学参数也不受影响,但西罗莫司的AUC增加21%,Cmax无变化;硝苯地平的AUC和Cmax分别增加18%和42%,需要观察这2种药物的不良反应,必要时减少药物使用剂量[25]。
阿尼芬净在血中通过非酶降解途径缓慢清除,不涉及肝、肾代谢,尚无药物相互作用的报道。
棘白菌素类药物因其显著的杀菌活性和极低的不良反应及药物相互作用,越来越受到重视,尤其是在危重患者真菌感染的治疗过程中。掌握该类药物的药动学、药效学特点,结合临床患者实际情况,优化给药剂量和给药时间,做到安全、有效、合理的个体化给药,避免抗真菌药物滥用,可以在增加疗效的同时,避免和减轻不良反应,防止耐药性的产生。
[ 1 ] Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009,48(5):503-535.
[ 2 ] Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: Clinical practice guidelines of the Infectious Diseases Society of America[J]. Clin Infect Dis, 2008,46(3):327-360.
[ 3 ] Andes D. Optimizing antifungal choice and administration[J]. Curr Med Res Opin, 2013,29 (Suppl 4):13-18.
[ 4 ] Emri T, Majoros L, Toth V, et al. Echinocandins: Production and applications[J]. Appl Microbiol Biotechnol, 2013,97(8):3267-3284.
[ 5 ] Sinnollareddy M, Peake SL, Roberts MS, et al. Using pharmacokinetics and pharmacodynamics to optimise dosing of antifungal agents in critically ill patients: A systematic review[J]. Int JAntimicrob Agents, 2012,39(1):1-10.
[ 6 ] Lewis RE. Current concepts in antifungal pharmacology[J]. Mayo Clinic Proc, 2011,86(8):805-817.
[ 7 ] Stone JA, Holland SD, Wickersham PJ, et al. Single-and multiple-dose pharmacokinetics of caspofungin in healthy men[J]. Antimicrob Agents Chemother, 2002,46(3):739-745.
[ 8 ] Betts RF, Nucci M, Talwar D, et al. A multicenter, double-blind trial of a high-dose caspofungin treatment regimen versus a standard caspofungin treatment regimen for adult patients with invasive candidiasis[J]. Clin Infect Dis, 2009,48(12):1676-1684.
[ 9 ] Nguyen TH, Hoppe-Tichy T, Geiss HK, et al. Factors influencing caspofungin plasma concentrations in patients of a surgical intensive care unit[J]. J Antimicrob Chemother, 2007,60(1):100-106.
[10] Ikawa K, Nomura K, Morikawa N, et al. Assessment of micafungin regimens by pharmacokinetic-pharmacodynamic analysis: A dosing strategy for aspergillus infections[J]. J Antimicrob Chemother, 2009,64(4):840-844.
[11] Pappas PG, Rotstein CM, Betts RF, et al. Micafungin versus caspofungin for treatment of candidemia and other forms of invasive candidiasis[J]. Clin Infect Dis, 2007,45(7):883-893.
[12] Gumbo T, Hiemenz J, Ma L, et al. Population pharmacokinetics of micafungin in adult patients[J]. Diagn Microbiol Infect Dis, 2008,60(3):329-331.
[13] Hope WW, Howard SJ, Felton TW. Clinical utility of micafungin: pharmacokinetics, dosing, use in special populations and drug interactions[J]. Mycoses, 2012,55(Suppl 1):33-38.
[14] Liu P. Population pharmacokinetic-pharmacodynamic analysis of anidulafungin in adult patients with fungal infections[J]. Antimicrob Agents Chemother, 2013,57(1):466-474.
[15] Dimopoulos G, Paiva JA, Meersseman W, et al. Efficacy and safety of anidulafungin in elderly, critically ill patients with invasive candida infections: A post hoc analysis[J]. Int J Antimicrob Agents, 2012,40(6):521-526.
[16] Mistry GC, Migoya E, Deutsch PJ, et al. Single-and multiple-dose administration of caspofungin in patients with hepatic insufficiency: Implications for safety and dosing recommendations[J]. J Clin Pharmacol, 2007,47(8):951-961.
[17] Glockner A, Steinbach A, Vehreschild JJ, et al. Treatment of invasive candidiasis with echinocandins[J]. Mycoses, 2009,52(6):476-486.
[18] Cota JM, Burgess DS. Antifungal dose adjustment in renal and hepatic dysfunction: Pharmacokinetic and pharmacodynamic considerations[J]. Curr Fungal Infect Rep, 2010,4(2):120-128.
[19] Leitner JM, Meyer B, Fuhrmann V, et al. Multiple-dose pharmacokinetics of anidulafungin during continuous venovenous haemofiltration[J]. J Antimicrob Chemother, 2011,66(4):880-884.
[20] Aguilar G, Carbonell JA, Ferrando C, et al. Echinocandins in a critically ill patient during continuous venovenous renal replacement[J]. Rev Iberoam Micol, 2012,29(2):85-89.
[21] Ashbee HR, Barnes RA, Johnson EM, et al. Therapeutic drug monitoring (TDM) of antifungal agents: Guidelines from the British Society for Medical Mycology[J]. J Antimicrob Chemother, 2014,69(5):1162-1176.
[22] Lichtenstern C, Wolff M, Arens C, et al. Cardiac effects of echinocandin preparations-three case reports[J]. J Clin Pharm Ther, 2013,38(5):429-431.
[23] Fink M, Zerlauth U, Kaulfersch C, et al. A severe case of haemodynamic instability during anidulafungin administration[J]. J Clin Pharm Ther, 2013,38(3):241-242.
[24] Morris MI, Villmann M. Echinocandins in the management of invasive fungal infections[J]. Am J Health System Pharm, 2006,63(18):1693-1703.
[25] 张树敬, 杨帆. 棘白菌素类药物[J]. 中国感染与化疗杂志, 2012,12(5):393-396.
[26] Hebert MF, Townsend RW, Austin S, et al. Concomitant cyclosporine and micafungin pharmacokinetics in healthy volunteers[J]. J Clin Pharmacol, 2005,45(8):954-960.
Pharmacokinetics and pharmacodynamics of echinocandins for optimizing regimen in clinical practice
XIADi,SHIYi
. (DepartmentofRespiratoryandCriticalCareMedicine,ClinicalSchoolofNanjingUniversityMedicalCollege,Nanjing210002,China)
国家自然科学基金(81270064)。
南京大学医学院临床学院,南京军区南京总医院呼吸与危重症医学科,南京 210002。
夏迪(1988—),女,硕士研究生,主要从事呼吸内科疾病的诊断和治疗。
施毅,E-mail: shiyi56@126.com。
2014-06-18
2014-07-29

