酶标抗原直接竞争ELISA方法检测呋喃唑酮代谢物残留
樊晓博,徐社会,蒋 宝,柴喜春
(1.渭南职业技术学院渭南市农产品食品检验检测研究中心,陕西渭南 714000;2.广州瑞森生物科技有限公司,广东广州 511400)
酶标抗原直接竞争ELISA方法检测呋喃唑酮代谢物残留
樊晓博1,徐社会2,蒋 宝1,柴喜春1
(1.渭南职业技术学院渭南市农产品食品检验检测研究中心,陕西渭南 714000;2.广州瑞森生物科技有限公司,广东广州 511400)
采用酶标抗原建立了高效、高灵敏的呋喃唑酮代谢物直接竞争的ELISA检测方法。以呋喃唑酮单克隆抗体包被作为固相抗体,HRP标记的抗原与标准品(或样品)中呋喃唑酮的代谢物衍生物竞争结合抗体,建立了直接竞争酶联免疫检测体系。以3-氨基-2-恶唑烷酮的衍生物(CPAOZ)为标准品建立标准曲线,得到方法的IC50为0.08 μg/L,灵敏度为0.015 μg/L,线性范围0.025~0.5 μg/L;检测样品的平均回收率为82.0%~121.0%,与其他结构类似物基本无交叉反应。建立呋喃唑酮酶标抗原直接竞争酶联免疫检测方法,灵敏度高、特异性强、操作简单,可以满足畜禽水产实际样品的检测需要。
呋喃唑酮,3-氨基-2-恶唑烷酮,酶标抗原,直接竞争酶联免疫吸附检测
呋喃唑酮是人工合成的光谱抗菌药,属于硝基呋喃类药物,因其具有抗病菌[1]、防止感染[2]等作用在养殖业中广泛应用,也作为预防畜禽和水产肠道疾病的饲料添加剂[3-6]使用,硝基呋喃类药物残留已引起民众广泛关注[7-8]。呋喃唑酮为致癌药物,被动物服用后,硝基呋喃类药物在食品中代谢产物会具有潜在的毒理性危害[9-10],普通的食品加工方法,如烧烤、微波加工、烹调等,均难以使其降解,对人类健康造成严重的威胁[11]。硝基呋喃类药物在欧盟列为A类禁用药物,规定在鱼、虾等水产品中不得检出[12-15],我国农业部 2002文件也要求在动物源食品中不得检出硝基呋喃类药物[16]。
目前硝基呋喃类药物的检测主要有仪器方法,如超高效液相色谱法(UHPLC)[17]、液相色谱-质谱联用(HPLC-MS)[18-20]和酶联免疫吸附检测法(ELISA)[21]等。仪器法比较准确,但操作繁琐,设备昂贵,难以满足现场检测的需要。酶联免疫检测方法基于抗原抗体具有高度特异性,操作简单、准确,检测样大,弥补仪器法的不足,非常适用于样品快速筛查。目前,国外有报道建立高灵敏度的AOZ直接竞争ELISA方法[22-23],但国内ELISA技术在检测呋喃唑酮残留方面的研究多采用间接竞争的方法,其检测灵敏度普遍不如高效液相色谱法及其联用技术[24]。本研究通过酶标记抗原,固相包被抗体,建立了直接竞争AOZ-ELISA检测方法,显著提高了方法的稳定性和灵敏度,通过对不同样品的检测,验证了方法的准确性。
1 材料与方法
1.1 材料与仪器
呋喃唑酮代谢物(AOZ)、辣根过氧化物酶(HRP) Sigma公司;呋喃它酮、呋喃西林、呋喃妥因代谢物标准品 百灵威化学;CPAOZ-OVA(Ovalbumin)、抗CPAOZ单克隆抗体本实验室自制;96孔微量反应板 雷博公司;其它化学试剂均为国产市售分析纯。
G16-2恒温培养箱 美国SHELL LAB;P200微量可调移液枪 吉尔森公司;Wellwash MK-2洗板机、MK-3酶联免疫检测仪 美国Thermo公司;恒温振荡器 上海智城分析仪器制造有限公司;1-13型快速离心机 Sigma公司;dc-12型水浴氮吹仪 上海安普科学仪器有限公司。
1.2 实验方法
1.2.1 CPAOZ标准曲线的配制 CPAOZ以甲醇配制成质量浓度10 mg/L溶液,用PBS(0.01 mol/L,pH7.4))稀释到500 μg/L作为标准贮备液。使用前配制成质量浓度梯度为0、0.025、0.05、0.1、0.2、0.5 μg/L的CPAOZ的标准工作曲线。
1.2.2 CPAOZ-OVA酶标记物的制备 参考文献[25]溶解5 mg HRP于1 mL 0.2 mol/L醋酸盐缓冲液(pH5.6)中,加入新配置的0.1 mol/L过碘酸钠0.5 mL,置4 ℃冰箱反应30 min。反应完后加0.5 mL 2.0%的乙二醇,4 ℃反应30 min。向活化的酶溶液中加入0.5 mL 3 mg/mL CPAOZ-OVA(10%甲醇溶解)溶液混匀,于4 ℃先用蒸馏水透析2次,再换用0.01 mol/L PBS(pH7.4)透析2 d。透析完毕后取出,3000 r/min离心30 min,除去沉淀,上清液即为酶标记物。
1.2.3 固相包被抗体制备 将CPAOZ单克隆抗体用碳酸盐缓冲液(0.05 mol/L,pH9.6)稀释至0.1 mg/L,96孔微孔板中各加入200 μL,37 ℃放置过夜,弃去包被液,加入封闭液,每孔20 μL,封闭3 h。弃去封闭液,烘干,备用。
1.2.4 酶标记物效价测定 取包被单克隆抗体的板条,将制备好的酶标记物从1:100开始倍比稀释,每孔加入100 μL,室温反应30 min,再加入100 μL底物溶液显色,室温避光20 min,终止后,酶标仪以单波长450 nm测吸光值。以蒸馏水做空白对照。
1.2.5 反应条件优化 将CPAOZ单克隆抗体1∶1000、1∶2000、1∶4000、1∶6000 4种稀释度包被,加入50 μL标准品和100 mL稀释度为1∶1000的酶标记物,确定最佳包被稀释度。用最佳包被稀释度包板,加入50 μL标准品和质量浓度为0.1、0.4、0.8、1.6 mg/L的酶标记物,确定最佳的酶标记物浓度。
1.2.6 直接竞争AOZ-ELISA操作步骤 取包被好的板条,加入50 μL标准品(或处理好的样品)到相应的微孔中,加入分析缓冲液稀释的酶标记物100 μL,室温避光反应30 min,将微孔中的反应液甩掉,再将清洗液加满每一微孔后甩掉,重复洗3次。在每一微孔加入底物溶液100 μL后,在室温下避光静置20 min。每一微孔加入100 μL反应终止液,酶标仪以单波长450 nm判读。
1.2.7 样品处理
1.2.7.1 测物为组织(鱼肉、虾肉,鸡肉) 衍生反应:取1 g均质样品于离心管中,加入4 mL H2O和0.5 mL HCl及100 μL衍生试剂。振荡混合1 min。置于37 ℃烘箱静置过夜(约16 h)。
萃取流程:加入5 mL 0.1 mol/L K2HPO4,0.4 mL NaOH,5 mL乙酸乙酯。振荡混合约1 min。离心10 min(3000 r/min)。取2 mL上层溶液(乙酸乙酯层)至10 mL玻璃瓶中。于50 ℃下,利用氮气将乙酸乙酯层快速吹干。加入1 mL正己烷,先将残余物完全溶解,再加入1.6 mL PBS,3000 r/min离心10 min。取下层溶液进行检测。样品稀释倍数为4。
1.2.7.2 待测物为生乳 生乳需先离心10 min(3000 r/min),避开上层乳脂,取下层液1 mL置入离心管中,加入4 mL H2O和0.5 mL 1 mol/L HCl及100 μL衍生试剂,其余歩骤同组织。
1.2.7.3 待测物为蜂蜜 取1 mL蜂蜜样品置入离心管中,加入1 mL H2O,0.5 mL 1 mol/L HCl,10 mL正己烷。振荡混合约1 min,用离心机离心10 min(3000 r/min),置于-20 ℃冷冻60 min。移去上层液后,50 ℃水浴,将冷冻层融化。加入50 μL衍生试剂,振荡混合约1 min。其他步骤同组织样。
1.2.8 考核指标 灵敏度:以10%抑制率的对应浓度作为最低检测限(LOD),抑制率20%~80%作为定量线性检测范围。

式(1)
式中,B为标准溶液或样本溶液的平均吸光度值,B0为0浓度的平均吸光度值。
特异性:将AOZ的结构类似物呋喃它酮、呋喃西林、呋喃妥因及其衍生物配成不同质量浓度的溶液,采用ELISA方法检测其IC50,计算交叉反应率。

式(2)
回收率:向各种阴性样品中分别添加不同质量浓度的AOZ标准品,处理后用ELISA方法检测,每个浓度作3个平行测定。
1.2.9 进口试剂盒检测结果对比 与德国拜发ELISA试剂盒检测相同的样品,对结果进行比较。两种试剂盒分别对相同的样品进行检测,计算拜发试剂盒检测样品的回收率,以拜发试剂盒检测结果为参考计算试剂盒样品检测回收率。
2 结果与分析
2.1 HRP-CPAOZ-OVA酶标记物效价测定
由图1可知,酶在标记抗原的过程中,酶活损失较小,标记后酶活力很高,酶标记物效价都在1∶101200以上,可以满足后期检测的要求。

图1 酶标记物效价曲线(n=3)Fig.1 Titer determination curve of enzyme labled antigen(n=3)
2.2 反应条件优化
抗原和抗体的质量浓度对免疫检测方法的灵敏度和特异性有重要的影响,因此有必要对抗体和抗原的浓度进行优化。
2.2.1 最佳抗体稀释度的确定 以最高OD值(Amax)、IC50和Amax/IC50为综合参考指标,由图2可知,最高OD值与包被抗体浓度呈正比,抗体浓度过高时,抗体与酶标抗原结合过多,方法的灵敏度下降。当抗体稀释倍数2000时,与稀释倍数4000时IC50比较接近,但稀释4000倍表示灵敏度的Amax/IC50数值最大,灵敏度最高,其最高OD值也在适宜的范围内,所以选择包被抗体的稀释度为4000。

图2 包被抗体稀释度曲线Fig.2 Dilution curve of antibody
2.2.2 最佳酶标抗原浓度确定 选择包被抗体稀释度为1∶4000,选择不同浓度的酶标抗原做直接竞争ELISA实验,结果如图3所示。随着酶标抗原的浓度降低,最高OD值随之下降,在酶标抗原浓度为0.8 mg/L时,Amax值在适宜的范围内,IC50值最小,Amax/IC50最大,此浓度下体系的灵敏度最高。故选择此浓度为最佳的酶标抗原浓度。

图3 酶标抗原浓度曲线Fig.3 Concentration curve of HRP-CPAOZ-OVA
2.3 AOZ-ELISA方法考核
2.3.1 方法灵敏度 在优化条件下,以标准溶液质量浓度(0、0.025、0.05、0.1、0.2、0.5 μg/L)的对数值做横坐标,以抑制率为纵坐标绘制标准曲线,如图4所示。

图4 AOZ-ELISA标准曲线(n=3)Fig.4 Standard curve of AOZ-ELISA(n=3)
在一系列条件优化的基础上方法LOD(IC10)为0.015 μg/L,IC50为0.08 μg/L,线性检测范围0.025~0.5 μg/L,R2=0.9902,线性关系良好。
2.3.2 方法特异性 将AOZ的结构类似物及其衍生物配成不同质量浓度的溶液作为被测物,采用ELISA方法测定其IC50。结果如表1所示,与呋喃妥因衍生物的交叉反应率为0.5%,与其他结构类似物基本没有交叉反应,说明抗体对AOZ衍生物特异性很高。

表1 交叉反应率的测定
2.3.3 方法准确度 样品加标回收率是评价ELISA检测方法准确度的一个重要指标。对样品进行检测时,由于抗体对AOZ基本不识别,所以需要对样品进行衍生化处理,以对醛基苯甲酸作为衍生试剂使药物转化成衍生产物。添加回收实验中,模拟实际样品,向待测样品中添加AOZ标准品。根据方法的检测限及稀释倍数添加浓度为0.4、1.0和1.5 μg/kg,检测样品分别为鱼肉、虾肉、鸡肉、生乳和蜂蜜。由表2可见,组织样品和生乳样品添加回收率在80%~120%之间,蜂蜜样品添加回收率在82.0%~121.0%之间,符合检测的要求,说明该方法重复性好,准确度高,满足实际样品的检测要求。
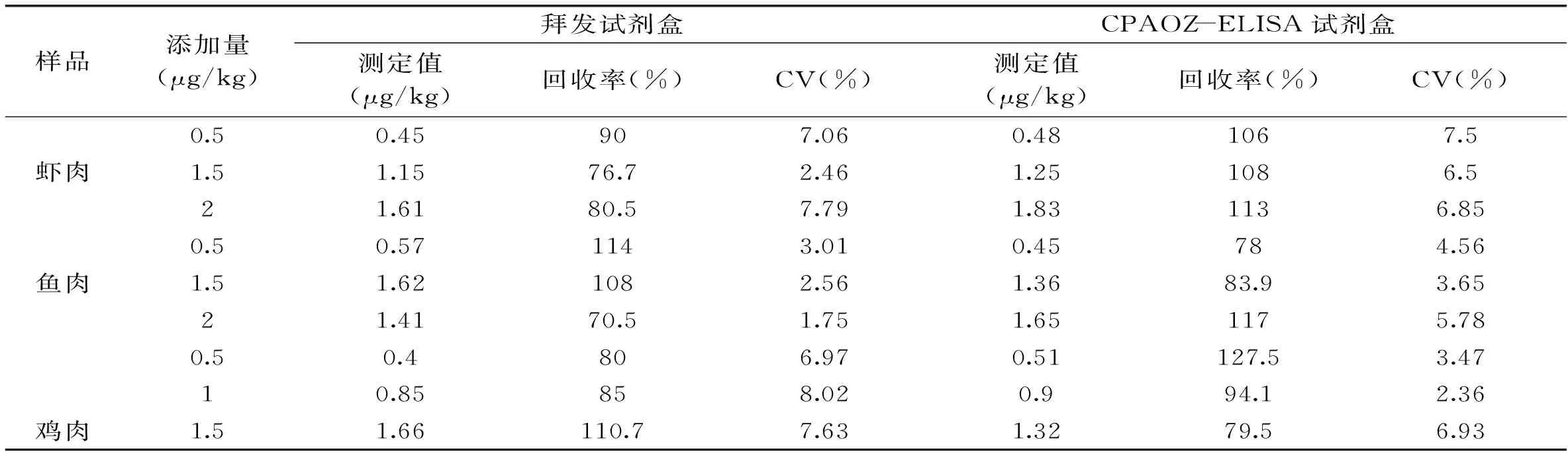
表3 两种试剂盒检测结果比较

表2 回收率实验结果
2.3.4 检测结果对比 采用德国拜发呋喃唑酮试剂盒检测相同的样品,与本研究建立的ELISA方法比较,确定其回收率,检测方法的可信度。以拜发ELISA试剂盒的检测结果为依据计算回收率,结果如表3所示,回收率在可接受的范围内,两种方法对相同样品的测定值接近,建立直接竞争ELISA的方法结果准确、可靠。
3 结论
本研究利用辣根过氧化物酶成功标记抗原,标记后酶标记物的效价可以满足检测要求,建立了直接竞争呋喃唑酮酶联免疫分析方法。该方法包被抗原的稀释倍数为4000,酶标抗原的工作浓度为0.8 mg/L;在CPAOZ质量浓度在0.025~0.5 μg/L时有较好的线性关系,检测限为0.015 μg/L,IC50为0.08 μg/L,与其他结构类似物不存在交叉反应,实际样品检测平均回收率在82.0%~121.0%之间。相比现有的酶联免疫检测方法,本方法检测速度快、灵敏度和稳定性有了明显的提高,与进口试剂盒进行比较,检测结果准确可靠,可以满足现有的检测需要,具有良好的应用前景。
[1]Dodd M C,Stillman W B. Theinvitrobacteriostatic action of some simple furan derivatives[J]. Pharmacol. Exp. Chemomother,1944,82:11-18.
[2]Snyder M L,Kiehn C L,Christopherson,JW. Effectiveness of a nitrofuran in the treatment of infection wounds I. Preliminary report[J]. Milit. Surg.,1945,pp.380-384.
[3]Cooper K M,Caddell A,Elliott C T,et al. Pruduction and characterization of polyclonal antibodies to derivative of 3-amino-2-oxazolidinone,a metabolite of the nitrofuran furazolidone[J].Analytica Chimica Acta,2004,520:79-86.
[4]李书国,李雪梅,陈辉,等. 动物性食品安全和HACCP[J]. 食品科学,2003,24(8):217-220.
[5]佟恒敏,李艳华,韩建春. 我国动物性食品中兽药残留的现状及危害[J]黑龙江畜牧兽医2003,11:61-62.
[6]徐维海,林黎明,朱校斌. HPLC/MS法对呋喃唑酮及其代谢物在罗非鱼体内残留研究[J]. 上海水产大学学报,2005,34(8):23-25.
[7]Radovnikovic A,Conroy E R,Gibney M,et al. Residue analyses and exposure assessment of the Irish population to nitrofuran metabolites from different food commodities in 2009-2010[J]. Food Additives & Contaminants:Part A,2013,30(11):1858-1869.
[8]O'Keeffe M,Conneely A,Cooper K M,et al. Nitrofuran antibiotic residues in pork[J]. Analytica Chimica Acta,2004,520(1-2):125-131.
[9]Koten-vermeulen JEM V,Wouters MFA,Leuven FXR V. Report of the 40thMeeting of Joint FAO/WHO Expert Committee on Food Additives[J]. World Health Organization,Geneva,WHOTRS,1993:85.
[10]Bartel L C,Montalto de Mecca M,Castro J A. Nitro reductive metabolic activation of some carcinogenic nitro heterocyclic food contaminants in rat mammary tissue cellular fractions[J]. Food and Chemical Toxicology,2009,47(1):140-144.
[11]Craken R J,Kennedy D G. The bioavailability of residues of the furazolidone metabolite 3-amino-2-oxazo-lidinone in porcine tissues and the effects of cooking upon residue concentration[J]. Food Additives and Contaminants,1997,14:507-513.
[12]Council Regulation(EEC)2377/90[Z]. Off J Eur Commun,L224(1990)1.
[13]Council Regulation(EEC)1442/9590[Z]. Off J Eur Commun,L143(1995)26.
[14]Commission Decision(EC)2003/181[Z]. Off J Eur Commun,L71(2003)17.
[15]Commission Decision(EC)2003/181[Z]. Off J Eur Commun,L29(2003)44.
[16]中华人民共和国农业部公告. 193-2002食品动物禁用的兽药及其它化合物清单[S]. 北京:农业部,2002.
[17]Kaufmann A,Butcher P,Maden K,et al. Determination of Nitrofuran and Chloramphenicol Residues by High Resolution Mass Spectrometry versus Tandem Quadrupole Mass Spectrometry[J]. Analytica Chimica Acta,2015,863:41-52.
[18]Chumanee S. Sutthiviyakit S,Sutthivaiyakit P. New reagent for trace determination of protain-bound metabolites of nitrofurans in shrimp using liquid chromatography with diode array detector[J]. Journal of Agricultural and Food Chemistry,2009,57(5):1752-175.
[19]Noelia M V T,Patricia P B,Roberto R G,et al. Determination of nitrofuran metabolites in seafood by ultra high performance liquid chromatography coupled to triple quadrupole tandem mass spectrometry[J]. Journal of Food Composition and Analysis,2013,30(2):86-93.
[20]Douny C,Widart J,Pauw E D,et al. Development of an analytical method to detect metabolites of nitrofurans[J]. Aquaculture,2013,376-379:54-58.
[21]Cheng C C,Hsien K H,Lei Y C,et al. Development and residue screening of the furazolidone metabolite,3-amino-2-oxazolidinone(AOZ),in cultured fish by an enzyme-linked immumosorbent assay[J]. Journal of Agricultural and Food Chemistry,2009,57(13):5687-5692.
[22]Vass M,Kotkova L,Dibikova I,et al. Production and characterization of metabolite of furazolidone[J]. Veterinarni Medicina,2005,50(7):300-310.
[23]Diblikova I,Cooper K M,Kennedy D G,et al. Monoclonal antibody-based ELISA for the quantification of quantification of nitrofuran metabolite 3-amino-2-oxazolidinone in tissues using a simplified sample preparation[J]. Analytica Chimica Acta,2005,540:285-292.
[24]邹龙,刘师文,许杨. 硝基呋喃类药物及其代谢产物残留检测技术研究进展[J]. 食品工业科技,2011,32(9):464-471.
[25]王黎丽,余为一. 2种制备三聚氰胺酶标抗原方法的比较[J]. 安徽农业科学,2011,39(22):13273-13274.
Direct competitive ELISA with HRP labeled antigen for determination of furazolidone metabolite residues
FAN Xiao-bo1,XU She-hui2,JIANG Bao1,CHAI Xi-chun1
(1.Weinan Testing & Inspection and Research Center of Agricultural Products and Food,Weinan Vocational & Technical College,Weinan 714000,China;2.Guangzhou Ruisen Biotechnology Corporation,Guangzhou 511400,China)
In this study,a rapid and high sensitive direct competitive enzyme-linked immunoassay(dc-ELISA)method based on the antigen labeled by Horseradish Peroxidase(HRP)was established,which could be applied to the detection of 3-amino-2-oxazolidinone(AOZ)that is a metabolite of furazolidone in real sample. In the direct competitive assay,monoclonal antibody was bound on the surface of a microtiter plate,then the standards(or the sample)competed with CPAOZ antigen for the antibody binding sites. Calibration curve was prepared for 3-{[(4-carboxyphenyl)methylene]amino}-2-oxazolidinone(CPAOZ),the IC50of dcELISA was 0.08 μg/L,the limit of detection was 0.015 μg/L,detection range was 0.025~0.5 μg/L. The recoveries of all kinds of samples were range from 82.0% to 121.0%. There was almost no cross reaction with other drugs of similar construction. The conclusion suggested that the AOZ-ELISA was a great method with high sensitivity for detecting AOZin samples.
furazolidone;3-amino-2-oxazolidinone(AOZ);Horseradish Peroxidase(HRP)labeled antigen;direct competitive ELISA(dc-ELISA)
2015-02-12
樊晓博(1984-),女,硕士研究生,讲师,研究方向:食品快速检测技术,E-mail:shine2786@163.com。
渭南职业技术学院青年科研基金项目(WZYQ201405)。
TS201.7
A
1002-0306(2015)21-0318-05
10.13386/j.issn1002-0306.2015.21.057

