胃癌组织中Bmi-1表达与胃癌分化、转移及临床预后的关系
何 胜 曾维政
胃癌是我国发病率和死亡率均较高的恶性肿瘤,流行病学研究显示其发病与遗传因素、环境因素以及幽门螺杆菌感染等多种因素有关,其发生与演变与多基因变异密切相关,且为多种基因共同作用的结果[1]。Bmi-1 基因(B cell-specific MLV integration site-1)作为多梳基因家族的成员,可与c-myc异位基因共同作用引起胃肠道肿瘤的形成和转化,在胃肠道肿瘤细胞中呈高表达状态,并通过调节细胞周期在肿瘤的发展中发挥重要作用,但Bmi-1基因的表达与胃癌的转移及预后的关系尚不明确[2]。为此,本研究针对胃癌组织中Bmi-1基因表达与胃癌分化、转移及临床预后的关系进行了研究。
资料和方法
一、一般资料
选取我科2013年1月至2014年1月行胃癌根治术患者72例的术后标本、术后病理蜡块及完整临床资料,所有患者均经术后病理确诊为胃癌,所有蜡块均包括肿瘤组织和癌旁组织(病理学确诊的正常组织,距离肿瘤边缘5~10 cm)。排除术前已经接受放疗、化疗的患者。切取标本后,以液氮冷冻,置入-80℃冰箱备用。男性45例,女性27例;年龄32~80岁,平均年龄(55.8±3.4)岁。患者具体一般资料,见表1。
二、实验试剂及仪器
RT-PCR试剂盒购自上海申能博彩生物科技有限公司,Bmi-1引物和GAPDH引物购自大连宝生物工程有限公司,鼠抗人Bmi-1单克隆抗体购自美国Santa Cruz公司。
PCR扩增仪购自Thermo Hybaid公司,紫外分光光度计购自日本岛津公司,低温高速离心机购自德国Eppendorf公司,BX-50全自动显微照相系统购自日本OLYMPUS公司,EG1160全自动包埋机和RMZ145半自动切片机购自德国LELCA公司,电热恒温水浴箱购自上海医疗器械七厂。
三、实验方法
采用半定量逆转录聚合酶链反应(RT-PCR)技术测定胃癌组织及癌旁组织Bmi-1基因mRNA表达。将处于对数生长期的胃癌细胞进行处理后加入TRIzol 1 mL抽提细胞RNA,并按照逆转录试剂盒上的操作说明合成cDNA,采用GeneAmp9600型PCR扩增仪进行扩增。HPV 16E6 mRNA的反应条件为:预变性94℃4 min,变性94℃30 s,退火54℃30 s,延伸72℃1 min,最后延伸10 min,一共进行30个循环。将PCR产物置于1.5%的琼脂凝胶电泳中进行检测。
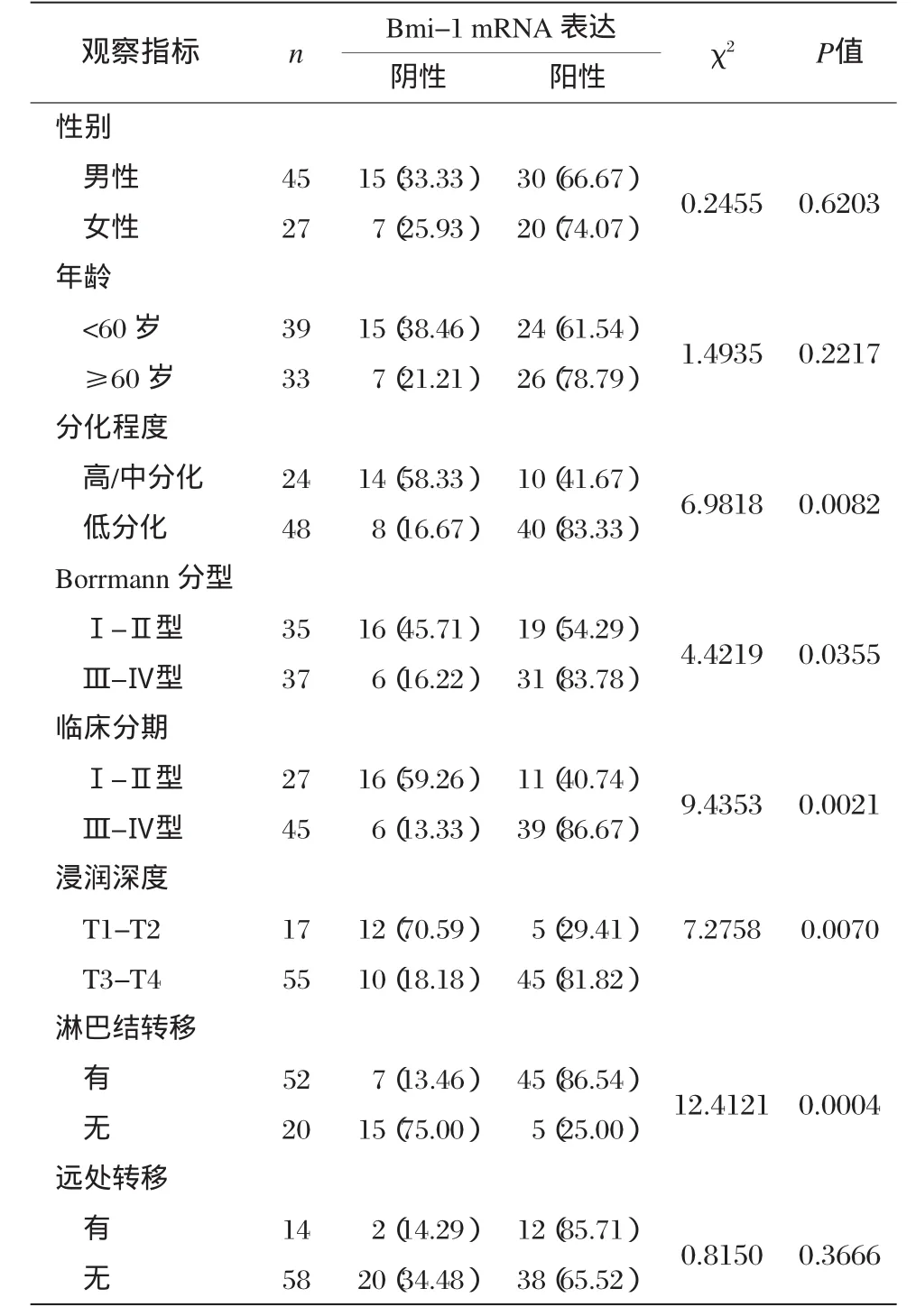
表1 胃癌组织Bmi-1 mRNA表达和胃癌各临床及病理因素之间的关系 [n(%)]
采用免疫组化对石蜡切片染色检测胃癌组织及癌旁组织Bmi-1蛋白表达水平。患者术后留取少量胃癌组织及癌旁组织制成石蜡切片送病理检验。将胃癌组织及癌旁组织样本用10%的甲醛进行固定,并用石蜡进行包埋后切片,平均片厚约2 μm,腊片脱蜡后采用3%的双氧水在室温下孵育5~10 min后,进而将内源性的过氧化氢酶活性清除。蒸馏水清洗3次后置入磷酸盐缓冲液进行浸泡,5 min后置于95℃的环境下,15 min后降至室温进行冷却。将新配制的二氨基联苯胺溶液滴于切片上,显色3 min后置于显微镜下进行观察,蒸馏水充分冲洗后使用苏木紫进行再次染色,脱水后封片。
四、观察指标
1.PCR结果
采用 (100 V,10 min)1%琼脂糖凝胶对扩增产物进行电泳之后,溴化乙锭染色,分析结果采用凝胶成像分析系统,同时拍照。对比胃癌组织及癌旁组织的PCR结果。
2.免疫组化结果
免疫组化中,阳性表现为细胞质中棕黄色或黄色颗粒。其中染色程度:1分,不着色;2分,淡黄色;3分,棕黄色;4分,棕褐色。染色细胞占计数细胞百分率:1分, <10%;2分,10% ~50%;3分,51% ~75%;4分,>75%。染色程度和染色细胞占计数细胞百分率相乘乘积进行计算:1~4分,阴性;5~8分,弱阳性;9~12分,中等阳性;13~16分,强阳性。对比不同临床分期的胃癌组织及癌旁组织的免疫组化结果。
3.胃癌组织Bmi-1 mRNA表达和胃癌各临床及病理因素之间的关系
记录所有患者的性别、年龄、临床分期、Borrmann分型、分化程度、浸润深度、淋巴结转移和远处转移情况。临床分期采用胃癌TNM分期法(2002年抗癌国际联盟)。
4.随访
对于所有患者进行为期1年的术后随访,方式为电话和门诊随访,记录胃癌组织Bmi-1 mRNA表达阳性和阴性两组患者术后1年复发率和死亡率。
五、统计学方法
结 果
一、胃癌组织及癌旁组织的PCR结果
从图1可见,胃癌组织中的Bmi-1基因mRNA表达显著高于癌旁组织。Bmi-1基因mRNA在胃癌组织中呈强表达,在癌旁组织中呈弱表达。
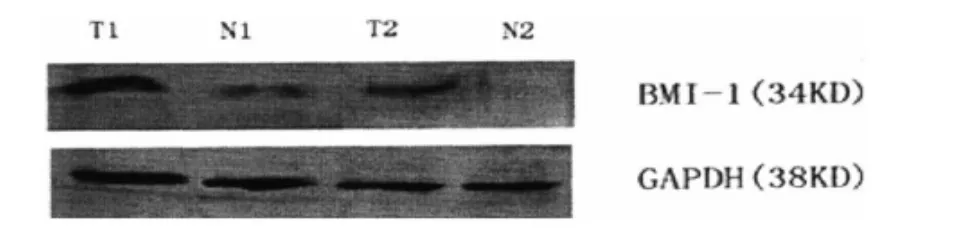
图1 胃癌组织及癌旁组织的PCR结果对比
二、胃癌组织及癌旁组织的免疫组化结果
胃癌组织及癌旁组织的免疫组化结果对比,见表2、图2。图2中,Bmi-1蛋白在癌旁组织中缺乏阳性表达,在胃癌组织中表达集中于肿瘤细胞细胞核中,表现为棕黄色或棕褐色颗粒。表2中,胃癌组织中的Bmi-1蛋白阳性表达率显著高于同期癌旁组织,Ⅲ-Ⅳ期胃癌组织的Bmi-1蛋白阳性表达率显著高于Ⅰ-Ⅱ期胃癌组织,P<0.05。

表2 胃癌组织及癌旁组织的免疫组化结果对比 [n(%)]
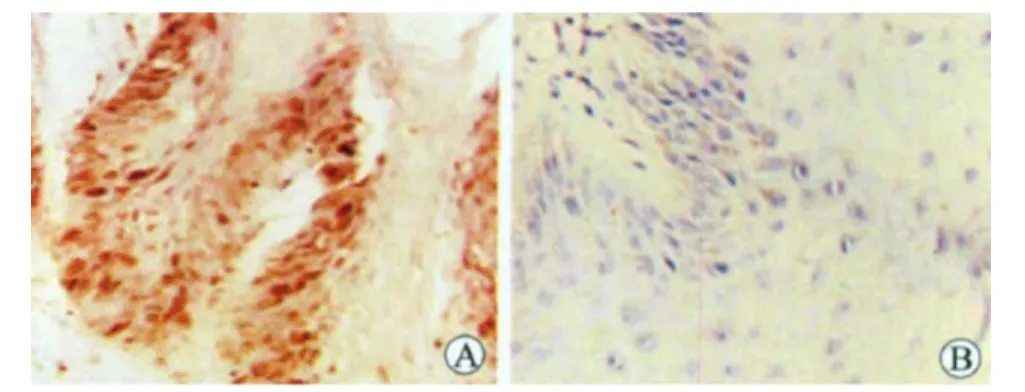
图2 胃癌组织及癌旁组织的免疫组化结果对比(SP,×200)。A:胃癌组织(Ⅲ期)中癌细胞细胞核内可见较多棕黄色或棕褐色颗粒;B:胃癌癌旁组织中(Ⅲ期)细胞核染色呈蓝色。
三、胃癌组织Bmi-1 mRNA表达与临床及病理因素之间的关系
胃癌组织Bmi-1 mRNA表达和胃癌各临床及病理因素之间的关系,见表1。低分化、Borrmann分型Ⅲ-Ⅳ型、临床分期Ⅲ-Ⅳ期、浸润深度T3-T4、淋巴结转移阳性的胃癌组织Bmi-1 mRNA表达阳性率显著升高,P<0.05。
四、胃癌组织Bmi-1 mRNA表达和术后1年复发率及死亡率的关系
胃癌组织Bmi-1 mRNA表达和术后1年复发率及死亡率的关系,见表3。胃癌组织Bmi-1 mRNA表达阳性患者术后1年复发率显著高于阴性患者,P<0.05。

表3 胃癌组织Bmi-1 mRNA表达和术后1年复发率及死亡率的关系 [n(%)]
讨 论
近年来的研究表明,Bmi-1基因在许多实体瘤,包括肺癌、结肠癌、直肠癌、乳腺癌、鼻咽癌以及胃癌等肿瘤中均有较高的表达水平,提示Bmi-1基因的高表达在肿瘤发生与演变的过程中起着重要作用[3]。胃癌作为我国发病率和死亡率均较高的恶性肿瘤,其流行病学研究显示其发病与遗传因素、环境因素以及幽门螺杆菌感染等多种因素有关,其发生和演变与多基因变异密切相关,且为多种基因共同作用的结果。Bmi-1基因作为一种转录抑制因子,可以介导邻近基因沉默,并在转录水平调控细胞的衰老及增殖,进而引起一系列细胞生物学改变[4]。Bmi-1的家族成员主要包括Mel-18以及BLG等一系列保守且重要的蛋白质,Bmi-1基因主要存在于人类基因的10号染色体短臂13区,开放的阅读框编码蛋白含有326个氨基酸,其主要包含一个位于N末端的环指结构区域以及一个位于中心保守DNA结合模序的结构区域,正是这两个区域在细胞的分化以及肿瘤形成过程中起到重要作用[5-6]。Bickenbach等[7]研究显示,Bmi-1基因与肿瘤的发生密切相关,在转基因鼠的实验中发现,高水平表达的Bmi-1基因可导致淋巴细胞瘤的发生,而Bmi-1基因的表达缺失则会阻滞淋巴细胞的功能[8]。
本研究采用半定量逆转录聚合酶链反应 (RTPCR)技术测定胃癌组织及癌旁组织Bmi-1基因mRNA表达,以证实胃癌组织中是否存在Bmi-1基因mRNA的高表达;同时采用免疫组化对石蜡切片染色检测胃癌组织及癌旁组织Bmi-1蛋白表达水平,旨在观察胃癌组织中是否存在Bmi-1蛋白的表达。分析胃癌组织Bmi-1 mRNA表达和胃癌各临床及病理因素之间的关系,对比mRNA表达阳性和阴性两组患者的术后1年复发率和死亡率。本研究显示,胃癌组织中的Bmi-1基因mRNA表达显著高于癌旁组织,且Bmi-1基因mRNA在胃癌组织中呈强表达,在癌旁组织中呈弱表达,胃癌组织中的Bmi-1蛋白阳性表达率显著高于同期癌旁组织。结果提示,Bmi-1高表达与肿瘤细胞的增殖及浸润有关,而肿瘤细胞的过度增殖会导致肿瘤细胞的浸润及淋巴结的转移,且这种高表达水平不仅存在于转录水平,且在转录后也呈表达水平上调状态,因此Bmi-1是一种肿瘤的异常分子标志物[9]。Bmi-1还可以通过诱导胃癌细胞的端粒酶活性进而促进其增殖,并参与胃癌细胞的浸润和转移[10]。另外,本研究结果中Ⅲ-Ⅳ期胃癌组织的Bmi-1蛋白阳性表达率显著高于Ⅰ-Ⅱ期胃癌组织。低分化、Borrmann分型Ⅲ-Ⅳ型、临床分期Ⅲ-Ⅳ期、浸润深度T3-T4、淋巴结转移阳性的胃癌组织Bmi-1 mRNA表达阳性率显著升高。即Borrmann分型越晚、浸润程度越深、肿瘤较大同时伴有淋巴结转移的患者,其Bmi-1基因表达水平越高。提示,Bmi-1基因在胃癌的分化以及癌细胞获得转移潜能的过程中起到重要作用,进而影响肿瘤的发展[11]。在预后方面,临床分期及有无淋巴结转移是影响患者预后的两个重要因素[12]。本研究结果显示,胃癌组织Bmi-1 mRNA表达阳性患者术后1年复发率显著高于阴性患者。提示,胃癌组织中的Bmi-1基因表达与胃癌预后有关,可能成为检测胃癌患者病情以及评估胃癌患者预后的重要指标。
综上所述,癌组织中Bmi-1对于胃癌分化、转移及临床预后具有一定的评价和预测作用,可能成为检测胃癌患者病情以及评估胃癌患者预后的重要指标。
1 何春燕,徐琼,曹丽芳,等.胃癌组织中Bmi-1蛋白表达与胃癌患者病理因素及预后的关系.中外医疗,2013,32(10):31-33.
2 刘晓丽,马礼鸿,王凯.Bmi-1和hTERT在胃癌组织中的表达及临床病理意义.中国老年学杂志,2013,33(19):4694-4695.
3 张晓伟.Bmi-1启动子介导Bmi-1干扰靶向性治疗胃癌研究[D].上海:复旦大学,2012.
4 宋涛,夏红.FOLFOX6方案治疗晚期结直肠癌78例的临床疗效与安全性探讨.现代仪器与医疗,2014,20(6):49-51.
5 李岩,李薇,宋伟,等.Bmi-1基因RNA干涉对胃癌细胞生物学活性的影响.中国老年学杂志,2013,33(22):5614-5616.
6 郭兰伟,李霓,王刚,等.BMI与恶性肿瘤发病风险的前瞻性队列研究.中华流行病学杂志,2014,35(3):231-236.
7 Bickenbach KA,Denton B,Gonen M,et al.Impact of obesity on perioperative complications and long-term survival of patients with gastric cancer.Ann Surg Oncol,2013,20(3):780-787.
8 余明军,孙学军,王海明.胃癌组织Bmi-1蛋白表达及临床病理特征.浙江中西医结合杂志,2014,24(4):301-302.
9 樊强,卞邦健,杨广林,等.新辅助化疗在局部晚期胃癌治疗中临床应用.现代仪器与医疗,2014,20(6):55-56.
10 Li W,Li Y,Tan Y,et al.Bmi-1 is critical for the proliferation and invasiveness of gastric carcinoma cells. J Gastroenterol Hepatol,2010,25(3):568-575.
11 王艺芳.Bmi-1-siRNA抑制肺腺癌SPC-A1细胞的增殖及机制[D].大连:大连医科大学,2012.
12 刘红梅,徐丽,崔雪花,等.胃癌中Bmi-1蛋白的表达及意义.临床与实验病理学杂志,2012,28(10):1153-1155.

