鸟结核分枝杆菌刺激巨噬细胞后对细胞骨架蛋白β-actin的调控机制研究
王建军,王泽友,姚永良,吴建红,成 阳,李光新
鸟结核分枝杆菌刺激巨噬细胞后对细胞骨架蛋白β-actin的调控机制研究
王建军1,王泽友2,姚永良1,吴建红1,成 阳1,李光新3
目的 研究鸟结核分枝杆菌刺激巨噬细胞后其对巨噬细胞骨架蛋白及其调节蛋白的作用机制。方法 RT-PCR方法分析M.avium刺激巨噬细胞后cofilin-1,β-actin基因的表达水平,同时Western blot方法从蛋白水平分析M.avium刺激巨噬细胞后β-actin、cofilin-1蛋白的表达水平。流式细胞术检测M.avium刺激巨噬细胞后巨噬细胞凋亡及坏死的情况。结果β-actin基因及其蛋白在巨噬细胞受M.avium刺激后表达显著下调,而β-actin蛋白的调节蛋白cofilin-1表达显著增强。同时,M.avium刺激巨噬细胞后诱导巨噬细胞凋亡显著增多。结论M.avium刺激巨噬细胞后可通过调控β-actin及cofilin-1蛋白的表达,从而诱导巨噬细胞凋亡或坏死。
巨噬细胞;鸟结核分枝杆菌;β-actin; cofilin-1
结核分枝杆菌(Mycobacteriumtuberculosis, MTB)为结核病的病原菌,是兼性细胞内寄生菌,其引发的结核病被列为全球重大传染病之一[1]。根据世界卫生组织的统计,我国是全球结核病流行严重的国家之一,结核病年发病人数约为130万,占全球发病的14.3%,位居全球第2位[2]。
结核分枝杆菌感染人体后,主要被巨噬细胞吞噬,未被机体免疫系统清除而潜伏下来的MTB也主要寄生于巨噬细胞内,在巨噬细胞内增殖通过各种机制诱导细胞凋亡,发挥其抗结核活性[3]。肌动蛋白(actin)是微丝的结构成分,氨基酸结构高度保守,是构成细胞骨架的主要成分其表达水平的变化与细胞形态变化密切相关[4]。研究表明细胞凋亡时,肌动蛋白细丝发生断裂,肌动蛋白网络结构遭到破坏,这是细胞凋亡时形态改变的一个典型特征,提示肌动蛋白可能是细胞凋亡早期的调控物之一[5]。目前研究发现结核分枝杆菌感染巨噬细胞后巨噬细胞分泌的外泌体(exosomes)中的β-actin蛋白表达显著下调及cofilin-1蛋白表达增强,表明结核分枝杆菌感染巨噬细胞可能改变宿主细胞骨架的稳定性[6]。鸟结核分枝杆菌是非结核分枝杆菌中重要的种属之一,其不仅可引起淋巴结炎,淋巴结核,脑膜炎等,然而其导致的肺部病变与人型结核分枝杆菌导致的肺结核很相似。目前非结核分枝杆菌导致的疾病越来越受到卫生部门的重视,但非结核分枝杆菌的相关研究仍少之又少无法为临床提供强有力的支撑。本文着重研究鸟结核分枝杆菌感染巨噬细胞后从基因与蛋白水平对细胞骨架蛋白及其调节蛋白进行研究,探讨其在鸟结核分枝杆菌诱导细胞凋亡过程中发挥的具体机制。
1 材料与方法
1.1 研究对象 巨噬细胞系THP-1,鸟结核分枝杆菌(Mycobacteriumavium,M.avium)来购自上海物种保藏中心。
1.2 主要试剂 RPMI-1640培养基、胎牛血清购自Hyclone公司、RNA提取试剂、PCR试剂购自北京鼎国昌盛生物技术公司。β-actin、cofilin-1、GAPDH抗体购自上海义森生物科技有限公司。Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海前尘生物技术公司。
1.3M.avium培养 接种环取M.avium菌液于罗氏固体培养基上划线接种,37 ℃培养4周后,刮下M.avium,0.05%吐温无菌生理盐水震荡充分打散M.avium,高压蒸汽灭菌使其丧失活性后比浊法计算M.avium菌液浓度(1.5 ×107/ mL)。
1.4 巨噬细胞培养 THP-1细胞于10%胎牛血清RPMl-l640培养基中,37 ℃ 5% CO2饱和湿度环境中培养48 h后,终浓度为1 μmol/L的佛波酯诱导细胞24 h使其分化成巨噬细胞后,随机分为对照组与实验组,对照组空白培养基刺激巨噬细胞;实验组以灭活的M.avium刺激细胞24 h(M.avium:细胞=10∶1)。
1.5 RT-PCR引物设计及合成 根据NCBI数据库检索β-actin、GAPDH基因的cDNA序列并合成引物,引物序列如表1。

表1 β-actin及GAPDH引物序列
1.6 RNA提取 按照鼎国昌盛生物技术公司的Trizol试剂盒说明书提取细胞总RNA,-80 ℃保存备用。
1.7 RT-PCR 逆转录体系30 μL中含30 pmol/L oligo(dT)151 μL,2.5 mmmol/L dNTPs混合物4 μL,RNA酶抑制剂0.5 μL(30 U),AMV逆转录酶0.5 μL(10 U),5×RT缓冲液6 μL,1 μg模板RNA,17 μL DEPC水,37 ℃水浴1 h合成cDNA;25 μL PCR体系中含cDNA 2.5 μL,0.5 μL TaqDNA聚合酶1.5 U,10 mmol/L上游引物0.5 μL,10 mmol/L下游引物0.5 μL,2.5 mmol/L dNTPs 4 μL,10×PCR 缓冲液2.5 μL,无核糖核酸酶水14.5 μL,预变性94 ℃ 2 min,然后94℃变性30 s,53℃退火30 s,72℃延伸35 s,共30个循环,最后72 ℃延伸5 min,1.5%琼脂糖凝胶电泳分析PCR产物。
1.8 Western Blot 蛋白质提取试剂盒提取巨噬细胞受M.avium刺激前后的总蛋白并Bradford方法测定蛋白浓度;配制10% SDS-PGAE电泳胶,将变性后的蛋白质按50 μg的蛋白总量进行垂直电泳,然后通过电转移法将蛋白质转至PVDF膜上,β-actin抗体及cofilin-1抗体作为一抗,辣根过氧化物酶标记的二抗进行免疫反应。
1.9 细胞凋亡检测M.avium刺激巨噬细胞24 h后,收集巨噬细胞1×106个,PBS(含2 g/L BSA)轻轻洗涤两次;分别加入10 μL的FITC标记的Annexin-V抗体、PI试剂,重悬细胞室温避光孵育30 min。PBS(含2 g/L BSA)洗涤细胞2次,0.4 mL PBS(含2 g/L BSA)重悬细胞,流式细胞仪检测。
1.10 统计分析 所有数据均采用SPSS 16.0进行处理及统计学分析,两组间比较采用t检验,多组间两两比较采用q检验,P<0.05为差异有统计学意义。
2 结 果
2.1M.avium对巨噬细胞影响 THP-1细胞培养24 h后,无任何处理组为对照组,其余组以1 μmol/L TPA诱导分化形成巨噬细胞后以PBS、M.avium分别处理24 h,倒置显微镜观察巨噬细胞生长形态 (图1A)。同时,提取细胞基因组DNA、检测基因组片段化情况(图1B)。实验结果表明巨噬细胞经M.avium刺激后,巨噬细胞形态未发生明显变化,细胞基因组DNA未发生片段化。

a:THP-1细胞组;b:THP-1分化巨噬细胞组;c:M.avium处理巨噬细胞组。1:HindIII Marker;2:THP-1基因组DNA;3:巨噬细胞基因组DNA;4:巨噬细胞经M.avium刺激后的基因组DNA。
a: THP-1 cells group; b: THP-1 differentiated into macrophages group; c:M.aviumstimulation macrophages group. 1:HindIII Marker; 2: The gDNA of THP-1 cells; 3: The gDNA of macrophage cells; 4: The gDNA ofM.aviumstimulation macrophage.
图1 巨噬细胞经M.avium刺激后的细胞形态(A)及基因组DNA分析(B)
Fig.1 Analysis of the morphology (A) and genomic DNA (B) ofM.aviumstimulation macrophages
2.2M.avium刺激巨噬细胞后β-actin及cofilin-1基因表达研究 巨噬细胞经M.avium处理24 h后,RT-PCR法检测巨噬细胞β-actin及cofilin-1 mRNA的表达变化(图2),SPSS 16.0统计软件分析β-actin及cofilin-1 mRNA表达水平,实验结果表明β-actin基因在M.avium处理组表达下调2.3倍,差异有统计学意义(P<0.05),而cofilin-1基因在M.avium处理组中表达增强1.3倍,差异有统计学意义(P<0.05)。
2.3 Western blot分析细胞骨架蛋白 Western blot方法检测M.avium处理巨噬细胞24 h后,巨噬细胞β-actin及cofilin-1蛋白的表达变化(图3)。Image J灰度扫描灰度并经GAPDH灰度值校正后,SPSS 16.0统计分析,实验结果表明M.avium刺激巨噬细胞24 h后巨噬细胞β-actin蛋白表达下调2.1倍,差异有统计学意义(P<0.05),而β-actin的调节蛋白cofilin-1则表达增强1.7倍,差异有统计学意义(P<0.05)。
2.5 流式细胞检测巨噬细胞凋亡及坏死 巨噬细胞经M.avium感染处理24 h后,FITC标记Annexin-V抗体及PI试剂孵育细胞30 min后,流式细胞仪检测各组细胞凋亡及坏死情况(图4)。独立进行3次重复实验,SPSS 16.0对各组数据进行统计学分析,实验结果表明M.avium感染巨噬细胞后处理巨噬细胞后,15%巨噬细胞发生凋亡,有统计学意义(P<0.05);3%巨噬细胞发生坏死,有统计学意义(P<0.05)。
3 讨 论
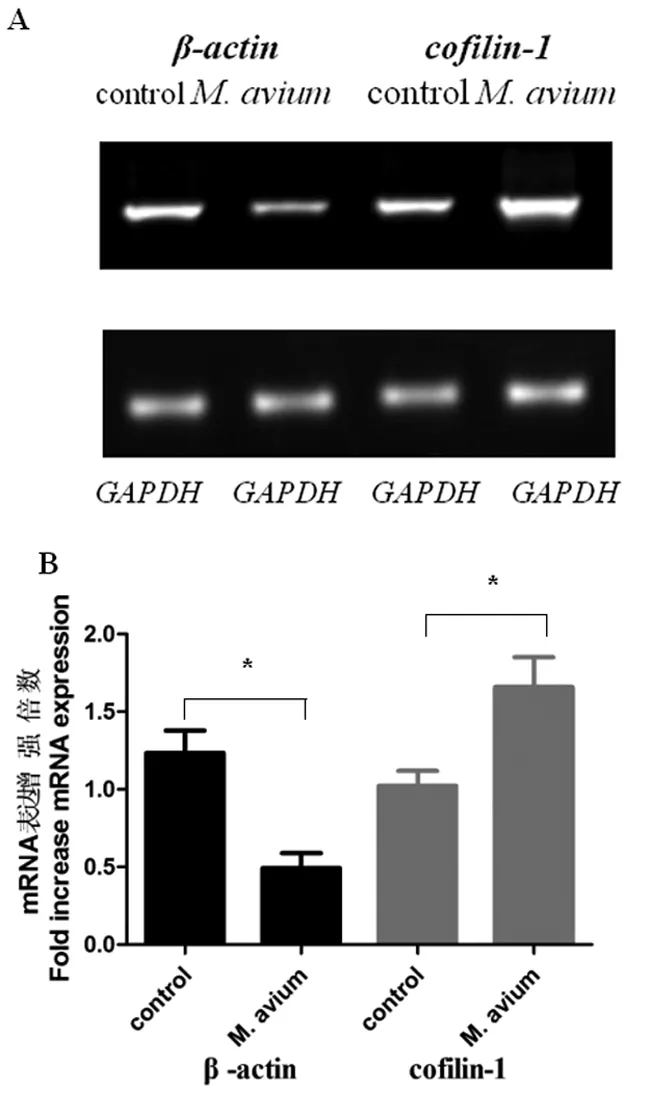
A:巨噬细胞受M.avium刺激后β-actin及cofilin-1 mRNA 的PCR结果;B:SPSS 16.0统计软件分析结果,GAPDH为标准校正;(n=3与对照组相比,*P<0.05)。
A: Results ofβ-actinandcofilin-1 mRNA detected by PCR; B: Results of the expression ofβ-actinandcofilin-1 mRNA analyzed by SPSS 16.0 stastical software,GAPDHas a standard calibration (n=3, compared with the control group, *P<0.05).
图2 RT-PCR方法分别检测巨噬细胞受M.avium刺激后β-actin及cofilin-1 mRNA的表达水平
Fig.2 Expression ofβ-actinandcofilin-1 mRNA inM.aviumstimulation macrophages analyzed by PCR methods
巨噬细胞(Macrophage)是结核分枝杆菌在体内的主要宿主细胞,结核分枝杆菌可在巨噬细胞内长期滞留及潜伏[7]。结核分枝杆菌因其特殊的脂质结构而导致巨噬细胞内的溶酶体酶难以杀伤结核分枝杆菌,最终可导致结核分枝杆菌在巨噬细胞内大量增殖。结核分枝杆菌感染巨噬细胞后,将破坏宿主细胞骨架而导致细胞凋亡或坏死,继而释放结核分枝杆菌出胞而侵袭周边巨噬细胞,并导致结核分枝杆菌感染加重。
结核分枝杆菌感染巨噬细胞后,巨噬细胞产生大量的TNF-α与IL-1β而增强caspase-3的活性,从而介导巨噬细胞凋亡,然而细胞的凋亡必然引起细胞骨架形态与成分的改变[8]。β-actin蛋白解聚与细胞凋亡关系密切,且其解聚常出现在凋亡小体形成前。胞浆肌动蛋白actin是细胞重要的骨架蛋白,细胞周期蛋白依赖性激酶-5调节亚基-1(Cyclin-dependent kinase 5, regulatory subunit 1, CD5R1)是细胞周期蛋白依赖性激酶-5(Cyclin-dependent kinase-5,CDK5)的特异性激活因子,活化的CDK5可促进tau蛋白过度磷酸化及过度表达,最终导致细胞骨架与微管的不稳定性[9]。Cofilin-1蛋白是细胞骨架蛋白的结合蛋白,其可通过水解ATP分解肌动蛋白纤维[10]。研究表明细胞凋亡时,肌动蛋白细丝发生断裂,肌动蛋白网络结构遭到破坏,提示肌动蛋白是细胞凋亡早期的调控物之一[11]。本研究前期发现巨噬细胞经鸟结核分枝杆菌刺激后分泌的exosomes中的actin蛋白表达显著降低,而cofilin-1蛋白则表达显著增强,表明巨噬细胞的细胞骨架可能受到鸟结核分枝杆菌的破坏而导致宿主细胞骨架相关蛋白的合成与加工受到抑制,同时actin与cofilin-1不一致的表达表明巨噬细胞在竭力调节并维持细胞骨架的稳定[12]。

A:M.avium处理巨噬细胞后β-actin与cofilin-1蛋白的表达结果。B:β-actin与cofilin-1蛋白表达经GAPDH校正后的统计分析结果,(n=3与对照组相比,*P<0.05)。
A: Results of the protein expression of β-actin and cofilin-1 in macrophages stimulated withM.avium. B: Results of the protein expression of β-actin, and cofilin-1 by stastical software, GAPDH as quantitative correction, (n=3, compared with the control group, *P<0.05).
图3 Western blot分析巨噬细胞受M.avium刺激后β-actin蛋白及其调节蛋白cofilin-1的表达
Fig.3 Analysis of the expression of β-actin and its regulatory protein cofilin-1 inM.aviumstimulation macrophages by Western blot
本研究初步发现鸟结核分枝杆菌刺激巨噬细胞后细胞骨架蛋白受结核分枝杆菌的抑制,而诱导巨噬细胞大量的凋亡或坏死,提示鸟结核分枝杆菌可通过抑制细胞骨架蛋白的表达而诱导宿主细胞的凋亡,但具体的调节机制仍有待进一步研究。

A:流式细胞术检测M.avium诱导巨噬细胞凋亡及坏死的水平;B:SPSS 16.0统计软件分析巨噬细胞的凋亡及坏死结果(n=3与对照组相比,*P<0.05)。
A: The detection of the apoptosis or necrosis of macrophages infected withM.aviumby flow cytometry; B: Results of the apoptosis or necrosis of macrophages analyzed by SPSS 16.0 statistical software (n=3, compared with the control group, *P<0.05).
图4 流式细胞术检测巨噬细胞的凋亡及坏死情况
Fig.4 Analysis of the apoptosis or necrosis of macrophages by flow cytometry
[1]Ottenhoff TH, Doherty TM, van Dissel JT, et al. First in humans: a new molecularly defined vaccine shows excellent safety and strong induction of long-livedMycobacteriumtuberculosis-specific Th1-cell like responses[J]. Hum Vaccin, 2010, 6(12): 1007-1015. DOI: 10.4161/hv.6.12.13143
[2]Wang S, Yang AF. The present situation and the preventive measures of tuberculosis in China[J]. Chin J Ethnomed Ethnopharm, 2009, 18 (15): 65-66. (in Chinese) 王胜, 杨安芳. 我国结核病的现状与预防措施[J]. 中国民族民间医药, 2009, 18 (15): 65-66.
[3]Dao DN, Kremer L, Guerardel Y, et al.Mycobacteriumtuberculosislipomannan induces apoptosis and interleukin-12 production in macrophages[J]. Infect lmmun, 2004, 72(4): 2067-2074. DOI:10.1128/IAI.72.4.2067-2074.2004
[4]Wu B, Ma J, Meng K, et al. Observation on ultrastructure of liver cell apoptosis[J]. J Chin Electron Microscopy, 2000, 19(6): 791-797. (in Chinese) 吴波, 马捷, 孟奎, 等. 肝细胞凋亡的超微结构观察[J]. 电子显微学报, 2000, 19(6): 791-797.
[5]Franklin-Tong VE, Gourlay CW. A role for actin in regulating apoptosis/programmed cell death: evidence spanning yeast, plants and animals[J]. Biochem J, 2008, 413(3): 389-404. DOI: 10.1042/BJ20080320
[6]Wang JJ, Chen C, Xie PF, et al. Proteomic analysis and immune properties of exosomes shed by macrophages infected withmycobacteriumavium[J]. Microbes Infect, 2014, 16(4): 283-291. DOI: 10.1016/j.micinf.2013.12.001
[7]Siegel RM. Caspases at the crossroads of immune-cell life and death[J]. Nat Rev Immunol, 2006, 6(4): 308-317. DOI: 10.1038/nri1809
[8]Miao EA, Rajan JV, Aderem A. Caspase-1-induced pyroptotic cell death[J]. Immunol Rev, 2011, 243(1): 206-214. DOI: 10.1111/j.1600-065X.2011.01044.x
[9]Michaelis ML, Dobrowsky RT, Li G, et al. Tau neurofibrillary pathology and microtubule stability[J]. J Mol Neuro Sci, 2002, 19(3): 289-293. DOI: 10.1385/JMN:19:3:289
[10]Hotulainen P, Paunola E, Vartiainen MK, et al. Actin-depolymerizing factor and cofilin-1 play overlapping roles in promoting rapid F-actin depolymerization in mammalian nonmuscle cells[J]. Mol Biol Cell, 2005, 16(2): 649-664. DOI: 10.1091/mbc.E04-07-0555
[11]Franklin-Tong VE, Gourlay CW. A role for actin in regulating apoptosis/programmed cell death: evidence spanning yeast, plants and animals[J]. Biochem J. 2008, 413(3): 389-404. DOI: 10.1042/BJ20080320
[12]Wang JJ, Chen C, Tang LJ, et al. Molecular immune response of macrophages stimulated with exosomes secreted by macrophages infected withMycobacteriumtuberculosisand it’s proteomics analysis[J]. Chin J Cell Mol Immunol, 2012, 29(2): 123-126. (in Chinese) 王建军, 陈偲, 汤立军, 等. 鸟结核分枝杆菌感染巨噬细胞后分泌的外泌体刺激巨噬细胞产生的分子免疫反应及其蛋白质组学研究[J]. 细胞与分子免疫学杂志, 2012, 29(2):123-126.
Li Guang-xin, Email: lgxin34147@126.com
Regulatory mechanisms of the cytoskeletal protein β-actin after stimulation ofMycobacteriumaviumto macrophages
WANG Jian-jun1,WANG Ze-you2,YAO Yong-liang1,WU Jian-hong1,CHENG Yang1,LI Guang-xin3
(1.KunshanFirstPeople’sHospital,AffiliatedtoJiangsuUniversity,Kunshan215300,China; 2.InstituteofCancerResearch,CentralSouthUniversity,Changsha410078, 3.DepartmentofPathology,ChongqingCancerInstitute,Chongqing215300,China)
We investigated the functions of the cytoskeleton proteins and their regulatory proteins inMycobacteriumavium(M.avium) stimulation macrophages. The expression of β-actin and cofilin-1 were detected in mRNA and proteins levels by RT-PCR and Western blot technologies, respectively. Meanwhile, the apoptosis or necrosis of macrophages stimulated withM.aviumwas analyzed by flow cytometry. Results showed that β-actin mRNA and proteins of β-actin were both down-regulated inM.aviumstimulation macrophages, however the expression of cofilin-1 gene and proteisn was presented oppositely both in mRNA and protein level compared with the expression of β-actin. Furthermore, the apoptosis or necrosis of macrophages induced byM.aviumwas increased significantly. We confirmed that the expression of β-actin and confilin-1 could be regulated byM.aviumstimulation to induce theapoptosis or necrosis of macrophages.
macrophage;M.avium; β-actin; cofilin-1
10.3969/j.issn.1002-2694.2015.09.004
李光新, Email:lgxin34147@126.com
1.江苏大学附属昆山医院, 昆山 215300; 2.中南大学肿瘤研究所,长沙 410078; 3.重庆市肿瘤研究所病理科,重庆 215300
Supported by the Science and Technology project of Kunshan social development(KS1425)
R392.11
A
1002-2694(2015)09-0800-05
2014-11-24;
2015-05-11
昆山市科技局立项项目(KS1425)

