羊种布氏菌043强毒株BRA0434基因缺失突变株的构建与毒力的初步评价
纪太旺,李志强,张 辉,2,张俊波,赵庆亮,王 浩,李 亚,王慧勤,陈创夫,2
羊种布氏菌043强毒株BRA0434基因缺失突变株的构建与毒力的初步评价
纪太旺1,李志强1,张 辉1,2,张俊波1,赵庆亮1,王 浩1,李 亚1,王慧勤1,陈创夫1,2
目的 检测BRA0434基因对羊种布氏菌043毒力的影响。方法 利用同源重组的原理,以BRA0434基因外侧的同源臂序列构建重组质粒,将其电转化至布氏菌043感受态细胞,通过卡那抗性筛选和检测引物鉴定而获得羊种布氏菌043-ΔBRA0434缺失突变株,并以之和羊种布氏菌043以106CFU剂量腹腔接种小鼠,又以100∶1的感染复数侵染小鼠巨噬细胞。结果 与羊种布氏菌043相比,羊种布氏菌043-ΔBRA0434缺失突变株的载菌量和小鼠脾脏重量的影响都有一定程度的下降;侵染小鼠巨噬细胞试验结果显示羊种布氏菌043-ΔBRA0434缺失突变株的毒力较羊种布氏菌043有所降低。结论 BRA0434基因的缺失会减轻羊种布氏菌043的毒力。
布氏菌;BRA0434基因;毒力;试验
ZHAO Qing-liang1,WANG Hao1,LI Ya1,WANG Hui-qin1,CHEN Chuang-fu1,2
布氏菌病(brucellosis)是最常见的一种细菌性人兽共患传染病[1-3],其病原属于布氏菌属,呈革兰氏阴性,无芽孢,兼性细胞内细菌[4-6]。布氏菌的致病力主要表现在通过某些机制逃避或抑制巨噬细胞的杀菌作用,适应胞内环境并导致慢性感染[4-5]。慢性感染导致布氏菌拥有能够在宿主细胞内生存的能力,如适应宿主细胞的内环境,以及宿主正常的免疫防御[6-8]。
前期,研究发现在羊种布氏菌043强毒株与猪种布氏菌1330标准株的基因组DNA上有BRA0434基因的存在,而在猪种布氏菌S2菌苗株的基因组DNA上并没有BRA0434基因的存在。为此,本研究以羊种布氏菌043为模板,构建BRA0434基因缺失突变株,通过生长特性检测试验、侵染小鼠巨噬细胞试验以及动物感染试验等方法评估其毒力下降程度,从而探讨BRA0434基因在布氏菌毒力发挥过程中的作用,为进一步研究该基因在布氏菌中的具体功能奠定基础。
1 材料与方法
1.1 菌株、载体、实验动物与细胞 羊布氏菌(B.melitensis,043) 是布氏菌强毒株,为本研究室保存;大肠杆菌(Escherichiacoli,DH5α)为本研究室保存;pMD18-T simple 载体购自TaKaRa公司;pUC19K质粒由军事医学科学院疾病预防控制所陈泽良研究员馈赠;6~8周龄昆明白雌性小鼠购自石河子大学实验动物中心;小鼠巨噬细胞(RAW264.7)购自北京协和细胞资源中心。
1.2 重组质粒的构建 以羊种布氏菌043的基因组DNA为模板,使用引物BRA0434-N-F和BRA0434-N-R高保真扩增N端同源臂,使用引物BRA0434-N-F和BRA0434-N-R高保真扩增C端同源臂;以pUC19K质粒为模板,使用引物Kan-F和Kan-R高保真扩增卡那霉素抗性基因。将得到的目的片段通过融合PCR的方法进行融合之后直接与pMD18-T simple载体进行连接,并转化大肠杆菌DH5α,涂布于含有A+和K+抗性(氨苄青霉素和卡那霉素,50 mg/mL)的LB固体培养基,使用引物BRA0434-N-F和BA0434-C-R对阳性单克隆菌落进行菌液PCR验证。之后,将菌液PCR验证正确的菌株和重组质粒送北京六合华大基因生物技术有限公司测序。所用引物和序列见表 1。

表1 引物和序列
1.3 羊种布氏菌043-ΔBRA0434缺失突变株的构建和遗传稳定性检测 序列测定正确后,将构建好的重组质粒电转入羊种布氏菌043的感受态细胞中,复苏后涂布于含有K+的布氏菌固体培养基,37 ℃倒置培养3~5 d,进行抗性克隆的筛选与鉴定。首先,采用BRA0434基因的鉴定引物BRA0434-F和BRA0434-R对抗性克隆进行菌液PCR鉴定;其次,再采用位于BRA0434基因外侧与卡那霉素抗性基因内部的鉴定引物(BRA0434-I-F和Kan-I-R2引物组合;Kan-I-F2和BRA0434-I-R引物组合)对抗性克隆进行菌落PCR鉴定。将PCR鉴定正确的菌株继续传代培养至15代,检测其遗传稳定性。所用鉴定引物和序列见表2。
1.4 生长特性检测 从布氏菌固体培养基上分别挑取羊种布氏菌043、羊种布氏菌043-ΔBRA0434的新鲜单克隆菌落,接种到新鲜的布氏菌液体培养基中,置37 ℃、180 r/min条件下摇床振荡培养至OD600=0.6~0.8,然后分别将摇好的菌液稀释到OD600=0.1,置37 ℃、180 r/min条件下继续进行摇床振荡培养。在培养过程中,每2 h取样一次,每次取样94 μL菌液,加入6~8 μL甲醛溶液,震荡混匀,静置灭活10 min后再检测OD600的变化情况,直至细菌生长速度进入平台期,并绘制羊种布氏菌043-ΔBRA0434和羊种布氏菌043的生长曲线。
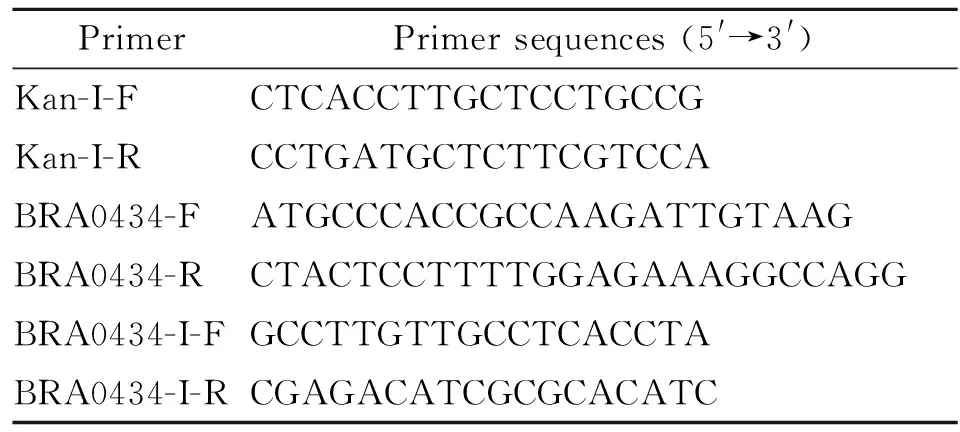
表2 鉴定引物和序列
1.5 动物感染试验 将6~8周龄昆明白雌性小鼠随机分成3组,每组24只。分别腹腔接种羊种布氏菌043、羊种布氏菌043-ΔBRA0434,接种剂量为1.0×106CFU/只,空白对照组注射无菌的PBS。在感染后的7 d、14 d、21 d和28 d的每个时间点,每组随机选取6只小鼠,断颈处死小鼠,无菌条件下摘取小鼠脾脏并称重,用组织匀浆器充分碾碎脾脏后加入1 mL的PBS制成匀浆液。10倍系列稀释匀浆液,取100 μL 涂板计数。
1.6 侵染小鼠巨噬细胞试验 将小鼠巨噬细胞(RAW264.7)传至六孔板中,培养至铺满六孔板底部,然后进行细胞计数。按照布氏菌与小鼠巨噬细胞的感染比例为100∶1的比例(MOI=100∶1)分别用羊种布氏菌043、羊种布氏菌043-ΔBRA0434侵染小鼠巨噬细胞。在侵染4 h、12 h、24 h和48 h的每个时间点,用 0.1%的 Tritonx-100裂解细胞。10倍系列稀释后,取100 μL 涂板计数。
2 结 果
2.1 重组质粒的构建 以羊种布氏菌043为模板,扩增出BRA0434基因的N端同源臂目的条带大小为495 bp(图 1A);扩增出BRA0434基因的C端同源臂目的条带大小为526 bp(图 1B);以pUC19K质粒为模板,扩增出卡那霉素抗性基因的目的条带大小为1 093 bp(图 1C);融合PCR扩增出的目的条带大小为2 114 bp(图 1D);使用引物BR0524-N-F和BR0524-C-R对阳性单克隆菌落进行菌液PCR验证,阳性克隆菌能够扩增出的条带大小为2 114 bp(图 1E);所得到的目的条带大小均与设计的理论值相符。
A:1:BRA0434基因N端同源臂;2:阴性对照;M:DNA Marker;(A)BRA0434基因N端同源臂PCR扩增
1: Flanking N of BRA0434; 2: Negative control; M:DNA Marker;(A) Flanking N of BRA0434 was amplified by PCR
B:1:BRA0434基因C端同源臂;2:阴性对照;M:DNA Marker;(B)BRA0434基因C端同源臂PCR扩增
B:1: Flanking C of BRA0434; 2: Negative control; M:DNA Marker; (B) Flanking C of BRA0434 was amplified by PCR
1:卡那霉素抗性基因;2:阴性对照;M:DNA Marker;(C)卡那霉素抗性基因PCR扩增
1: Kanamycin resistance gene; 2: Negative control; M: DNA Marker;(C) Kanamycin resistance gene was amplified by PCR.
1:融合PCR产物;2:阴性对照;M:DNA Marker;(D)BRA0434基因同源臂与卡那霉素抗性基因融合PCR扩增
1: Products of fusion PCR; 2: Negative control; M: DNA Marker;(D) Homology arms of BRA0434 gene and kanamycin resistance gene were amplified by fusion PCR.
1:重组质粒的菌液PCR产物;2:阴性对照;M:DNA Marker;(E)重组质粒的菌液PCR鉴定
1: Products of recombinant plasmid PCR; 2: Negative control; M: DNA Marker;(E) Recombinant plasmid was identified by PCR.
图1 重组质粒的构建
Fig.1 Construction of reconstruction plasmid
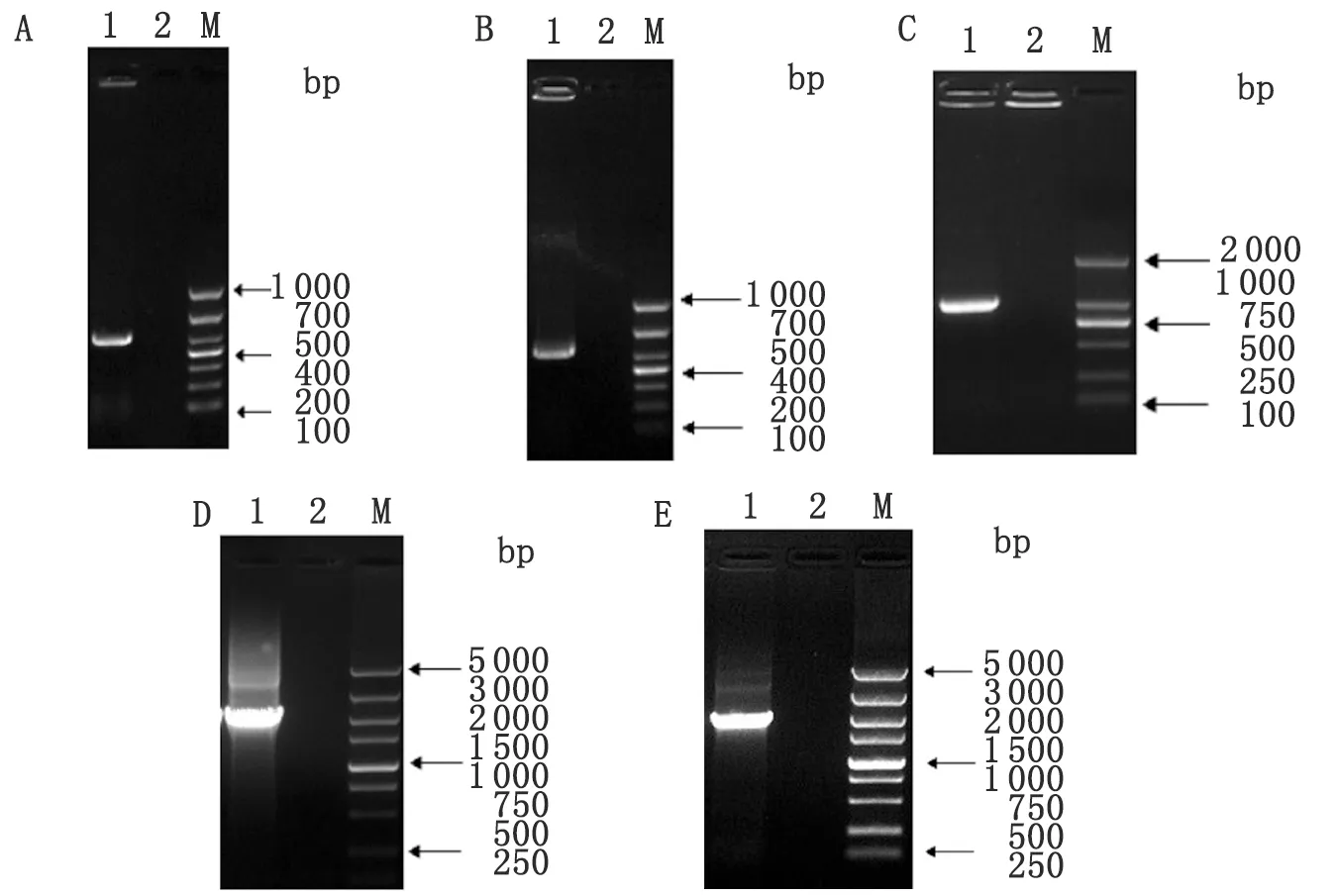
2.2 羊种布氏菌043-ΔBRA0434缺失突变株的鉴定与遗传稳定性检测 采用BRA0434基因的鉴定引物BRA0434-F和BRA0434-R对抗性克隆进行菌液PCR鉴定之后,抗性克隆不能扩增出BRA0434基因的全长片段(1 335 bp),而羊种布氏菌043亲本株能够扩增出BRA0434基因的全长片段(图 2A);同时,采用位于BRA0434基因的外侧和卡那霉素抗性基因内部的鉴定引物(BRA0434-I-F和Kan-I-R引物组合;Kan-I-F和BRA0434-I-R引物组合)对抗性克隆进行菌液PCR鉴定之后,抗性克隆能够扩增出预期大小的片段(分别为:1 040 bp和809 bp),而羊种布氏菌043亲本株不能扩增出预期大小的片段(图 2B、C)。这表明BRA0434基因的缺失突变株构建正确,得到的重组菌株命名为043-ΔBRA0434。将043-ΔBRA0434连续传代培养至15代,每一代都用BRA0434基因的鉴定引物BRA0434-F和BRA0434-R进行菌液PCR鉴定,结果043-ΔBRA0434不能扩增出BRA0434基因的全长片段(1 335 bp),而羊种布氏菌043亲本株能够扩增出BRA0434基因的全长片段,这表明043-ΔBRA0434缺失突变株遗传性稳定。
1:043-ΔBRA0434;2:羊种布氏菌043;M:DNA Marker;(A)BRA0434-F和BRA0434-R引物PCR鉴定043-ΔBRA0434
1: 043-ΔBRA0434; 2:B.Meilitensis043; M: DNA Marker;(A) PCR identification of 043-ΔBRA0434 by primers BRA0434-F and BRA0434-R
1:043-ΔBRA0434;2:羊种布氏菌043;M:DNA Marker;(B)BRA0434-I-F和Kan-I-R引物组合PCR鉴定043-ΔBRA0434
1: 043-ΔBRA0434; 2:B.Meilitensis043; M: DNA Marker;(B) PCR identification of 043-ΔBRA0434 by primers BRA0434-I-F and Kan-I-R
1:043-ΔBRA0434;2:羊种布氏菌043;M:DNA Marker;(C)Kan-I-F和BRA0434-I-R引物组合PCR鉴定043-ΔBRA0434
1: 043-ΔBRA0434; 2:B.Meilitensis043; M:DNA Marker;(C) PCR identification of 043-ΔBRA0434 by primers Kan-I-F and BRA0434-I-R.
图2 羊种布氏菌043-ΔBRA0434 缺失突变株的鉴定
Fig.2 Identification of BRA0434 gene deficientB.melitensis043 stain
2.3 羊种布氏菌043-ΔBRA0434缺失突变株生长特性检测 体外培养的羊种布氏菌043-ΔBRA0434缺失突变株与其亲本株羊种布氏菌043的生长曲线结果表明(图 3),羊种布氏菌043-ΔBRA0434缺失突变株与其亲本株羊种布氏菌043的的生长曲线趋于一致,即差异无统计学意义(P<0.05)。
图3 羊种布氏菌043-ΔBRA0434与羊种布氏菌043的生长曲线
Fig.3 Growth curve ofB.melitensis043-ΔBRA0434 andB.melitensis043 strains
2.4 动物感染试验 在免疫后7 d、14 d、21 d和28 d的每个时间点,每组取6只小鼠,断颈处死小鼠,无菌摘取脾脏并称重,比较小鼠脾脏中细菌的载菌量变化情况以及脾脏重量的变化情况(图 4)。脾脏CFU计数结果显示:与羊种布氏菌043相比,羊种布氏菌043-ΔBRA0434缺失突变株的载菌量有一定程度的下降,且羊种布氏菌043-ΔBR0524缺失突变株对小鼠脾脏重量变化的影响也较羊种布氏菌043有所降低。
2.5 侵染小鼠巨噬细胞试验 以下为羊种布氏菌043-ΔBRA0434缺失突变株和羊种布氏菌043在4 h、12 h、24 h和48 h等不同时间点侵染小鼠巨噬细胞(RAW264.7)的CFU计数详情(图 5)。结果显示:羊种布氏菌043-ΔBRA0434缺失突变株的毒力较其亲本株羊种布氏菌043有所下降,尤其是在染12 h的时候,其毒力下降较为明显。
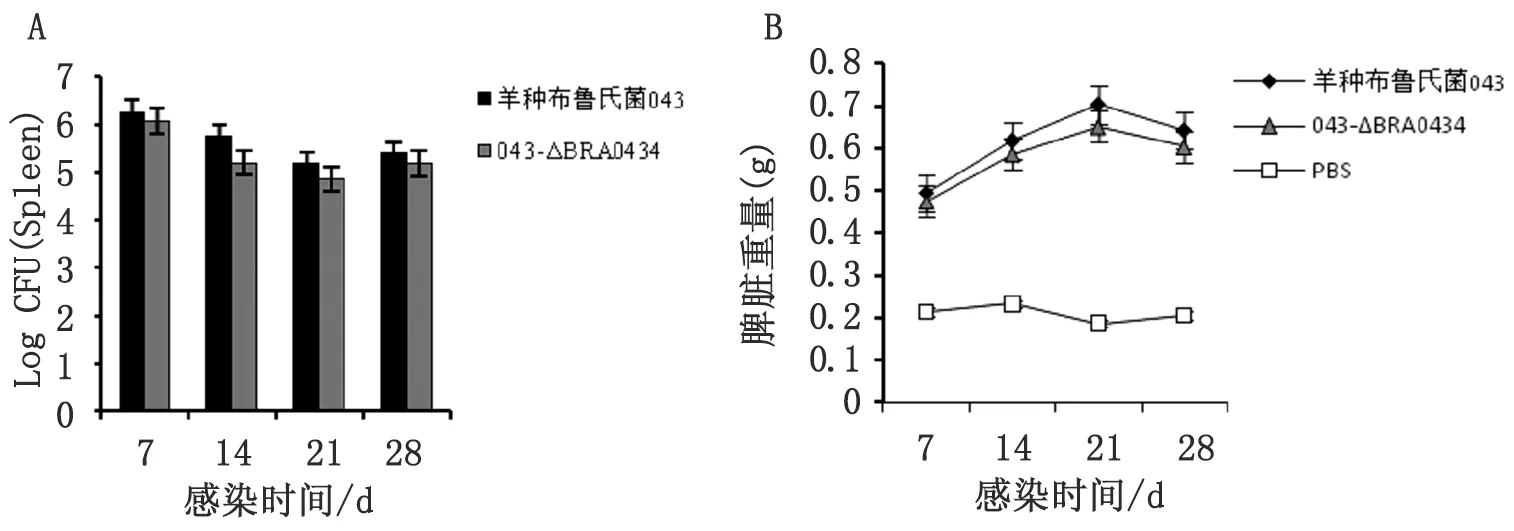
图4 感染后不同时间点小鼠脾脏载菌量变化(A)与脾脏重量变化(B)情况
Fig.4 Change of bacterial counts in the spleen (A) and weight profiles (B) after the infection ofBrucellaat different time points
图5 043亲本株和突变株胞内存活实验结果
3 讨 论
基因敲除是应用DNA同源重组的基本原理所发展起来的一门新型的生物学技术,它是通过一定的途径使机体特定的基因失活或者缺失的技术,即用设计的同源片段替代机体特定的靶基因片段,从而达到基因敲除的目的[12-13]。目前,该技术已经成为一种比较理想的改造生物遗传物质的生物学技术,尤其是未知基因功能的探索[14]。本研究就是利用同源重组的基本原理构建了羊种布氏菌043-ΔBRA0434缺失突变株,不同于传统布氏菌缺失突变株构建方法的是,本研究所采用的方法是以pMD18-T Simple载体为骨架来进行重组质粒的构建,这在一定程度上避免了传统方法中经典自杀质粒的整合所带来的问题(如构建所需的时间较长、分子操作需要在特殊的宿主菌体中来进行、操作过程较为繁琐、克隆的效率比较低等);同时,还提供了一个不同于传统方法中所选用的SacB筛选标记,本研究以卡那霉素抗性基因作为筛选标记,它能够通过一次筛选就可得到目的基因的缺失突变株,而且,还能够大大降低SacB所带来的假阳性检出概率,进而能够大大提高布氏菌缺失突变株构建的效率。
在本研究中,我们对羊种布氏菌043-ΔBRA0434缺失突变株与羊种布氏菌043亲本株的生长特性进行了检测,我们的研究结果表明BRA0434基因的缺失不会对羊种布氏菌043的生长规律或者生长状态产生明显的影响。通过采用侵染小鼠巨噬细胞(RAW264.7)试验、动物感染试验等方法初步探讨了BRA0434基因对羊种布氏菌043毒力的影响,我们的研究结果表明BRA0434基因的缺失则会对羊种布氏菌043毒力功能的发挥产生一定的影响。此外,经Blasst等生物信息学方法分析,BRA0434基因属于布氏菌的一个假定的未知蛋白,可能具有结合阳离子、参与碳水化合物代谢过程的功能。然而,若确定BRA0434基因在布氏菌中的具体功能,还需进行进一步的探索和研究。
[1]Copin R, Vitry MA, Hanot Mambres D, et al.Insitumicroscopy analysis reveals local innate immune response developed aroundBrucellainfected cells in resistant and susceptible mice[J]. PLoS Pathog, 2012, 8(3): e1002575. DOI:10.1371/journal.ppat.1002575
[2]Pasquevich KA, Garcia Samartino C, Coria LM, et al. The protein moiety of Brucella abortus outer membrane protein 16 is a new bacterial pathogen-associated molecular pattern that activates dendritic cells in vivo, induces a Th1 immune response, and is a promising self-adjuvanting vaccine against systemic and oral acquired brucellosis[J]. J Immunol, 2010, 184(9): 5200-5212. DOI:10.4049/jimmunol.0902209
[3]Zhang Y, Chen CF, Zhang H, et al. Construction and preliminary evaluation of immune effects of deletion mutant of WboA gene of Brucella melitensis vaccine M5-90[J]. Chin J Pre Vet Med, 2011, 33(7): 546-551. (in Chinese) 张艳, 陈创夫, 张辉, 等. 布鲁氏菌M5-90ΔWboA基因缺失株的构建及免疫效果的初步评价[J]. 中国预防兽医学报, 2011, 33(7): 546-551.
[4]Pan W, Wang JY, Zhao MQ, et al. Construction of umarkedbp26 gene-deleted strains ofBrucellaspp[J]. Chin Vet Sci, 2011, 41(3): 280-286. (in Chinese) 潘文, 王佳莹, 赵明秋, 等. 布鲁氏菌bp26 基因缺失株的构建[J]. 中国兽医科学, 2011, 41(3): 280-286.
[5]Huang XQ, Wang H, Ge YC, et al. Construction of fusion gene expression vector containingBrucellaOmp31 and EGFP and localization in mouse macrophage[J]. J Shihezi Univ (Nat Sci), 2012, 30(4): 444-447. (in Chinese) 黄小强, 王慧, 葛阳春, 等. 布鲁氏菌外膜蛋白omp31基因与EGFP基因融合表达载体的构建及其在巨噬细胞中的表达[J]. 石河子大学学报: 自然科学版, 2012, 30(4): 444-447.
[6]Davar SS, Reza AM, Sahar K, et al. Biological and immunological characteristics ofBrucellaabortusS99 major outer membrane proteins[J]. Jundishapur J Microbiol, 2012, 4(1): 29-36.
[7]Adone R, Muscillo M, La Rosa G, et al. Antigenic, immunologic and genetic characterization of rough strainsB.abortusRB51,B.melitensisB115 andB.melitensisB18[J]. PLoS One, 2011, 6(10): e24073. DOI:10.1371/journal.pone.0024073
[8]Gomez G, Pei J, Mwangi W, et al. Immunogenic and invasive properties ofBrucellamelitensis16M outer membrane protein vaccine candidates identified via a reverse vaccinology approach[J]. PLoS One, 2013, 8(3): e59751. DOI:10.1371/journal.pone.0059751
[9]Barquero-Calvo E, Martirosyan A, Ordonez-Rueda D, et al. Neutrophils exert a suppressive effect on Th1 responses to intracellular pathogenBrucellaabortus[J]. PLoS Pathog, 2013, 9(2): e1003167. DOI:10.1371/journal.ppat.1003167
[10]Durward M, Radhakrishnan G, Harms J, et al. Active evasion of CTL mediated killing and low quality responding CD8+T cells contribute to persistence of brucellosis[J]. PLoS One, 2012, 7(4): e34925. DOI:10.1371/journal.pone.0034925
[11]Bai YX, Yang Y, Wang YF, et al. Construction ofBrucelladeletion mutant by using T cloning vector[J]. Chin Biotechnol, 2010, 30(9): 62-67. (in Chinese) 白耀霞, 杨毅, 王玉飞, 等. 利用T载体克隆快速构建布鲁氏菌缺失突变株[J]. 中国生物工程杂志, 2010, 30(9): 62-67.
[12]Tsien JZ, Chen DF, Gerber D, et al. Subregion-and cell type-restricted gene knockout in mouse brain[J]. Cell, 1996, 87(7): 1317-1326. DOI:10.1016/S0092-8674(00)81826-7
[13]Falck J, Forment JV, Coates J, et al. CDK targeting of NBS1 promotes DNA-end resection, replication restart and homologous recombination[J]. EMBO Reports, 2012, 13(6): 561-568. DOI:10.1038/embor.2012.58
[14]Meyer M, de Angelis MH, Wurst W, et al. Gene targeting by homologous recombination in mouse zygotes mediated by zinc-finger nucleases[J]. Proc Natl Acad Sci U S A, 2010, 107(34): 15022-15026. DOI:10.1073/pnas.1009424107
Chen Chuang-fu, Email: ccf-xb@163.com
Construction and preliminary evaluation of virulence of BRA0434 gene deficientBrucellamelitensis043 strain
JI Tai-wang1,LI Zhi-qiang1,ZHANG Hui1,2,ZHANG Jun-bo1,
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832003,China;2.Co-InnovationCenterforZoonoticInfectiousDiseasesintheWesternregion,Shihezi, 832003,China)
To study the influence of BRA0434 gene on the virulence ofBrucellamelitensis(B.melitensis) 043 strain, the BRA0434 gene recombinant plasmid was constructed by replacing BRA0434 gene with kanamycin resistance gene based on the method of homologous recombination, and it was transformed intoB.melitensis043 competent cells. The BRA0434 gene deficientB.melitensis043 strain (043-ΔBRA0434) were identified by using the kanamycin resistance screening and detection primers. TheB.melitensis043-ΔBRA0434 did not occur resilience mutation within 15 generations and genetic stability. We usedB.melitensis043-ΔBRA0434 andB.melitensis043 strains to infect mice and each mice was inoculated intraperitoneally (i. p.) with 106CFU) and murine macrophage (RAW264.7) (MOI=100∶1). Results showed that the microbial load quantity ofB.melitensis043-ΔBRA0434 has decreased to some extent compared withB.melitensis043 strain, and the effect on spleen weight of mice has also declined to some extent compared withB.melitensis043 strain. Results of the infection of murine macrophage (RAW264.7) experiments were also conveyed with animal infected test. These results indicated that the deficiency of BRA0434 gene could make some impact on the virulence ofB.melitensis043 strain.
Brucella; BRA0434 gene; virulence; test
10.3969/cjz.j.issn.1002-2694.2015.08.011
国际科技合作项目(No.2013DFA32380), 国家自然科学基金项目(No.31460650)资助,纪太旺与李志强同等贡献
陈创夫,Email:ccf-xb@ 163. com
1.新疆石河子大学动物科技学院,石河子 832003; 2. 西部地区高发人兽共患传染性疾病防治协同创新中心,石河子 832003
Supported by the International Science and Technology Cooperation Project of China (No. 2013DFR30970), and the National Natural Science Foundation of China (No. 31460650)
R378
A
1002-2694(2015)08-0737-05
2014-04-28;
2015-02-21

