CD4+CD25+Treg细胞及其相关细胞因子在HBV感染孕妇胎盘组织中的表达
曾晓明,郑九生,龚维
(江西省妇幼保健院产科,江西 南昌330006)
乙型肝炎病毒(HBV)感染已成为全世界重大公共卫生问题,与各种肝脏疾病的发生、发展密切相关,我国乙肝病毒慢性携带者高达1亿多,其中30%~50%是通过母婴垂直传播感染导致[1],因此,故控制和减少HBV母婴垂直传播是防治HBV感染的重要途径。宫内感染是HBV母婴传播最主要途径,目前阻断HBV宫内感染的最有效方法为新生儿出生24h内联合使用乙肝高效价免疫球蛋白及乙肝疫苗,但HBeAg阳性孕妇的新生儿有5%~15%阻断失败。因此,有必要进一步研究HBV宫内感染机制,尤其是孕产妇HBeAg阳性时宫内感染率高的机制,以便探讨更有效的阻断方法。
目前对于HBV宫内感染的机制仍不十分明确。近年来,CD4+CD25+Treg细胞(Tregs)对HBV宫内感染影响的研究受到关注。FOXP3是目前公认的Tregs特异的免疫标志[2];IL-10、TGF-β1是Tregs所分泌的抑制性细胞因子,对Tregs的抑制功能具有重要作用[3]。现阶段对于Tregs与HBV宫内感染关系主要集中在孕妇外周血及新生儿脐带血Tregs表达的研究,对于孕妇胎盘组织中细胞因子水平与HBV宫内感染发生的研究较少,在这方面有必要进一步探索。本研究采用免疫组化(二步法)检测HBV宫内感染孕妇胎盘组织中Foxp3表达,将Foxp3作为检测Tregs的指标;同时采用免疫组化法检测胎盘组织中细胞因子IL-10及TGF-β1的表达,研究HBV感染孕妇胎盘组织中Tregs及其相关因子与HBV宫内感染的相关性,探讨孕产妇HBeAg阳性时宫内感染发生率高的机制。
1 资料与方法
1.1 研究对象 选择2012年6月至2014年10月在我院分娩109例HBV感染孕妇作为研究对象(其中HBsAg及HBeAg双阳性58例;HBsAg阳性且HBeAg阴性孕妇51例),纳入标准:(1)足月、单胎妊娠;(2)HBsAg阳性但肝功能正常;(3)无子痫前期、胎儿生长受限等并发症。HBV宫内感染诊断标准:脐静脉血检测提示HBsAg阳性或合并HBVDNA阳性,考虑HBV宫内感染[4]。
按照HBV宫内感染诊断标准,将发生HBV宫内感染的孕妇设为宫内感染组,将未发生宫内感染的孕妇设为宫内未感染组,两组孕妇的临床资料(年龄、孕产次、孕周)无统计学差异(P>0.05);依据孕妇HBV血清学标志物检查结果,将HBsAg及HBeAg双阳性孕妇设为HBeAg阳性组;将HBsAg阳性且HBeAg阴性孕妇设为HBeAg阴性组,两组孕妇的临床资料(年龄、孕产次、孕周)无统计学差异(P>0.05)。
1.2 主要试剂 Foxp3鼠抗人单克隆抗体、IL-10兔抗人多克隆抗体购自艾博抗公司;TGF-β1兔抗人多克隆抗体购自福州迈新公司;通用型二抗、DAB试剂盒购自中杉金桥公司。
1.3 实验方法 标本采集:新生儿娩出并断脐后,在胎盘娩出前,抽5ml脐静脉血,送本院检验科检测脐带血HBV-DNA以及乙肝六项;娩出胎盘后,快速用手术刀取小块包括母体面和胎儿面的胎盘组织,采取的部位在胎盘中央附近,避开钙化点,采取面积约2cm×2cm×2cm大小 ,生理盐水洗净,10%多聚甲醛液中固定24h,在病理科脱水,常规包埋制成石蜡块,4℃冰箱内放置保存待用。
采用免疫组化(二步法)检测宫内感染组及未宫内感染组孕妇胎盘组织中Foxp3、IL-10及TGF-β1的表达,Foxp3工作浓度分别为 1:200,IL-10及TGF-β1工作浓度为1:100,具体操作同说明书。每批染色均设阳性对照(Foxp3、IL-10阳性对照片由abcam公司提供,TGF-β1阳性对照片由福州迈新公司提供)和阴性对照(PBS代替一抗)。
1.4 结果判定 阳性细胞判定:细胞具有完整结构,细胞浆呈黄色或棕黄色颗粒,细胞核为蓝色者为阳性细胞;阴性细胞判定:细胞具有完整结构,细胞浆未被染成棕褐色,显示为浅蓝色。半定量分析:在显微镜200放大倍数下观察阳性细胞,每张切片随机观察5个视野,综合阳性细胞所占比例(A)及细胞浆着色深浅(B)计分。 阳性细胞所占比例 (A):<5% 计 0分,5%~25%计 1分,26%~50%计2分,>50% 计3分;细胞浆着色深浅(B):无着色计0分,浅棕黄色计1分,黄色计2分,棕褐色计3分。两项指标的计分数相乘(A×B)进行半定量:积分0分为阴性,1~3分为轻度阳性,4~6分为中度阳性,7~9 分为强阳性[5]。
1.5 统计学方法 应用SPSSl7.0软件分析数据,计数资料比较采用χ2检验;细胞因子表达强度采用等级资料秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 HBV宫内感染率 109例HBV感染孕妇共发生宫内感染12例,宫内感染率为11.01%。采用χ2检验方法统计分析,结果显示HBeAg阳性组宫内感染率明显高于HBeAg阴性组(P<0.01),见表1。

表1 HBV宫内感染率
2.2 胎盘组织中 Foxp3、IL-10、TGF-β1 阳性细胞定位及表达部位 胎盘组织的病理图片均为DAB染色,Foxp3、TGF-β1及IL-10阳性细胞都主要定位于胎盘绒毛滋养细胞、绒毛血管内皮细胞、蜕膜细胞,在绒毛间质细胞有少量表达,表达部位在细胞浆。Foxp3、IL-10、TGF-β1阳性细胞在各组中分布基本一致。各组胎盘组织中Foxp3、IL-10、TGF-β1的表达及PBS阴性对照见图1~6。
2.3 宫内感染组与宫内未感染组孕妇胎盘组织中Foxp3、IL-10、TGF-β1表达的阳性率比较 宫内感染组 Foxp3、IL-10、TGF-β1 在胎盘组织中较宫内未感染组表达的阳性率显著增高,采用秩和检验
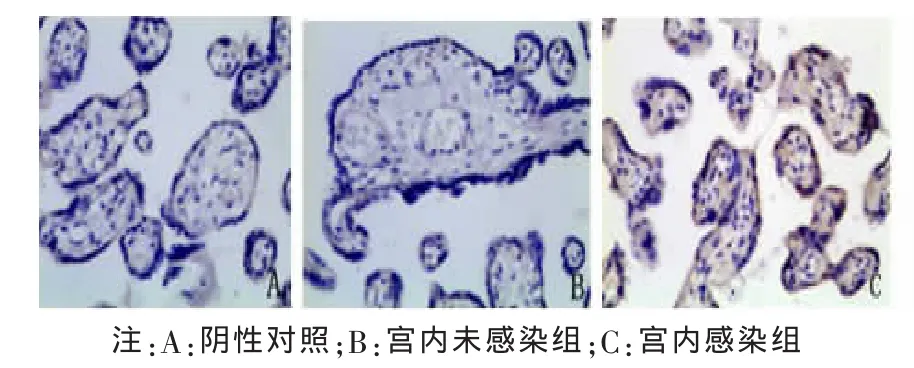
图1 Foxp3在宫内未感染组与宫内感染组胎盘组织中的表达(×200)
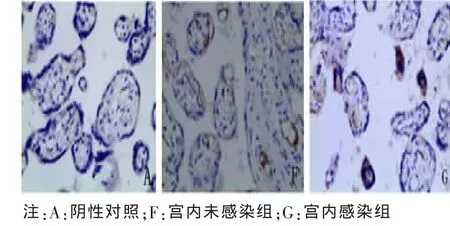
图3 TGF-β1在宫内未感染组与宫内感染组胎盘组织中的表达(×200)
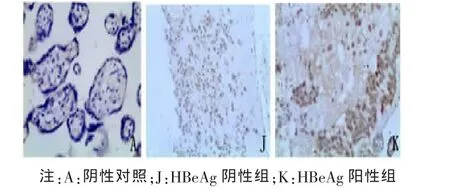
图5 IL-10在HBeAg阴性组与HBeAg阳性组胎盘组织中的表达(×200)
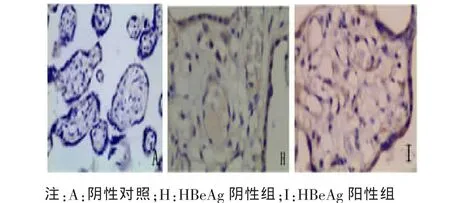
图4 Foxp3在HBeAg阴性组与HBeAg阳性组胎盘组织中的表达(×200)
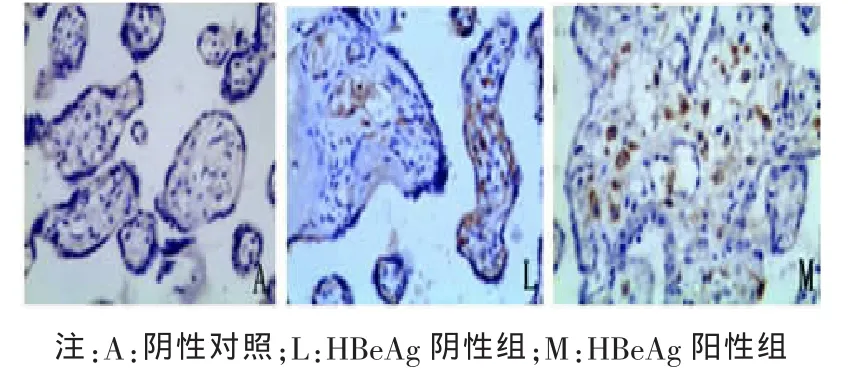
图6 TGF-β1在 HBeAg阴性组与HBeAg阳性组胎盘组织中的表达(×200)
方法统计分析,显示差异有统计学意义(P<0.05),见 表2~4。

表2 宫内感染组与宫内未感染组孕妇胎盘组织中Foxp3表达的阳性率[n(%)]

表3 宫内感染组与宫内未感染组孕妇孕妇胎盘组织中IL-10表达的阳性率[n(%)]

表4 宫内感染组与宫内未感染组孕妇胎盘组织中TGF-β1表达的阳性率[n(%)]
2.4 HBeAg阳性组及HBeAg阳性组胎盘组织中Foxp3、IL-10、TGF-β1 表达的阳性率比较 HBeAg阳性组 Foxp3、IL-10、TGF-β1 在胎盘组织中较HBeAg阴性组表达的阳性率显著增高,采用秩和检验方法统计分析,显示差异有统计学意义 (P<0.05),见表 5~7。
3 讨论
3.1 胎盘组织中CD4+CD25+Treg细胞与HBV宫内感染发生的关系 Tregs是一种具有抑制功能的T细胞亚群 ,能抑制自身反应性T淋巴细胞、CD4+和CD8+T细胞、NK细胞、B细胞及其他免疫细胞的功能[6]。其表面表达很多表面分子,主要有FOXP3、TNFR、CD122、CTLA4、CD134 等[7], 其 中 Foxp3 是目前公认的Tregs特异的免疫标志,国内也有许多研究检测胎盘组织中Foxp3表达作为胎盘组织Tregs 的指标[8,9]。

表5 HBeAg阳性组与HBeAg阴性组孕妇胎盘组织中Foxp3表达的阳性率[例(%)]

表6 HBeAg阳性组与HBeAg阴性组孕妇胎盘组织中IL-10表达的阳性率[例(%)]

表7 HBeAg阳性组与HBeAg阴性组孕妇胎盘组织中TGF-β1表达的阳性率[例(%)]
辅助性T淋巴细胞 (Th)属于CD4+T细胞亚群,分为Th1和 Th2细胞,Th1细胞产生IL-2和IFN-γ 等细胞因子,Th2 细胞产生 lL-4、IL-10、与IL-13等细胞因子,Th1/Th2细胞处于动态平衡才能维持细胞免疫和体液免疫正常的功能。近年许多研究表明,发生HBV宫内感染时,新生儿及其母亲外周血 Tregs数量增多,并存在Th1/Th2细胞免疫失衡[10,11]。郑九生等采用流式细胞仪检测HBV宫内感染的母亲及其新生儿Tregs表达水平和DAS-ELISA法检测IFN-γ水平及IL-4水平,提示宫内感染组孕妇存在Th1/Th2细胞免疫失衡,Th1细胞免疫反应下调而 Th2细胞免疫反应增强,病毒难以被清除,参与HBV宫内感染[12]。
胎盘中绒毛间隙充满着母体的血液,HBV病毒可以通过感染胎盘再而感染胎儿[13]。但胎盘感染发生的细胞因子机制尚不明确,现阶段对于Tregs与HBV宫内感染关系主要集中在孕妇外周血及新生儿脐带血Tregs水平的研究,对于孕妇胎盘组织中细胞因子水平与HBV宫内感染发生的研究较少,有必要进一步研究。本研究采用免疫组化(二步法)检测HBV感染孕妇胎盘组织中Foxp3表达水平,作为检测 Tregs的指标,研究胎盘组织Tregs表达与HBV宫内感染发生的关系。我们的研究显示胎盘组织中Foxp3阳性细胞主要定位于胎盘绒毛滋养细胞、绒毛血管内皮细胞、蜕膜细胞,在绒毛间质细胞有少量表达,主要表达部位为细胞浆,这与何永文等报道基本一致[8];宫内感染组孕妇胎盘组织中Foxp3表达阳性率91.6%,明显高于宫内未感染组的42.2%,说明Tregs数量增多可能是HBV宫内感染发生的危险因素之一,推测胎盘感染HBV时,Tregs通过其免疫抑制功能,抑制HBV特异性免疫应答,使清除HBV和抑制炎症反应对组织的损伤达到免疫平衡,当Tregs增多,这种免疫平衡被打破,胎盘组织中HBV难以被清除,导致胎盘感染持续,参与HBV宫内感染的发生。但是目前国内外对于胎盘组织中Tregs与HBV宫内感染的相关研究不多,其发生机制并不明确,胎盘组织中Tregs增多在HBV宫内感染的发生中是否起关键作用并不清楚。
3.2 胎盘组织中TGF-β1和IL-10与HBV宫内感染 TGF-β1和IL-10是具有免疫抑制作用的细胞因子,主要是由Tregs分泌产生,妊娠过程中胎盘滋养细胞也可产生。TGF-β1可以明显抑制T细胞增生及NK细胞、CTL的活性;IL-10可阻止T细胞受体介导的CD4+T细胞的活化,能抑制TNF等细胞因子,两者在免疫功能调节中具有重要作用。周建研究结果发现慢性乙肝患者HBV载量越高,IL-10的水平越高,说明IL-10水平增高不利于HBV 的清除[14]。
解长银等[15]发现,TGF-β1主要表达于胎盘绒毛滋养细胞和蜕膜细胞,主要表达部位为细胞浆 ;赵芳等[16]发现,IL-10主要表达于胎盘合体滋养细胞和细胞滋养细胞中。本实验应用免疫组化二步法对HBV感染孕妇患者胎盘的TGF-β1和IL-10的表达进行定位和半定量检测,结果显示,TGF-β1及IL-10阳性细胞都主要定位于胎盘绒毛滋养细胞、绒毛血管内皮细胞、蜕膜细胞,在绒毛间质细胞有少量表达,主要表达部位在细胞浆。与解长银、赵芳等报道分布基本一致。
同时,我们的研究还显示HBV宫内感染孕妇胎盘组织中TGF-β1和IL-10阳性表达率均较宫内未感染组明显增高,说明胎盘组织中细胞因子IL-10、TGF-β1表达水平升高可能是HBV宫内感染发生机制之一,推测胎盘组织中细胞因子TGF-β1和IL-10表达水平升高时,通过其免疫抑制作用,导致Th1/Th2细胞免疫失衡,HBV特异性免疫应答受到抑制,胎盘组织中病毒难以被清除,导致HBV宫内感染的发生。
3.3 HBeAg阳性与HBV宫内感染 HBeAg是HBV复制和传染的指标,大量研究表明孕妇血HBeAg阳性是HBV宫内感染的高危因素。谢小娟等[17]发现大三阳孕妇宫内感染率其新生儿HBV感染率明显升高,且随HBV-DNA量的升高而增加。我们的研究发现HBeAg阳性组宫内感染率18.96%,远高于HBeAg阴性组(1.96%),差异有显著意义,说明孕产妇HBeAg阳性会增加HBV宫内感染发生率,这与谢小娟等研究结果一致。
目前关于孕产妇HBeAg阳性增加HBV宫内感染发生风险的机制存在争议,马丽娟等[18]研究认为孕妇HBeAg阳性者其新生儿存在Th1/Th2细胞免疫失衡,导致不能及时有效地清除HBV使宫内感染易于发生;张永臣等[19]研究发现HBeAg阳性组孕产妇的新生儿外周血Tregs明显高于HBeAg阴性组,导致新生儿免疫调节功能低下;也有学者认为HBeAg导致滋养细胞发育不良,使胎盘丧失其对胎儿的屏障保护作用,从而导致宫内感染的发生;而张薇莉等[20]认为HBeAg可选择性通过胎盘屏障进入胎儿体内,使新生儿出生后出现HBeAg血症;
而我们的研究显示HBeAg阳性组胎盘组织中Foxp3、IL-10、TGF-β1 较 HBeAg 阴性组阳性表达率显著增高,差异有统计学意义(P<0.05),说明孕产妇HBeAg阳性时,其胎盘组织中存在Tregs增多及其相关因子表达水平升高,推测这可能是HBeAg阳性孕产妇HBV宫内感染发生率高的机制之一。
3.4 总结与展望 综上所述,我们的研究说明:HBV感染孕妇胎盘组织中Tregs增多可能是发生HBV宫内感染的危险因素之一;胎盘组织中IL-10和TGF-β1表达增高可能是HBV宫内感染的发生机制之一;孕产妇HBeAg阳性时,其胎盘组织中存在Tregs增多及其相关因子表达水平升高,推测这可能是HBeAg阳性孕产妇HBV宫内感染发生率高的机制之一。我们推测Tregs增多及其相关因子表达水平升高时,通过其免疫抑制功能,导致Th1/Th2细胞免疫失衡,抑制HBV特异性免疫应答,使胎盘组织中病毒难以被清除,导致感染持续,进一步导致HBV宫内感染发生。
但是目前国内外对于胎盘组织中Tregs与HBV宫内感染的相关研究不多,胎盘组织中Tregs增多及其相关因子表达水平升高在HBV宫内感染的发生中是否起关键作用并不清楚,仍然需要进一步研究,以探索预防HBV宫内感染的更好办法。
[1]侯稳,孙琳,王健.HBV孕妇感染现状及影响因素分析[J].中国公共卫生,2008,24(2):167-168.
[2]Haiqi H,Yong Z,Yi L.Transcriptional regulation of Foxp3 in regulatory T cells[J].Immunobiology,2011,216(6):678-685.
[3]Liu G,Ma H,Qiu L,et al.Phenotypic and functional switch of macro-Phages induced by regulatory CD4+CD25+T cells inmice[J].lmmunol Cell Biol,20ll,89(1):130-142.
[4]罗琼,李景平.IL-12的表达与细胞因子IFN-γ、IL-2在HBV宫内感染的相关性[J].山西医科大学学报,2013,44(8):645-648.
[5]廖志琼,甘婷,陈希明,等.TGFβ1在子痫前期患者胎盘组织中的表达[J].解剖学研究,2012,34(1):1-4.
[6]Turner MS,Kane LP,More PA.Dominant role of antigen dose in CD4+Foxp3 regulatory t cell induction and expansion[J].j Immunol,2009,183(8):4895-4903.
[7]Wing K,Onishi Y,Prieto-Martin P,et al.CTLA-4 control over Foxp3 regulatory T cell function[J].Science,2008,322:271-275.
[8]何永文,方朝辉,廖志琼,等.Foxp3在子痫前期患者胎盘的表达变化[J].解剖学研究,2012,34(3):199-201.
[9]赵春辉,夏良萍,张晓凤,等.重度子痫前期患者外周血及胎盘组织Th17和Treg细胞的表达[J].中国妇幼保健,2013,28(31):5189-5192.
[10]高怡,郭健,付振东,等.HBV宫内感染新生儿外周血调节性T细胞表达[J].中国公共卫生,2013,29(4):488-490.
[11]吕洁玉,杜二球,陈永利,等.CD4+CD25+调节性T细胞在HBV宫内感染的表达及意义[J].湖北医药学院学报,2011,30(3):278-280.
[12]郑九生,邓灵.CD4+CD25+调节性T细胞表达水平对Th1/Th2类细胞免疫平衡的作用及与HBV宫内感染的相关性[J].南昌大学学报(医学版),2014,54(4):18-21.
[13]AI-Buhtori M,Moore L,Benbow Ew,et al.Viral detection in hydrops fetalis,spontaneous abortion,and unexplained fetal death in utero[J].JMed Virol,2011,83(4):679-684.
[14]周建.慢乙肝患者HBV-DNA载量、I-10水平与肝损伤的相关性[J].实验与检验医学,2010,28(6):591-592.
[15]解长银,臧晓娟,魏红,等.子痫前期患者胎盘组织及血浆中 TGF-β1的表达及临床意义[J].中华临床医师杂志(电子版),2013,24(7):11427-11430.
[16]赵芳,陈铎,吴燕菁,等.吲哚胺 2,3-二氧化酶和白细胞介素 10在子痫前期患者胎盘组织中的表达[J].中华妇产科杂志,2009,4(3):219-220.
[17]谢小娟,李小侠,李芒会,等.孕产妇及其新生儿的HBV检测结果相关性分析[J].现代检验医学杂志,2015,30(3):80-82.
[18]马丽娟,马玉燕,王磊一,等.HBeAg乙型肝炎病毒宫内感染的关系[J].山东大学学报(医学版),2008,46(5):528-530.
[19]张永臣,王念跃,王佳,等.HBsAg和HBeAg阳性孕妇新生儿血清HbeAg与调节性T细胞的关系 [J].临床检验杂志,2010,28(3):236-237.
[20]张薇莉,赵隽.乙型肝炎病毒感染孕妇的新生儿血清乙肝病毒标志物动态变化分析[J].中国生殖健康杂志,2014,25(6):499-504.

