微卫星标记在布氏田鼠封闭群遗传结构研究中的应用
张 曼,施海霞,宋铭晶
(中国医学科学院医学实验动物研究所北京协和医学院比较医学中心卫生部人类疾病比较医学重点实验室,北京 100021)
微卫星标记在布氏田鼠封闭群遗传结构研究中的应用
张 曼,施海霞,宋铭晶
(中国医学科学院医学实验动物研究所北京协和医学院比较医学中心卫生部人类疾病比较医学重点实验室,北京 100021)
目的使用微卫星标记分析连续三代布氏田鼠封闭群遗传结构的稳定性。方法使用高盐沉淀法从鼠尾中提取布氏田鼠基因组DNA,将筛选出7对微卫星引物并用荧光标记(Fam),然后对布氏田鼠封闭群连续三代的基因组DNA进行PCR扩增,测序仪检测PCR产物,整理原始数据并对布氏田鼠基因组DNA进行微卫星分析。结果 由平均有效杂合度和多态信息含量的分析得出该布氏田鼠种群传代过程中保持着较高而且稳定的杂合度。结论该实验结果说明本实验室布氏田鼠封闭群的遗传结构比较稳定。
布氏田鼠;封闭群;遗传结构;微卫星DNA标记
2007年从中国农业大学引入了已在室内随机交配3年的布氏田鼠(Brandt’s vole,lasiopodomys brandtii)普通级实验室种群,在本实验室连续繁殖3年,并对该种群进行了系统药物净化和同胞选择筛选。2011~2013年经清洁级实验动物微生物和寄生虫学检测达到了清洁级的标准[1],到目前已建立了连续繁殖8代的清洁级布氏田鼠远交系(封闭群),同时2013年我们尝试使用剖腹产净化和SPF级ICR雌鼠代乳得到净化的布氏田鼠仔鼠,剖腹产子代通过了SPF级的检测,说明本实验室有繁育和净化得到SPF级布氏田鼠的能力[2]。
封闭群遗传结构的稳定是该封闭群维持遗传背景清晰和优质的必要条件,因此我们利用微卫星标记(simple sequence repeats,SSR)技术检测布氏田鼠封闭群连续三代(F6~F8)的遗传结构的稳定性,分析布氏田鼠封闭群遗传结构的变化,进而推测在传代中种群大小的变化,对等位基因多样性的影响。最终,我们旨在通过SSR检测和合理繁育配对建立经济高效的布氏田鼠封闭群的传代体系。
SSR标记是被广泛应用并为学者认可的检测不同动物种群遗传多态性的有效工具[3],蔡磊等[4]检测采集于广东深圳大鹏湾浅水区的诸氏鲻虾虎鱼的平均多态信息指数(polymorphism information content,PIC)为0.447;安徽大学笼养的野外种群猕猴的平均PIC值为0.730[5]。而实验室内的实验动物种群也利用PIC值作为其遗传多态性的重要检测指标之一,李芳芳[6]等研究的两个豚鼠封闭群(1994年引自日本,封闭至今;2004年引自Charles River)的平均PIC值为0.552;班建荣等[7]检测引自兰州公司实验动物室并连续封闭6年的SPF级KM小鼠封闭群PIC值为0.368~0.830;申幸娇等人检测来自北京三个单位的封闭群兔(SPF级日本大耳白兔,SPF级新西兰白兔,SPF级青紫蓝兔)平均PIC值为0.410、0.549、0.470[8]。但还未见有学者尝试运用SSR标记检测连续传代的封闭群的遗传稳定性,从而探索将野生种群在实验室内以最优的繁育规模繁育,以实现该动物的实验动物化,因此本实验为田鼠类动物封闭群的建立和实验动物化研究提供借鉴。
1 材料和方法
1.1 材料
1.1.1 实验动物
清洁级的布氏田鼠饲养在独立送排风净化动物笼(individually ventilated cage,IVC)中,饲养室温度22℃ ~25℃,湿度50% ~70%,光照条件14L: 10D,自由摄食和饮水。动物饮水、垫料和笼具均经高压灭菌处理,饲料经CO60照射消毒达到SPF级动物饲料标准。饲料生产许可证编号【SCXK(京) (2012、2013、2014)-0008】。动物实验批准号,ILASPG-2014-011。
1.1.2 试剂与仪器
1.1.2.1 试剂
蛋白酶K(SIGMA公司)
Taq DNA聚合酶、10×PCR buffer(Mg2+)、dNTP、DNA Marker(20 bp)(TaKaRa)
胶回收试剂盒(BIOMIGA公司)
KAPA Taq HotStart扩增试剂(KAPA公司)
1.1.2.2 仪器
7100型全自动生化测定仪(日本日立公司产品),酶标仪(Thermo),ROX-500分子量内标(北京阅微基因技术有限公司),BC-subMIDI电泳仪(北京六一仪器厂),JY300C电泳槽(北京君意东方电泳设备有限公司),NAS-99分光光度计(ACTGene公司),BioSens SC 810B凝胶成像仪(上海山富科学仪器有限公司),GeneAmp 9600 PCR仪(ABI公司),3730XL DNA analyzer(ABI公司)
1.2 实验方法
1.2.1 DNA的提取
布氏田鼠基因组DNA来自连续三代的清洁级布氏田鼠幼仔(F6代50只,F7代36只,F8代40只,雌雄各半),采用高盐沉淀法提取,具体步骤如下:取布氏田鼠尾部组织置于1.5 mL离心管中,加入500 μL鼠尾裂解液(Tris·HCL 10 mmol/L,Na2EDTA 0.1 mol/L,pH8.0配制)和10 μL蛋白酶K(20 mg/mL),55℃消化过夜,待鼠尾组织完全溶解仅有少许尾骨残骸后,加入300 μL 6 mol/L饱和NaCL混匀,冰上静置15 min,12000 r/min离心15 min后取上清,加入与上清等体积的异丙醇沉淀DNA,70%乙醇清洗两次,然后倒掉乙醇自然风干,200 μL TE溶解沉淀,分光光度计检测DNA浓度,调整样品浓度至10 ng/μL。
1.2.2 引物的筛选
随机选取1只布氏田鼠基因组DNA用10条微卫星DNA引物[9]进行PCR扩增,用胶回收试剂盒回收目的片段后溶至30 μL无菌水中,取20 μL做基因组测序服务。根据测序结果筛选出与核心序列一致的7条引物,用带有荧光标记(Fam)的上游引物对布氏田鼠的基因组DNA进行微卫星分析。7个布氏田鼠微卫星位点及其特征描述见表1。

表1 7个布氏田鼠微卫星位点及其特征描述Tab.1 The primer and characteristics of 7 microsatellites loci for Brandt’s voles
1.2.3 PCR反应条件及电泳
利用7对微卫星引物对布氏田鼠基因组DNA进行PCR扩增,反应条件如下:10×Buffer(Mg2+),1.5 μL;2.5 mmol/L dNTP,1.2 μL;上游和下游引物(5 μmol/L),1 μL;DNA Taq聚合酶(5 U/μL),0.1 μL;模板DNA,1 μL;3d H2O补齐至15 μL。PCR反应程序为预变性95℃,5 min,1个循环;然后进行35个循环,包括变性95℃,30 s;退火(各引物最适退火温度),30 s,延伸72℃,30 s;最后延伸72℃,7 min;之后进入4℃保存。PCR产物用3%琼脂糖凝胶电泳检测。
1.2.4 3730 XL测序仪检测
在96孔板中每孔加入分子量内标和甲酰胺混合液(0.5:8.5)9 μL,PCR产物1 μL,轻轻混匀后进行上机检测,95℃变性3 min。
1.2.5 数据统计和分析
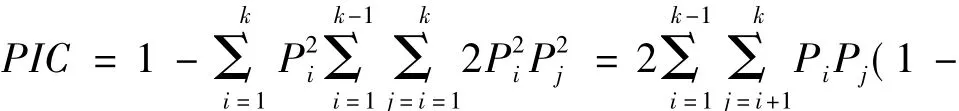
2 结果
2.1 微卫星引物扩增及多态性
选取7个微卫星座位检测三代布氏田鼠封闭群的遗传多态性,发现DQ886927座位有12个等位基因,DQ886932座位有11个等位基因,DQ886926座位有10个等位基因,DQ886925座位有9个等位基因,具有丰富的多态性,DQ886929和DQ886930座位各有7个等位基因,DQ886934座位最少,为4个等位基因。7个微卫星座位的平均等位基因数为8.57个。
2.2 杂合度和多态信息含量
三代布氏田鼠种群7个基因座位的观测等位基因数(observed number of alleles)、Ho、He和PIC值见表2。由表2中可以计算出,F6代布氏田鼠种群7个不同座位的平均期望杂合度为0.606,F7代布氏田鼠种群 7个不同座位的平均期望杂合度为0.512,F8代布氏田鼠种群7个不同座位的平均期望杂合度为0.507。
3 讨论
目前常用的分子标记技术主要有RFLP、RAPD、AFLP、SSR、SNP和EST技术等。RFLP标记为显性遗传,但对DNA多态性的检出灵敏度不高;RAPD技术为显性遗传,不能识别杂合子位点;AFLP技术对基因组纯度和反应条件要求较高[10-11];SNP技术和EST技术多用于大规模的DNA序列检测[12]。较之于上述5种分子标记技术,微卫星DNA分布广泛,为共显性标记,具有较高的多态性和重复性,对DNA的浓度要求不高,可提供高分辨率的遗传信息,适合于个体水平和种群水平上遗传结构的研究[13]。
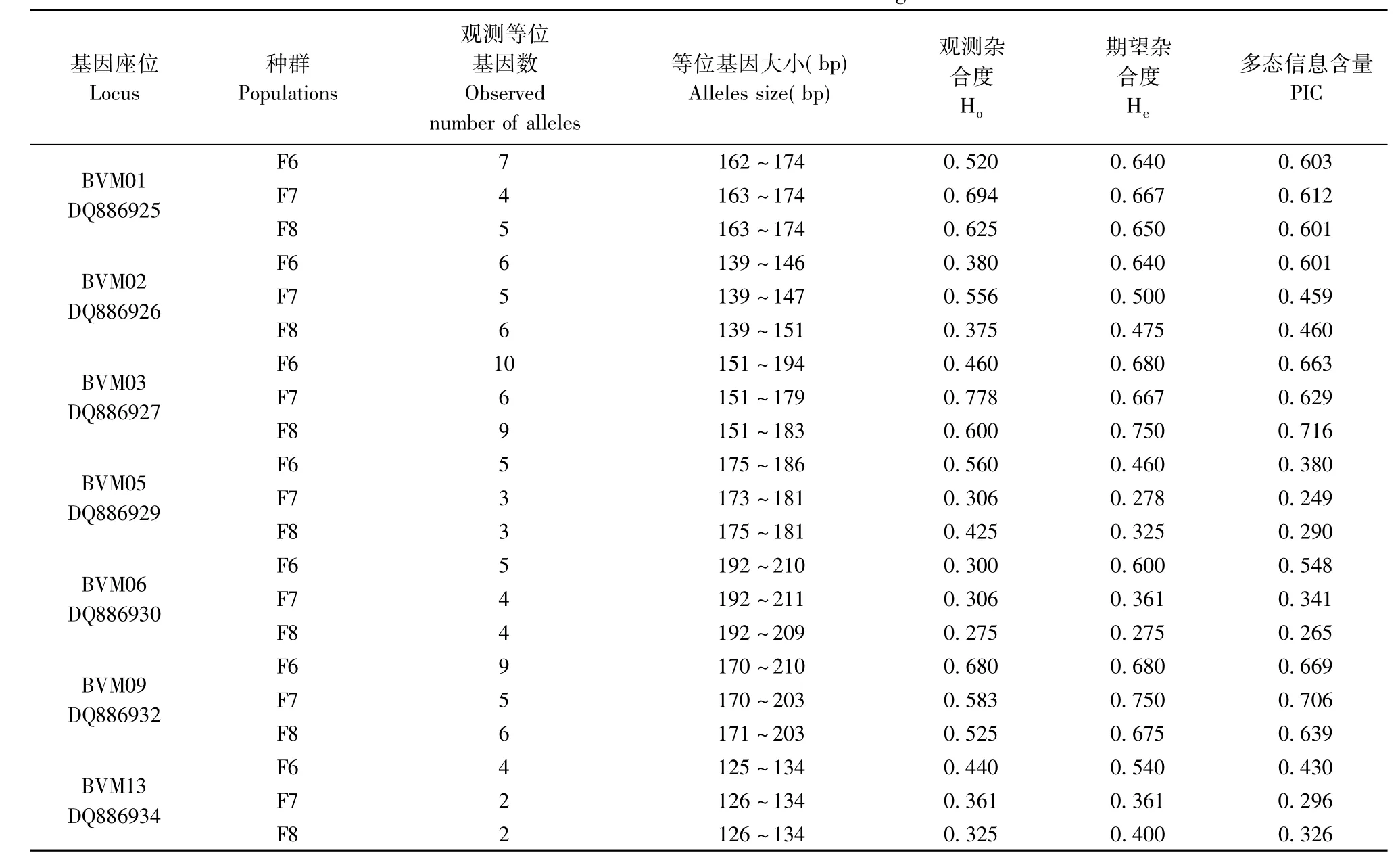
表2 三代布氏田鼠种群7个基因座位的遗传特点Tab.2 Genetic characterisitics of 7 microsatellite locus in three generations of Brandt’s voles
目前国内没有国家标准或行业标准作为指导实验动物封闭群遗传多样性的建立和维持的规范。He和PIC值是评价种群遗传多态性量化的主要指标,一般He或PIC值越大,该基因座位杂合子的比例就越大,携带的遗传信息量就越大。本研究中,7个微卫星座位各自在连续三代的布氏田鼠种群传代下的平均PIC和He值分别为DQ886925:0.606和0.652;DQ886926:0.507和0.538;DQ886927:0.669和0.699;DQ886929:0.306和 0.354;DQ886930: 0.385 和 0.412;DQ886932:0.672 和 0.702; DQ886934:0.350和0.434,说明本实验室连续繁殖6代以上的布氏田鼠种群的平均PIC值在0.306~0.672,平均He值在0.354~0.702。同有关学者研究的种群的遗传多态性相比较,如:C Marchi等[14]2007~2008年研究丹麦两个农业区域和一个自然区域的东方田鼠种群(He:0.671~0.835)、Magdalena Mikowska[15]2009年取自小岛、大陆、重金属污染区共10个地域的堤岸田鼠种群(He:0.578~0.869)、Claudia Melis等[16]2006年在挪威北部的14个水鼠种群(He:0.115~0.486)等,本实验室的布氏田鼠封闭群在实验室繁育规模较小的情况下,也没有发生明显的遗传漂变。并且genepop4.2的 Hardy-Weinberg test分析得出三代布氏田鼠种群均达到平衡状态,因此可以判定该群体在传代过程中保持着合格封闭群的遗传结构。
总之,本研究表明该布氏田鼠封闭群在连续传代过程中保持着稳定的遗传结构和高度的遗传多态性,该结论为我们建立最优化的传代体系提供了重要的理论支撑。鉴于目前国内还没有对封闭群的遗传多样性有指导性的要求,本研究在25对繁育笼的情况下,保持了该封闭群的遗传多态的稳定性,为田鼠类野生动物的引种和繁育提供了借鉴。
[1]梁虹,潘思丹,施海霞,等.布氏田鼠封闭群建立及繁殖特性研究[J].中国卫生检验杂志,2009,19(12):2767-2769.
[2]潘思丹,张曼,施海霞,等.布氏田鼠剖腹产净化技术的建立[J].中国卫生检验杂志,2014,24(3):352-354.
[3]Deng Wang,Yongwang Guo,Dazhao Shi.Genetic structure of Brandt’s vole(Lasiopodomys brandtii)populations in Inner Mongolia, China based on microsatellite analysis[J].Conservation Genetics.2011,12(3):659-667.
[4]蔡磊,陈小曲,郑伟强,等.诸氏鲻虾虎鱼多态性微卫星标记的开发及评价[J].中国实验动物学报,2015(1):57-62.
[5]徐玉蕊.安徽野生猕猴实验动物化及其种质特异性研究[D].安徽大学,2013.
[6]李芳芳,魏杰,王洪,等.应用微卫星标记对两个豚鼠封闭群的遗传学研究[J].中国比较医学杂志,2014,24(12):33-46.
[7]班建荣,胡芹宝,张新创.两个封闭群SPF级昆明小鼠遗传背景调查[J].微生物学免疫学进展,2013,41(5):6-9.
[8]申幸娇,岳秉飞.应用微卫星标DNA记对三个封闭群兔遗传分析[J].中国比较医学杂志,2013(9):12-18.
[9]Wang Deng,Shi Dazhao.Isolation and characterization of polymorphic microsatellite loci from Brandt’ s voles (Lasiopodomys brandtii)[J].Molecular Ecology Notes,2007,7 (4):671-673.
[10] Greg W.DOUHAN,Lucie VINCENOT,Herve GRYTA,et al.Population geneticsofectomycorrhizalfungi: from current knowledge to emerging directions[J].FUNGAL BIOLOGIY,2011,115:569-597.
[11]Milee Agarwal,Neeta Shrivastaca,Harish Padh.Advances in molecular marker techniques and their applications in plant sciences[J].Plant Cell Reports,2008,27:617-631.
[12]唐立群,肖层林,王伟平.SNP分子标记的研究及其应用进展[J].中国农学通报,2012,28(12):154-158.
[13]Alisoltani A,Fallahi H,Shiran B,et al.RNA~Seq SSRs and small RNA~Seq SSRs:New approaches in cancer biomarker discovery[J].Gene,2015,560(1):34-43.
[14]C Marchi,LW Andersen,C Damgaard.Gene flow and population structure of a common agricultural wild species(Microtus agrestis) underdifferentland managementregimes[J].Heredity,2013,111:486-494.
[15]Magdalena Mikowska,Aneta Gaura,Edyta Sadowska,et al.Genetic Variation in Bank Vole Populations in Natural and Metal~ Contaminated Areas[J]. Archives ofEnvironmental Contamination Toxicology,2014,67:535-546.
[16]Claudia Melis,Asa Alexandra Borg,Henrik Jensen,et al.Genetic variability and structure of the water vole Arvicola amphibius across four metapopulations in northern Norway[J].Ecology and Evolution,2013,3(4):770-778.
Applications of microsatellite marker technology in the genetic structure research for closed colony of Brandt’s voles
ZHANG Man,SHI Hai-xia,SONG Ming-jing
(Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health,Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences&Comparative Medicine Centre,Peking Union Medical College,Beijing 100021,China)
Objective Analysis of the genetic structure stability of Brandt’s vole(lasiopodomys brandtii)in closed colony using microsatellite marker technology.Methods Genomic DNA was extracted from tail tip using highconcentration-salt precipitation methods.Marked with fluorescent tags(Fam),7 microsatellite primers were filtered out by PCR,and the DNA structure of three consecutive generations of Brandt’s vole was analyzed by microsatellite marker.Results By the analysis of the average heterozygosity and polymorphism information content,Brandt’s vole populations maintaineda closed group of qualified genetic structure.Conclusions The present results show that the closed group of Brandt’s vole species in our laboratory maintain a stable genetic structure.
Brandt’s vole;Closed colony;Genetic structure;Microsatellite DNA marker
R-332
A
1671-7856(2015)07-0034-05
10.3969.j.issn.1671.7856.2015.007.008
国家自然科学基金项目(31301890);北京市自然科学基金资助项目(7122110)。
张曼(1989-),女,硕士生,研究方向实验动物学。E-mail:zh_man89@foxmail.com。
宋铭晶,博士,副研究员。E-mail:songmj@cnilas.org
2015-05-28)

