一株铁还原菌FeRB-FL1404的分离和鉴定及其去除高岭土中Fe(Ⅲ)研究
林玉满,陈小岚, 魏招娣,许旭萍(.福建师范大学环境科学与工程学院,福建 福州 50007;.福建师范大学生命科学学院,福建 福州 50007;.福建师范大学化学与化工学院,福建 福州 50007)
一株铁还原菌FeRB-FL1404的分离和鉴定及其去除高岭土中Fe(Ⅲ)研究
林玉满1,陈小岚2, 魏招娣3,许旭萍2
(1.福建师范大学环境科学与工程学院,福建 福州 350007;2.福建师范大学生命科学学院,福建 福州 350007;3.福建师范大学化学与化工学院,福建 福州 350007)
【摘 要】以高岭土为选择性培养基,从锰矿样品中分离到一株能够还原高岭土中Fe(Ⅲ)的铁还原菌FeRBFL1404。经形态特征观察、生理生化特征和16S rDNA序列分析,鉴定其为短小芽孢杆菌(Bacillus pumilus)。考察了以葡萄糖、蔗糖、草酸钠、柠檬酸三钠为碳源对FeRB-FL14043菌还原高岭土中Fe2O3(Fe(3+))的影响,结果表明葡萄糖作为碳源,高岭土除铁效果最好;在葡萄糖浓度为1%、矿浆浓度为10%、铁还原菌液加量为5%、温度为28℃、pH值6.5条件下厌氧培养10d,高岭土中Fe(3+)去除率为46.07%,Fe2O3含量由0.89%降低至0.48%,自然白度由61.3%提高至68.7%,1 280℃烧成白度由84.9%提高至90.6%。
【关键词】铁还原菌;分离;高岭土;除铁;碳源
1 引言
高岭土是一种重要的粘土矿物,其本身具有优良的性能,被广泛应用于陶瓷、造纸等多个行业中,这些行业对高岭上的白度都有一定的要求[1-5]。影响高岭土白度的主要因素是铁、钛的矿物成分与含量[6],其中自由铁杂质主要以铁矿物形式存在,如褐铁矿、赤铁矿、磁铁矿、黄铁矿、菱铁矿和黄钾铁矾等。这些铁矿物会使高岭土呈现不同程度的灰色、绿色、褐色、粉红色等[7],然而铁杂质多数以Fe2O3的形式赋存于矿物颗粒中,由于Fe2O3对高岭土的白度影响大,因此是首当其冲应被清除的杂质成分[8]。
高岭土在工业利用之前一般都需要经过除铁增白处理,除铁方案和工艺路线,主要取决于高岭土中铁的赋存状态及产品的最终用途。高岭土除铁增白方法主要有物理法[9-11]、化学法[12-14]、煅烧法和微生物法[8,15-16]。物理方法除铁可使高岭土白度有一定的提高,如磁选法可去除高岭土中具有一定磁性染色物质[9];化学漂白是利用特定的化学试剂选择性溶解高岭土中的杂质,然后通过洗涤、过滤除去杂质的方法。根据高岭土原料中铁的赋存形式,目前已形成了
矿物微生物加工作为一种新兴技术正受到越来越广泛的关注。目前高岭土除铁微生物主要有氧化亚铁硫杆菌、黑曲霉菌、异养铁还原菌等。氧化亚铁硫杆菌可氧化高岭土体系中的黄铁矿[17],从而提高高岭土白度;黑曲霉菌产生的有机酸(主要是草酸)对高岭土中难溶氧化铁[18]有一定的溶解作用,达到了增白目的;铁还原菌能使高岭土中三价铁(Fe2O3)还原成易溶于水的二价铁离子而除去[8,16]。微生物法具有成本低、能耗少、环境污染程度轻等显著特点,但其工业化瓶颈在于反应速度较慢,处理周期较长。随着高岭土矿的不断开采,优质资源日益减少。因此,开展高岭土微生物除铁增白研究,可使原本开采价值不高的高铁低品位高岭土矿得以开采,实现矿产资源的可持续发展。
2 材料与方法
2.1 材料
2.1.1 分离样品
采自福建矿山(高岭土矿和锰矿)。
2.1.2 高岭土
由龙岩高岭土公司提供,Fe2O3含量为0.89%,含三价铁为0.623%。
2.1.3 培养基
(1) PTYG上层固体培养基。
1%PTYG的上层固体培养基:蛋白胨0.10g、酵母膏0.10g、蔗糖0.10g、MgSO4·7H2O 0.60g、无水CaCl20.25g、琼脂20g、蒸馏水1 000mL,调节培养基pH值为7.0。上层PTYG固体培养基,用于营造厌氧环境。
(2) PTYG下层选择性固体培养基。
柠檬酸铁下层培养基:柠檬酸铁铵0.10g、NH4C1 1.00g、无水CaCl20.25g、MgSO4·7H2O 3.00g、 K2HPO4·3H2O 3.60g、KH2PO46.25g、葡萄糖50g、琼脂20g、蒸馏水1 000mL,调节培养基pH值为7.0。
(3) LB培养基。
LB培养基:蛋白胨10g、牛肉膏5g、NaCl 5g、蒸馏水1 000mL,调节培养基pH值为7.0,121℃灭菌20min。固体培养基每升加20g的琼脂。
(4) 高岭土培养基。
高岭土培养基:高岭土100g、葡萄糖10g、酵母膏1g、蒸馏水1 000mL,pH值自然。
2.1.4 主要仪器
洁净工作台(SW-GF-1F型,上海博讯实业有限公司医疗设备厂);生化培养箱(SPX-2508-Z型,上海博迅实业有限公司医疗设备厂);光学显微镜(PM-10AD型,Olympus);恒温摇床(HQ45型,武汉科学仪器厂);灭菌消毒器(CRDX-280型,上海电安医疗器械厂);分光光度计(723型,上海精密科学仪器有限公司);台式离心机(TDL-40B-II型,上海安亭科学仪器厂);冷冻高速离心机(CS-15R型,Beckman);智能白度测定仪(WSB-VI型,杭州大吉光电仪器有限公公司)。
2.2.1 富集培养
称取样品10g于250mL三角瓶中,加入1g葡萄糖,100mL水,于30℃静置富集培养至高岭土由红色变为白色。取5mL培养液接种于LB培养基中,于30℃静置培养1d,作为接种液。将此接种液接入装有高岭土培养基瓶中,再通氮气去除瓶中氧气,加盖密封,30℃暗光厌氧培养至高岭土由红色变为白色,进行铁还原菌选择性培养,如此重复多次,淘汰非还原性细菌,最终获得纯度较高的铁还原菌混合菌液。
2.2.2 铁还原菌的分离纯化
采用稀释涂布法,即分别取不同稀释度上述铁还原菌混合菌液各1mL,涂布于柠檬酸铁固体培养基平板上,覆盖一层PTYG上层培养基,于30℃培养,3d后观察微生物生长情况和菌落形态。挑取不同形态的菌落接种至LB培养基斜面,分别测定其使高岭土除铁的能力,选择一株除铁能力较强的菌株用于菌种鉴定。
2.2.3 菌株鉴定
(1) 形态特征和生理生化特征。
综上所述,在经济全球化日益复杂的背景下,通过有效的内部控制管理能够提升企业抵御财务风险的能力,实现企业的长远发展。为此,针对当前基于财务风险防范的内部控制管理存在的问题,需要相关人员从思想意识提升、制度完善、环境营造等方面积极思考怎样优化企业内部控制管理,以期能够更好的促进现代企业发展。
参照《伯杰氏细菌鉴定手册》[19]和《常见细菌系统鉴定手册》[20]对分离纯化后的的铁还原菌进行形态特征和生理生化特征鉴定。
(2) 菌株的16S rDNA分子鉴定。
基因组DNA提取及PCR扩增操作按试剂盒使用说明书进行,试剂盒产品编号NEP021-1。
基因组DNA提取:采用离心柱型细菌基因组DNA提取试剂盒提取菌液基因组DNA。
16S rDNA的PCR扩增体系:DNA 2μL、2× MIX 25μL、MF 1μL/10μm、MR 1μL/10μm、ddH2O 50μL。
PCR反应为:94℃预变性5min;94℃ 30s,52℃30s,72℃ 100s,共30个循环;最后在72℃延伸10min。PCR反应产物用10g/L琼脂糖凝胶电泳检测。PCR扩增产物由北京鼎国昌盛生物技术有限责任公司进行DNA测序。
(3) 构建系统发育树。
将菌株FeRB-FL1404的16S rDNA基因序列测定结果输入GenBank进行序列相似性比对,获得的序列提交NCBI进行BLAST比对,并将所选择出的同源性较高的序列,采用DNAstar7.0软件中的Jotun Hein Method构建系统进化树。
2.2.4 FeRB-FL1404菌对高岭土中Fe2O3(Fe3+)的还原
铁还原菌液制备:铁还原菌接入LB培养基中,于28℃培养36h(对数生长期)得到铁还原菌液,调节菌液OD600为0.2,用于试验。
批试验为在250mL的锥形瓶中加入高岭土10g,选用4种不同碳源(葡萄糖、蔗糖、草酸钠和柠檬酸三钠),加量均为1g,pH值调至6.5、蒸馏水100mL,灭菌后,加入5mL铁还原菌液,28℃厌氧培养10d,离心后测定溶液中Fe2+的含量,计算高岭土Fe3+去除率。试验平行3次,取平均值。
2.2.5 Fe2+浓度的测定
采用邻菲啰啉分光光度法[21]测定溶液中Fe2+浓度。从100mL培养液中取3mL,3 500r/min离心5min,取0.2mL上清液至25mL的比色管中,再加入盐酸羟胺1mL、NaAc-HAc缓冲溶液5mL、邻菲啰啉3.0mL,加水至刻线,显色10min,在510nm处测吸光度,根据工作曲线,计算出高岭土中铁的还原量和去除率。
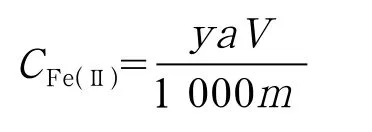
式中:CFe(Ⅱ)——高岭土中铁的去除量,mg/g;
a——稀释倍数;
y——0.2mL中Fe2+浓度,μg/mL;
V——培养液总体积,mL;
m——高岭土量,g。
高岭土原矿含Fe2O30.89%,经换算,相当于高岭土含Fe3+(Fe2O3):
CFe(Ⅲ)=6.23mg Fe/g高岭土;
通过测定溶液中Fe2+的含量,计算出CFe(Ⅱ),则:
高岭土Fe3+(Fe2O3)去除率=CFe(Ⅱ)/CFe(Ⅲ)×100%
3 结果与讨论
3.1 铁还原菌的分离
采用高岭土为富集培养基,PTYG-柠檬酸铁双层培养基为选择性分离培养基,从锰矿样品中分离出1株异化铁还原菌FeRB-FL1404菌株。
3.2 铁还原菌的鉴定
3.2.1 培养特性
铁还原菌FeRB-FL1404在LB培养基上28℃培养24h后,形成菌落为白色至淡黄色,椭圆形,菌落光滑,边缘整齐。
3.2.2 染色特性
经革兰氏染色,显微镜(×1000)观察,结果见图1。由图1可以看到,该菌株菌体呈杆状,大小约(0.6~0.7)μm×(2.0~3.0)μm,菌体呈紫色,为革兰氏阳性细菌。
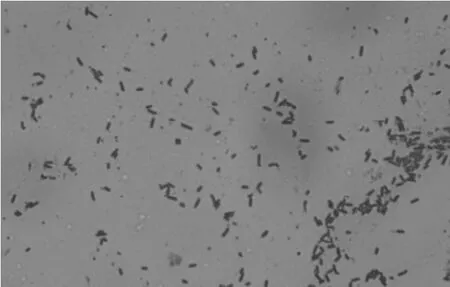
图1 铁还原菌FeRB-FL1404的菌体形态
3.2.3 生理生化特征
该菌具有过氧化氢酶活性,能还原石蕊牛奶,分泌蛋白酶分解明胶,分解葡萄糖产酸而不产气,无精氨酸双水解酶,V.P.试验阳性,硫化氢试验阳性,硝酸盐还原阴性,淀粉水解阴性,M.R试验阴性。
3.2.4 菌株16S rDNA序列比对及系统发育树构建
以菌株FeRB-FL1404基因组DNA为模板,经PCR扩增后在10%的琼脂糖凝胶上电泳,结果如图2所示(图中I表示:16S rDNA PCR产物;M表示:DAN Marker),在约1 500bp处有一明亮的条带。
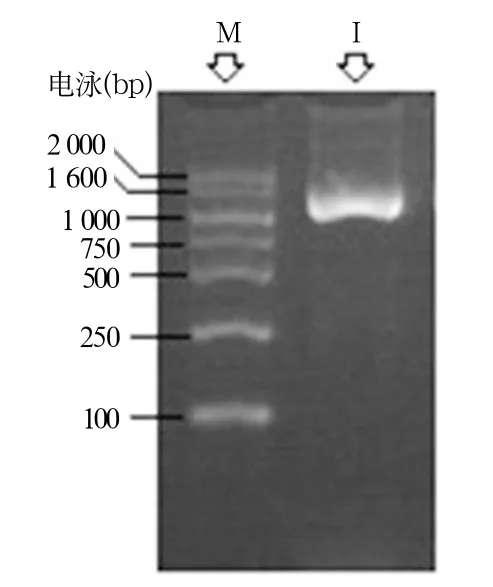
图2 铁还原菌FeRB-FL1404基因组的PCR扩增产物电泳
将该序列提交到GenBank上进行BLAST比对分析,该菌与短小芽孢杆菌具有较高的同源性,在进化关系上,菌株FeRB-FL1404与Bacillus属的Bacillus pumilus同源性高达99%。构建的系统进化树如图3所示。

图3 菌株FeRB-FL1404基于16S rDNA序列系统发育树
综合形态特征、生理生化特征和16S rDNA序列分析结果,可确定铁还原菌FeRB-FL1404为短小芽孢杆菌(Bacillus pumilus)。
3.3 铁还原菌对高岭土中Fe2O3(Fe3+)的还原
为了使在较短的时间内获得较多的活性较高的菌体,对FeRB-FL1404铁还原菌的最适生长温度和生长曲线进行测定,使培养得到的菌体能更加有效地还原高岭土中Fe2O3(Fe3+)。
3.3.1 温度对菌体生长的影响
FeRB-FL1404菌用LB培养基分别在22、24、26、28、30、32℃于120rpm恒温振荡培养48h,在600nm波长处,测定培养液OD600值,结果如图4。从图4可看出,该菌最适生长温度为28℃,因此,后续试验温度取28℃。
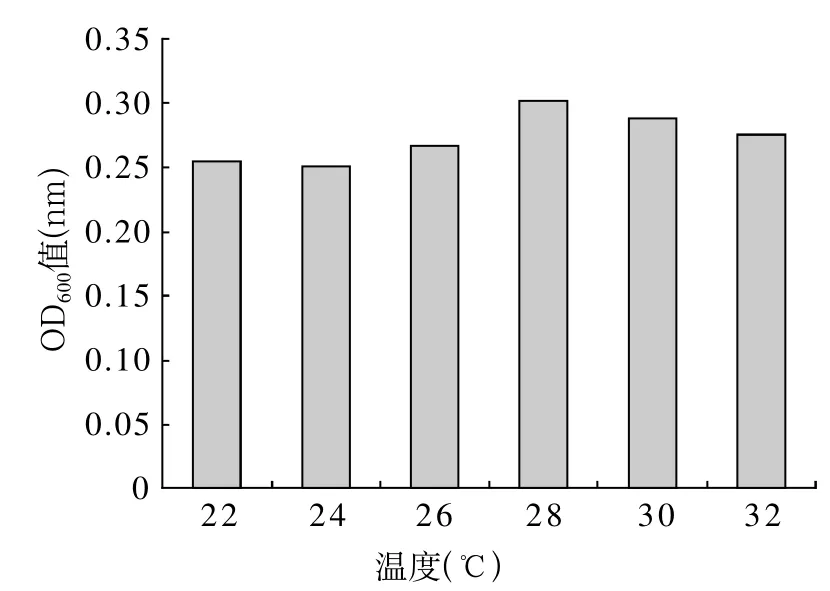
图4 温度对菌体生长量的影响
3.3.2 铁还原菌生长曲线
在一批含5mL LB培养基的试管中各接入0.5mL铁还原菌种子液,于28℃、120rpm恒温振荡培养,每隔3h取三根试管,测定培养液OD600值,取3次平均值,绘制生长曲线见图5。
从图5可知铁还原菌14~04接种后0~30h为延滞期,30~48h为对数生长期,48h以后为稳定期。由于在对数生长期,菌体活力最佳,因此在后续试验中选择培养36h铁还原菌作为接种液。
3.3.3 碳源对高岭土中Fe2O3(Fe3+)还原的影响
铁还原菌在厌氧条件下生长,并以葡萄糖等有机物为电子供体,以高岭土中Fe3+(Fe2O3)为电子受体进行异化铁还原作用,可将高岭土Fe3+还原为可溶性的Fe2+从矿物中浸出,所以可用培养液中Fe2+增加量来表示高岭土中Fe3+的去除量,从而计算出其去除率。
试验矿浆浓度为10%,OD600值为0.2的铁还原菌液加量为5%,碳源加量为1%,pH值为6.5,在此条件下厌氧培养10d,考察不同碳源对高岭土中Fe2O3(Fe3+)还原的影响,结果如图6所示。
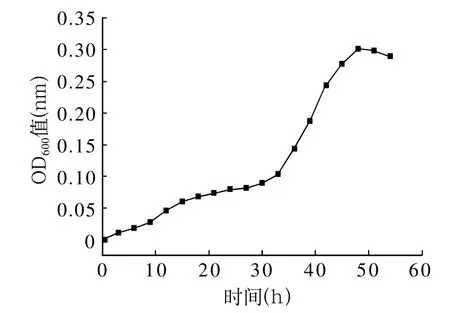
图5 铁还原菌生长曲线
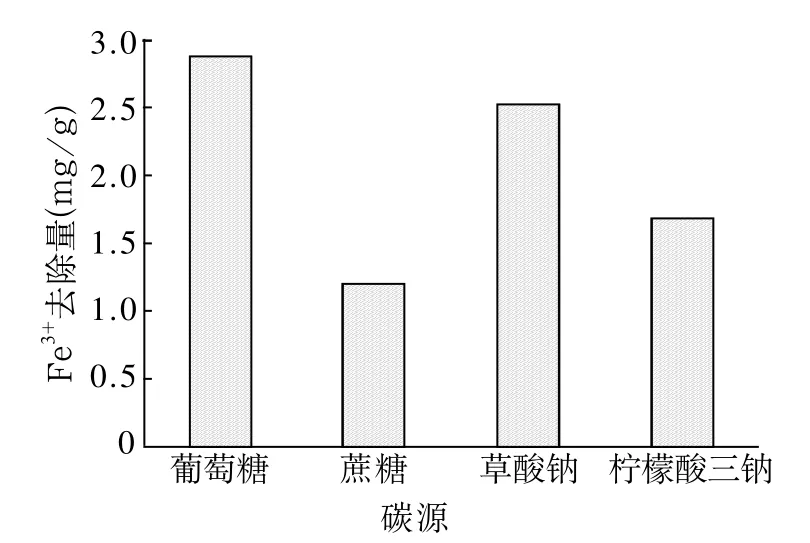
图6 不同碳源对微生物还原Fe(Ⅲ)的影响
图6表明以葡萄糖、蔗糖、草酸钠和柠檬酸三钠为碳源,铁还原菌FeRB-FL1404均能还原高岭土中Fe3+,高岭土中Fe3+的去除量依次为2.87、1.19、2.52、1.68mg/g,去除率依次为46.07%、19.10%、40.45%和26.97%,高岭土中Fe2O3含量从原土的0.89%依次降低到0.48%、0.72%、0.53%和0.65%。其中以葡萄糖为碳源除铁效果最好,除铁后高岭土中的Fe2O3含量降到0.48%,相应提高了高岭土白度,经白度检测仪测定,高岭土自然白度由61.3%提高至68.7%,1 280℃烧成白度由84.9%提高至90.6%,白度提高显著。
4 结论
(1) 采用富集培养方法,以高岭土为富集培养基,从锰矿样品中分离到一株能够还原高岭土中Fe(Ⅲ)的铁还原菌FeRB-FL1404。其菌落特征为:白色至淡黄色,圆形,边缘整齐。染色结果表明,该菌株为革兰氏阳性细菌,杆状,大小约(0.6~0.7)μm× (2.0~3.0)μm。
(2) 采用PCR技术获得了1 500bp的铁还原菌株FeRB-FL1404的部分16S rDNA序列。经同源性分析和与相关菌株16S rDNA的系统进化关系比较发现,菌株FeRB-FL1404与Bacillus属的Bacillus pumilus同源性高达99%,结合形态特征和生理生化特征,该菌株可确定为短小芽孢杆菌(Bacillus pumilus)。
(3) FeRB-FL14043菌分别以葡萄糖、蔗糖、草酸钠、柠檬酸三钠为碳源,其均能使高岭土中Fe3+还原,但葡萄糖除铁效果最好;以葡萄糖为碳源,高岭土中Fe3+去除率为46.07%,Fe2O3含量由0.89%降低至0.48%,自然白度由61.3%提高至68.7%,1 280℃烧成白度由84.9%提高至90.6%。
【参考文献】
[1]SARMA J, GANGULY M. Catalytic activity of natural kaolinite clay of karbi-anglong district of assam[J]. Chem. Chem. Eng. 2011(5):1116-1121.
[2]MURRAY H H. Traditional and new applications for kaolin, smectite, palygorskite: a general overview[J]. Appl. Clay Sci., 2000,17: 207-221.
[3]LIEW Y M, KAMARUDIN H, MUSTAFA A M et al. Investigating the possibility of utilization of kaolin and the potential of metakaolin to produce green cement for construction purposesa review aust[J]. Basic & Appl. Sci., 2011, 5(9): 441-449.
[4]SAIKIA N, BHARALI D, SENGUPTA P, et al. Characterization, beneficiation and utilization of a kaolinite clay from Assam, India[J]. Appl. Clay Sci., 2012,24:93-103.
[5]陈文瑞.我国陶瓷超级高岭土的开发与应用[J].中国陶瓷,2008, 44(11):59-62.
[6]BEROLINO L C, ROSSI A M, SCORZELLI R B, et a1.Influence of iron on kaolin whiteness: An electron paramagnetic resonance study[J]. Appl. Clay Sci., 2010, 49(3): 170-175.
[7]于瑞敏.过渡金属氧化物及化学漂白工艺对高岭土白度影响规律的研宄[D].厦门:厦门大学,2008.
[8]LEE E Y, CHO K S, RYU H W. Microbial refinement of kaolin by iron-reducing bacteria[J]. Appl. Clay Sci., 2002(22): 47-53.
[9]CHEN L Z, LIAO G, QIAN Z H, et al. Vibrating high gradient magnetic separation for purification of iron impurities under dry condition[J]. Int. J. Mine. Proc., 2012, 102(25): 136-140.
[10]XIA L Y, ZHONG H, LIU G Y, et al. Comparative studies on flotation of illite, pyrophyllite and kaolinite with Gemini and conventional cationic surfactants[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(2): 446-453.
[11]XIA G H, LU M, SU X L, et al. Iron removal from kaolin using thiourea assisted by ultrasonic wave[J]. Ultrasonics Sonochemistry, 2012, 19(1): 38-42.
[12]TUNCUK A, CIFTLIK S, AKCIL A. Factorial experiments for iron removal from kaolin by using single and two-step leaching with sulfuric acid[J]. Hydrometallurgy, 2013, 134: 80-86.
[13]GONZáLEZ J A, RUIZ M D C. Bleaching of kaolins and clays by chlorination of iron and titanium[J]. Appl. Clay Sci., 2006, 33: 219-229.
[14]MUSIAL I, CIBIS E, RYMOWICZ W. Designing a process of kaolin bleaching in an oxalic acid enriched medium by Aspergillus niger cultivated on biodiesel-derived waste composed of glycerol and fatty acids[J]. Appl. Clay Sci., 2011, 52(3): 277-284.
[15]GUO M R, LIN Y M, XU X P, et al. Bioleaching of iron from kaolin using iron-reducing bacteria with various carbon nitrogen sources[J]. Appl. Clay Sci., 2010, 48: 379-383.
[16]何秋香,郭敏容,陈文瑞,等.影响高岭土中Fe(Ⅲ)生物还原的因素[J].矿物学报,2011,31(2):296-301.
[17]雷绍民,龚文琪,袁楚雄.微生物浸出煤系高岭土中黄铁矿的初步研究[J].武汉工业大学学报,2000,22(2):8-10.
[18]HOSSEINI M R, PAZOUKI M, RANJBAR M, et al. Bioleaching of iron from highly contaminated Kaolin clay by Aspergillus niger[J]. Appl. Clay Sci., 2007(37): 251-257.
[19]布坎南 R E, 吉本撕 N E.伯杰细菌鉴定手册[M].北京:科学出版社,1994.
[20]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[21]国家环境保护总局编委会.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社,2002:368-370.
【试验研究】
Study on the Isolation and Identification of A Iron-reducing Bacterium FeRB-FL1404 and the Fe(Ⅲ) Removal of Its From Kaolin
LIN Yu-man1, CHEN Xiao-lan2, WEI Zhao-di3, XU Xu-ping2
(1.College of Environmental Science and Engineering, Fujian Normal University, Fuzhou 350007, China; 2.College of Life Sciences, Fujian Normal University, Fuzhou 350007, China; 3.College of Chemistry and Chemical Engineering, Fujian Normal University, Fuzhou 350007,China)
Abstract:In this paper, kaolin was chosen as the selective media. A iron-reducing bacterium FeRB-FL1404 was isolated from manganese ore and was identified as Bacillus pumilus according to its morphology feature, physiological and biochemical characteristics and 16S rDNA analysis. In addition, carbon souses, including glucose sucrose sodium oxalate trisodium citrate,impacting on the iron removal from kaolin using ion reducing bacteria were investigated with batch experiments. The results showed that glucose emerged as the most effective carbon source. Under the conditions with glucose as carbon source, glucose concentration of 1%, pulp concentration of 10%, bacterial inoculum for 5%, temperature of 28℃, pH6.5, anaerobic culture for 10 days, the removal percentage of Fe(3+)from kaolin was achieved 46.07%, Fe2O3content in kaolin was reduced from 0.89% to 0.48%, the natural whiteness was enhanced from 61.3% to 68.7%, and whiteness was enhanced from 84.9% to 90.6% after fired at 1 280℃.
Key words:iron-reducing bacteria; isolation; kaolin; removal of iron; carbon source
【收稿日期】2014-08-27
【基金项目】福建省自然科学基金项目(2012J01198);福建省高校产学合作科技重大项目(2014H6008)。book=12,ebook=15氧化漂白法、酸浸漂白法、还原漂白法、氧化—还原联合法等,其中以还原漂白法应用最为普遍。高岭土中铁杂质多为难溶于水的三价铁,一般采用在还原剂的作用下还原漂白法去除;高温煅烧是除碳增白的最佳方法,但对于铁含量较高的高岭土矿,煅烧后的白度难以突破85%。
【文章编号】1007-9386(2015)01-0011-05
【文献标识码】A
【中图分类号】TD925.5;TD973.2

