巴西橡胶树HbMAPK1基因的克隆及表达分析
吴绍华等

摘 要 植物促分裂素原活化蛋白激酶(Mitogen-activated Protein Kinase,MAPK)信号转导途径在植物应对低温、盐害、虫害等逆境胁迫中起着重要的作用。采用RACE和RT-PCR技术从橡胶树热研7-33-97的胶乳cDNA中扩增到一条全长cDNA,共1 909 bp,包含1 119 bp开放阅读框,编码372个氨基酸,含有特征性的STKc_TEY_MAPK和S_TKc结构域,命名为HbMAPK1(GenBank:KP262500),其编码蛋白分子量为42.57 ku,理论等电点为7.21。荧光定量PCR结果显示,HbMAPK1在橡胶树的根、树皮、胶乳及叶片中均有表达,其中稳定期叶片的基因表达量最高。4 ℃低温处理条件下,HbMAPK1在93-114与热垦501无性系叶片间的基因表达模式存在明显差异,表现为93-114叶片中HbMAPK1的表达受4 ℃低温的诱导显著上调,热垦501叶片中的表达下调。结合2个品系在生产上的抗寒表现,即93-114属于抗寒性品系,抵御低温能力较强,而热垦501属于不抗寒性品系,对低温较敏感。因此,推测HbMAPK1可能与橡胶树的抵御温胁迫有关。
关键词 巴西橡胶树;HbMAPK1;基因克隆;表达分析
中图分类号 S749.1 文献标识码 A
Molecular Cloning and Expressional Analysis of HbMAPK1 from Rubber Tree(Hevea brasiliensis Müll. Arg.)
WU Shaohua1, WANG Jianxiao1,2, CHEN Yueyi1, LI Mengfang2, TIAN Weimin1*
1 Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Minstry of Agriculture Key Laboratory of Rubber
Biology/State Key Laboratory Incubation Base for Cultivation & Physiology of Tropical Crops, Danzhou, Hainan 571737, China
2 College of Agriculture, Hainan University, Haikou, Hainan 570228, China
Abstract Mitogen-activated Protein Kinase(MAPK) signaling pathways play important role in response to the stress such as low temperature, salt and pest. In this study, the full length cDNA of HbMAPK1(GenBank:KP262500)was obtained from cDNA library in the latex of rubber tree clone Reyan7-33-97. It was 1 909 base pairs(bp) in length, containing a 1 119 bp open reading frame(ORF), encoding 372 amino acid residues with a predicted molecular mass of 42.57 ku and a pI of 7.21. The deduced amino acid sequence contained two specific domains of STKc_TEY_MAPK and S_TKc domain. Real-time PCR analysis showed that HbMAPK1 expressed in root, bark, latex and leaves. The transcript level of mature leaf was the highest. The expression patterns of HbMAPK1 was different in 4 ℃-treated leaf of rubber tree clone 93-114 and Reken 501. The HbMAPK1 transcript levels were upregulated in leaf by 4 ℃ treatment for 2 hours in rubber tree clone 93-114, but the result was the opposite in rubber tree clone Reken501. Based on the differential cold resistance of the two rubber tree clones in pructice,i. e., the cold resistance of 93-114 was stronger than Reken 501, HbMAPK1 is supposed to haer a role in enhancing cold resistance of rubber tree.
Key words Hevea brasiliensis Müll. Arg.; HbMAPK1;Gene clone;Expression analysis
doi 10.3969/j.issn.1000-2561.2015.09.006
促分裂原活化蛋白激酶(Mitogen-activated Protein Kinase,MAPK)是一类传递胞外和胞内信号到细胞响应的丝氨酸/苏氨酸蛋白激酶,是真核生物信号传递网络中的重要途径之一,在真核生物中普遍存在。MAPK级联途径作为多种生长信号跨膜传递的交汇点或共同通路,可将外源信号转入胞内并引发细胞应答,调控细胞的基因表达,在植物的生长发育和抗逆响应中发挥着极为重要的作用[1-5]。
MAPK级联途径由促分裂原活化蛋白激酶(MAPK)、促分裂原活化蛋白激酶的激酶(MAPKK)、促分裂原活化蛋白激酶的激酶之激酶(MAPKKK)3个组分组成[6],由MAPKKK-MAPKK-MAPK依次磷酸化传递信号[7-8]。MAPK级联途径各激酶基因家族在不同植物物种中是保守的。植物MAPKKK磷酸化MAPKK的S/T-X5-S/T(X代表任意氨基酸)序列,MAPKK磷酸化MAPK的保守氨基酸基序TDY或TEY中的苏氨酸(T)和酪氨酸(Y),使其激活。T(D/E)Y位于VII和VIII亚区之间的活化环。活化的MAPK除了可激活转录因子,也可通过蛋白质之间的相互作用引起细胞响应[6]。MAPK级联系统通过参与蛋白质磷酸化作用传递和放大信号,调控下游基因的表达,最终引起植物的一系列生理反应[9]。
橡胶树原产于高温、高湿、静风的巴西亚马逊河流域,是典型的热带雨林树种,抵御低温的能力不强,当气温降至10 ℃以下时,橡胶树的光合作用就停止了,气温降至5 ℃以下时就开始受害。中国的植胶区位于北纬18~24°热带北缘和南亚热带(主要是海南、云南和广东),寒潮是危害中国橡胶树最为严重的自然灾害之一。因此,选育抗寒高产的橡胶树无性系是中国橡胶树育种的重要目标。目前,抗寒性种质的鉴定主要采用抗寒前哨梯度苗圃系比鉴定法,即在一般年份有寒流侵袭的地区或寒流通道上建立前哨梯度苗圃系比区。通过抗寒苗圃鉴定,也选育出一批抗辐射或抗平流低温能力强或较强的无性系[10]。但抗寒前哨梯度苗圃系比鉴定法也存在一定的缺陷,如受寒流类型及方向的不确定性,种植区域的小环境气候差异等会造成鉴定的效率低、周期长。而且,一旦遇到暖冬,将难以比较无性系间耐寒性的差异,给橡胶树抗寒选育种工作造成时间和物力的浪费。因此,在抗寒相关基因的研究基础上,开发抗寒性分子标记辅助抗寒前哨苗圃鉴定,将大幅度提高鉴定的效率,推进抗寒性品种的选育进程。本研究从橡胶树胶乳中分离鉴定了一个低温响应的新的MAPK基因——HbMAPK1,旨在为进一步探讨橡胶树抗逆机理及开发抗逆性分子标记辅助橡胶树抗逆育种奠定基础。
1 材料与方法
1.1 材料
实验材料巴西橡胶树(Hevea brasiliensis Müll. Arg.)无性系热研7-33-97,种植于中国热带农业科学院实验场。巴西橡胶树无性系93-114、热垦501为当年芽接苗。RNAprep Pure多糖多酚植物总RNA提取试剂盒,DNaseⅠ购自天根公司。RACE试剂盒SMARTerTM RACE cDNA Amplification Kit购自clontech公司。反转录试剂盒RevertAidTM First Strand cDNA Synthesis Kit购自Ferments公司。DNA凝胶回收试剂盒购自OMEGA公司。PyrobestTM DNA Polymerase、实时荧光定量PCR试剂SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)购自大连宝生物公司。pEASY-Blunt Simple Cloning Kit购自北京全式金公司。其它生化试剂均为进口或国产分析纯试剂。引物合成和DNA测序由Invitrogen公司完成。
1.2 方法
1.2.1 材料处理 无性系热研7-33-97的根、皮、胶乳、叶片的RNA用于HbMAPK1的组织特异性相对表达分析;橡胶树无性系93-114和热垦501用于4 ℃低温胁迫处理2、4、8、12、24、48 h,不处理作为对照样品,每个处理设3个重复,取每个时间点叶片混合提取RNA,分析低温胁迫处理对HbMAPK1基因表达的影响。
1.2.2 总RNA的提取与cDNA的合成 橡胶树不同组织总RNA的提取参照RNAprep Pure多糖多酚植物总RNA提取试剂盒的操作说明进行。用DnaseⅠ柱上消化RNA样品中残留的微量DNA,cDNA第一链的合成根据Ferments公司试剂盒的操作步骤进行。
1.2.3 HbMAPK1的RACE和全长cDNA扩增 搜索本实验室的转录组数据库,获得1个注释为MAPK的Unigene,采用RACE技术进行3′和5′端序列的扩增。RACE 扩增参照clontech公司的试剂盒 SMARTerTM RACE cDNA Amplification Kit 进行,其中第1轮和第2轮扩增所用的基因特异性引物见表1。以获得的RACE序列与已知的Unigene基因序列拼接的序列设计全长cDNA扩增引物(表 1),利用RT-PCR技术进行基因全长cDNA扩增。cDNA模板制备:1 μg胶乳RNA,20 μL反应体系,逆转录合成cDNA第一链,稀释5倍后用作PCR扩增。全长cDNA扩增体系:Pyrobest DNA Polymerase(5 units/μL)0.25 μL,10×Pyrobest Buffer II 5 μL,dNTP Mixture(2.5 mmol/L each)4 μL,FL-CDNA-MAPK1-F(10 μmol/L)2.5 μL,FL-CDNA-MAPK1-R(10 μmol/L)2.5 μL,cDNA模版1 μL,灭菌水补足 50 μL。扩增程序为:95 ℃预变性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,共30个循环;72 ℃延伸10 min。0.8%的琼脂糖凝胶电泳分离PCR扩增产物,回收纯化目的条带,克隆到pEASY-Blunt Simple Cloning Vector载体上,送Invitrogen公司进行测序。利用BLAST检索GenBank数据库进行同源性分析。
1.2.4 生物信息学分析 利用DNAMAN软件对HbMAPK1全长cDNA序列进行比对分析,利用NCBI网站ORF Finder软件进行开放阅读框(ORF)预测,同时翻译成蛋白序列。从NCBI 数据库下载不同植物的MAPK蛋白序列,首先用Clustal W进行序列多重比对,再利用MEGA 4.0 软件,选择neighbour -joining(NJ)模型,并进行1 000次bootstrap统计学检验,构建包括HbMAPK1蛋白序列在内的植物MAPK蛋白的系统进化树。采用ProtParam软件分析该蛋白的分子量与等电点;SOPMA SECONDARY STRUCTURE PREDICTION
METHOD在线软件预测蛋白的二级结构;TargetP 1.1 Server在线软件进行导肽的预测;PSORT在线软件对该蛋白进行亚细胞定位预测;ProtScale在线软件预测该氨基酸序列的疏水性/亲水性;NetPhos 2.0 Server在线软件分析该蛋白的磷酸化位点。
1.2.5 荧光实时定量PCR分析 采用Bio-Rad公司的CFX实时荧光定量PCR系统,实验操作按仪器使用说明书进行。取1 μg胶乳RNA,逆转录合成cDNA第一链,稀释10倍后作为实时定量PCR分析模板。20 μL反应体系中,包含2 μL模板,10 μL 2×SYBR Premix和10 μmol/L的每条引物0.6 μL(引物终浓度为0.3 μmol/L)。PCR反应程序为:95 ℃变性30 s;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,共40个循环。40个循环后进行溶解曲线分析。利用CFX manager 3.0软件自动进行基线和Cq值分析,以HbActin作为内参基因,算法为2-△△Cq法。
1.3 数据处理
采用T-test方法对处理与对照的基因表达水平进行差异显著性分析(p<0.05为达到显著性差异)。
2 结果与分析
2.1 HbMAPK1全长cDNA的克隆
通过RACE方法及测序从巴西橡胶树胶乳中分离得到499 bp的5′端序列和334 bp的3′端序列。经拼接和RT-PCR扩增测序获得HbMAPK1全长cDNA 1 909 bp,其中包括1 119 bp的开放阅读框,5′非翻译区长481 bp,3′非翻译区长309 bp,该基因编码372个氨基酸(图1)。
2.2 HbMAPK1生物信息学分析
按照1.2.4所描述的方法对HbMAPK1进行生物信息学分析。结果显示:HbMAPK1编码一个由372个氨基酸残基组成的蛋白,分子式为C1913H3004N520O540S20,带负电荷的氨基酸残基数(Asp+Glu)为42,带正电荷的氨基酸残基数(Arg+Lys)为42。该蛋白分子量为42.57 ku,理论等电点为7.21,不稳定系数为37.20,属于稳定类蛋白。该氨基酸序列的二级结构由42.47%的α-螺旋、17.20%的延伸链、6.45%的β-转角和33.87%的无规则卷曲组成。α-螺旋和无规则卷曲是其主要的结构元件,而β-转角和延伸链则散布于整个蛋白质中。该蛋白可能不存在导肽酶切位点,不具有导肽,预测可信度为2级。该蛋白定位于细胞质的可能性为45%,定位于微体(过氧化物酶体)的可能性为30%,定位于叶绿体基质及叶绿体类囊体膜的可能性均为20%。结合跨膜区分析,结果显示该蛋白不具有跨膜区。因此,推测该蛋白可能是细胞质蛋白。
疏水性/亲水性分析结果显示,多肽链第53位的Glu具有最低的分值(-2.189),亲水性最强;第224位的Phe具有最高的分值(2.167),疏水性最强。但从整体来看,亲水性氨基酸均匀分布在整个肽链中,且存在一个明显的亲水区域。因此,该蛋白整条多肽链表现为亲水性。
另外,MAPK作为MAPK级联途径MAPKKK →MAPKK→MAPK中的末位信号转导,磷酸化位点预测和分析对于了解该蛋白在细胞信号传递过程中具有重要的作用。结果显示,该蛋白共有18个磷酸化位点,其中包括5个丝氨酸位点、8个苏氨酸位点、5个酪氨酸位点。
2.3 氨基酸序列比对及进化树构建
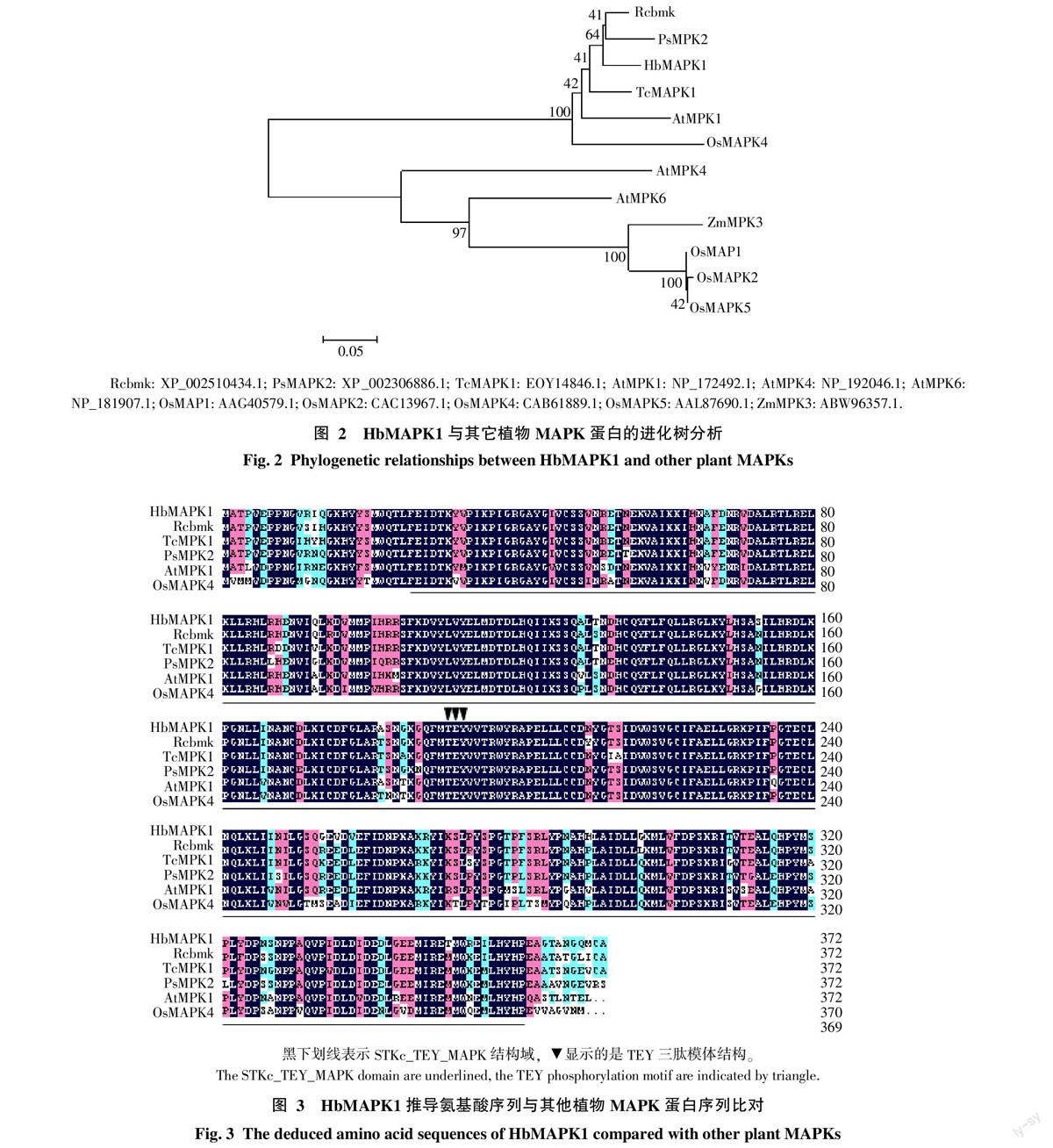
根据HbMAPK1序列推导的氨基酸序列与其他植物同源基因的氨基酸序列构建系统进化树,聚类结果显示,橡胶树HbMAPK1与蓖麻(Ricinus communis)(XP_002510434.1)的亲缘关系最近(图2)。
HbMAPK1推导的氨基酸序列与其他植物的MAPK基因所编码的氨基酸序列进行比对,结果显示,该蛋白序列与蓖麻Rcbmk(XP_002510434.1)、可可(Theobroma cacao)TcMAPK1(EOY14846.1)、毛果杨(Populus trichocarpa)PsMAPK2(XP_002306886.1)、
拟南芥(Arabidopsis thaliana)AtMPK1(NP_172492.1)及水稻(Oryza sativa)OsMAPK4(CAB61889.1)蛋白相似性分别为93.82%、91.13%、90.86%、86.02%和83.06%(图3),均具有STKc-TEY-MAPK结构域和TEY三肽模体机构。
2.4 HbMAPK1基因表达与分析
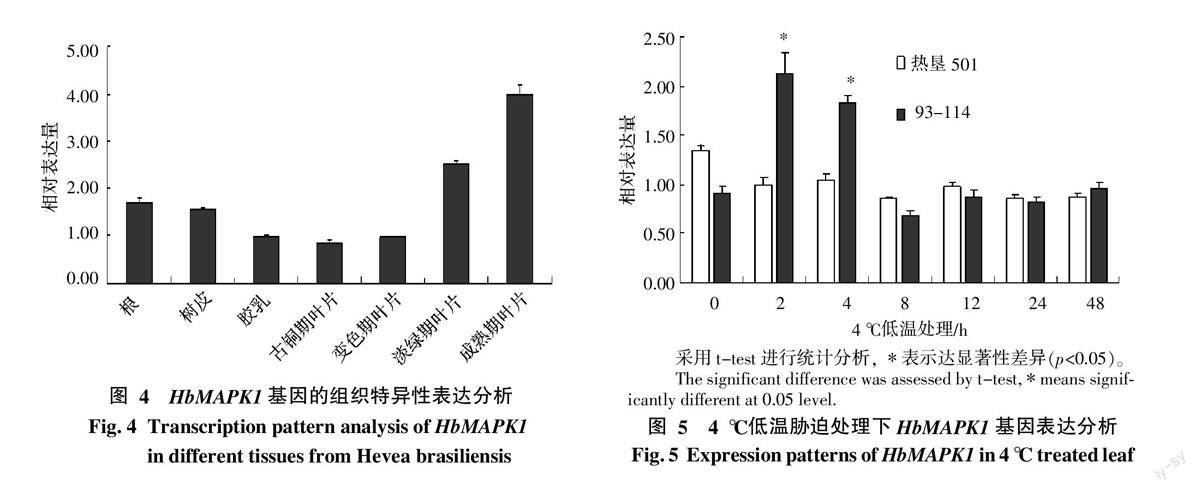
HbMAPK1基因的组织特异性相对表达分析结果显示,HbMAPK1在橡胶树的根、树皮、胶乳及叶片中均有表达,其中胶乳中的表达量最低,成熟期叶片中表达最高,不同时期叶片HbMAPK1的表达量也有所不同,从古铜期至成熟期表达量逐渐升高(图4)。4 ℃ 低温处理条件下,HbMAPK1在93-114与热垦501无性系间的基因表达模式存在明显差异。常温条件下,热垦501叶片中HbMAPK1本底表达量比93-114中的表达量高。但是,4 ℃低温处理2 h,橡胶树抗寒品系93-114的树叶中HbMAPK1的表达显著上调,达到2倍以上,并能持续至4、8 h后基因表达开始回落至本底水平,并稳定至48 h。而热垦501在4 ℃低温处理2 h后,HbMAPK1的基因表达开始下调,8 h达到最低,而且在2~48 h范围内的表达均处于下调状态(图5)。由此可见,橡胶树无性系93-114叶片中HbMAPK1的表达受到4 ℃低温的诱导显著上调,无性系热垦501叶片中的表达下调。根据2个品系在生产上的抗寒表现,即无性系93-114属于抗寒性品系,抵御低温能力较强,而热垦501属于不抗寒性品系,对低温较敏感,因此推测HbMAPK1可能在橡胶树抵御低温胁迫中起到一定的作用。
3 讨论与结论
橡胶树HbCBF1[11]、HbCBF2[12]、HbMT2a[13]、HbSoloit[14]等基因受低温诱导表达。安泽伟等[15]采用cDNA-AFLP技术对11个橡胶树抗寒无性系和12个不抗寒无性系低温处理前后基因表达谱进行差异分析,从中筛选12条在2组材料中表现一致的差异片段,其中TDF7-8、TDF5-15、TDF16-10片段分别与植物抗逆相关的ABC转运蛋白、3-脱氧-D-阿拉伯庚酮糖-7-磷酸合成酶(DAHPS)、WRKY基因具有较高的相似性。Silva等[16]在橡胶树低温诱导的文库中发现ATP合酶CF0 C亚基(CF0)、NAD(P)H醌氧化还原酶 H亚基(NADH)、光系统II10 ku多肽(PsbR)及吲哚-3-乙酸诱导蛋白ARG2-1和ARG2-2的表达受低温诱导,并通过qRT-PCR的验证。植物中MAPK广泛参与多种生物与非生物胁迫,如病害、低温、干旱、盐害和紫外线等引起的信号传导过程[17-18]。研究结果表明,烟草(NtNPK1)、拟南芥(AtMAP3、AtMPK4、AtMPK6)、水稻[OsMAP1、OsMAPK2、OsMAPK4、OsMAPK5、OsMAPK8(OsWJUMK1)]、玉米(ZmMPK3)等MAPK级联组分与低温胁迫相关[19-20]。
目前,橡胶树低温胁迫相关MAPK基因的鉴定及机理的研究还未见报道。本研究鉴定了橡胶树MAPK级联途径组分基因HbMAPK1。其他植物MAPK1的研究结果表明,拟南芥AtMAPK1激酶可被机械损伤、ABA、JA、H2O2等胁迫信号所激活[21]。玉米根系中克隆的ZmOSMAPK1的转基因拟南芥对干旱和盐胁迫、转基因烟草对低温均具有较高的耐性[22]。由于植物对寒害、干旱和盐胁迫有通用的路径,本研究重点关注橡胶树抗寒性,因此,采用荧光定量PCR探讨了HbMAPK1在低温处理下橡胶树叶片中HbMAPK1的基因表达情况。结果表明,抗寒无性系93-114中HbMAPK1的转录水平对4 ℃低温处理响应较快,在2 h即达到最高,这与水稻OsMAP1和拟南芥中AtMPK4、AtMPK6对低温的响应相似[23-26]。水稻7 d幼苗的根组织中OsMAP1的表达在12 ℃低温处理2 h达到最高,嫩枝中OsMAP1的表达在处理6 h达到最高[23]。拟南芥中AtMPK4和AtMPK6的响应更快,其中AtMPK4激酶活性在低温处理1 h后达到最高,AtMPK6在处理10 min内活性达到最高[24-26],更进一步说明拟南芥可能是以MEKK1-MKK2-MPK4/MPK6途径在响应低温胁迫的过程中起作用的[25, 27]。此外,本研究还探讨了HbMAPK1在低温较敏感的无性系热垦501的表达情况,结果发现HbMAPK1在低温敏感无性系热垦501叶片中的表达模式与抗寒无性系93-114存在明显不同,表现为受低温诱导表达下调。
因此,参照拟南芥、水稻及玉米MAPK途径能够对低温逆境作出响应,并根据橡胶树HbMAPK1在低温下的表达模式,推测MAPK途径可能参与橡胶树的低温响应。在后续的研究中,将着重分析不同逆境条件下HbMAPK1激酶的活性变化,鉴定与HbMAPK1互作的蛋白,为建立橡胶树逆境响应的MAPK信号途径及开发抗寒性分子标记辅助橡胶树无性系的鉴定奠定基础。
参考文献
[1] Colcombet J, and Hirt H. Arabidopsis MAPKs: a complex signalling network involved in multiple biological processes[J]. Biochem J, 2008, 413(2): 217-226.
[2] Fiil B K, Petersen K, Petersen M, et al. Gene regulation by MAP kinase cascades[J]. Curr Opin Plant Biol, 2009, 12(5):615-621.
[3] Pitzschke A, Schikora A, Hirt H. MAPK cascade signalling networks in plant defence[J]. Curr Opin Plant Biol,2009,12(4): 421-426.
[4] Sinha A K, Jaggi M, Raghuram B, et al. Mitogen-activated protein kinase signaling in plants under abiotic stress[J]. Plant Signal Behav, 2011, 6(2): 196-203.
[5] Rodriguez M C, Petersen M, Mundy J. Mitogen-activated protein kinase signaling in plants[J]. Annu Rev Plant Biol,2010, 61(4): 621-649.
[6] MAPK Group. Mitogen-activated protein kinase cascades in plants: a new nomenclature[J]. Trends Plant Sci, 2002, 7(7):301-308.
[7] Chang L, Karin M. Mammalian MAP kinase signalling cascades[J]. Nature, 2001, 410(6 824): 37-40.
[8] Gustin M C, Albertyn J, Alexander M, et al. MAP kinase pathways in the yeast Saccharomyces cerevisiae[J]. Microbiol Mol Biol Rev, 1998, 62(4): 1 264-1 300.
[9] 朱 斌, 梁 颖. 植物MAPK C族基因的研究进展[J]. 生物技术通报, 2012, 11(1): 27-31.
[10] 黄华孙. 中国橡胶树育种五十年[M]. 北京:中国农业出版社,2005: 82-86.
[11] 程 汉, 安泽伟, 黄华孙. 巴西橡胶树CBF1基因的克隆和序列分析[J]. 热带作物学报, 2005, 26(1): 50-55.
[12] 蔡海滨, 胡彦师, 黄华孙, 等. 巴西橡胶树CBF2基因的克隆和表达分析[J]. 热带农业科技, 2008, 32(3): 1-5, 12.
[13] 李 言, 杨署光, 陈月异,等. 渗透胁迫与植物激素等对巴西橡胶树HbMT2a基因表达的影响[J]. 热带作物学报, 2011, 32(5): 828-832.
[14] 杜 磊, 张德春, 邓 治,等. 巴西橡胶树一个AP2/EREBP转录因子的克隆及表达分析[J]. 植物生理学报, 2013, 63(11): 1 238-1 244.
[15] 安泽伟, 陈根辉,程 汉,等. 橡胶树冷应答转录组cDNA-AFLP分析[J]. 林业科学, 2010, 56(3): 62-67.
[16] Silva C C, Mantello C C, Campos T, et al. Leaf-, panel- and latex-expressed sequenced tags from the rubber tree under cold-stressed and suboptimal growing conditions: the development of gene-targeted functional markers for stress response[J]. Mol Breed, 2014, 34(3): 1 035-1 053.
[17] Danquah A, de Zelicourt A, Colcombet J, et al. The role of ABA and MAPK signaling pathways in plant abiotic stress responses[J]. Biotechnol Adv, 2014, 32(1): 40-52.
[18] Meng X, Zhang S. MAPK cascades in plant disease resistance signaling[J]. Annu Rev Phytopathol, 2013, 51(2): 245-266.
[19] Samajova O, Plihal O, Al-Yousif M, et al. Improvement of stress tolerance in plants by genetic manipulation of mitogen-activated protein kinases[J]. Biotechnol Adv, 2013, 31(1):118-128.
[20] Mizoguchi T, Irie K, Hirayama T, et al. A gene encoding a mitogen-activated protein kinase kinase kinase is induced simultaneously with genes for a mitogen-activated protein kinase and an S6 ribosomal protein kinase by touch,cold,and water stress in Arabidopsis thaliana[J]. Proc Natl Acad Sci U S A, 1996, 93(2): 765-769.
[21] Ortiz-Masia D, Perez-Amador M A, Carbonell J, et al. iverse stress signals activate the C1 subgroup MAP kinases of Arabidopsis[J]. FEBS Lett, 2007, 81(9): 1 834-1 840.
[22] 吴 涛. 玉米根系促分裂源活化蛋白激酶的表达特性、转基因植株分析及cDNA文库的构建[D]. 泰安: 山东农业大学, 2007.
[23] Wen J Q, Oono K, Imai R. Two novel mitogen-activated protein signaling components, OsMEK1 and OsMAP1, are involved in a moderate low-temperature signaling pathway in rice[J]. Plant Physiol, 2002, 129(4): 1 880-1 891.
[24] Ichimura K, Mizoguchi T, Yoshida R, et al. Various abiotic stresses rapidly activate Arabidopsis MAP kinases ATMPK4 and ATMPK6[J]. Plant J, 2000, 24(5): 655-665.
[25] Teige M, Scheikl E, Eulgem T, et al. The MKK2 pathway mediates cold and salt stress signaling in Arabidopsis[J]. Mol Cell, 2004, 15(1): 141-152.
[26] Smekalova V, Doskocilova A, Komis G, et al. Crosstalk between secondary messengers,hormones and MAPK modules during abiotic stress signalling in plants[J]. Biotechnol Adv,2014, 32(1): 2-11.
[27] Pitzschke A, Djamei A, Bitton F, et al. A major role of the MEKK1-MKK1/2-MPK4 pathway in ROS signalling[J]. Mol Plant, 2009, 2(1): 120-137.

