离子型溶剂([Bmim]Cl+MEA+H2O)密度、黏度测定及吸收CO2性能研究
徐 凡,高思春
(惠生工程(中国)有限公司河南化工设计院分公司,河南郑州 450018)
离子型溶剂([Bmim]Cl+MEA+H2O)密度、黏度测定及吸收CO2性能研究
徐 凡,高思春
(惠生工程(中国)有限公司河南化工设计院分公司,河南郑州 450018)
制备了离子型溶剂(MEA+[Bmim][Cl]+H2O),测定了该离子型溶剂的密度、黏度随温度和离子液体浓度的变化规律,并分别通过二次多项式方程和阿伦尼乌斯方程对密度、黏度数据进行关联。初步探讨了离子型溶剂吸收CO2的性能,并与传统吸收剂(30%MEA+70%H2O)进行对比。结果表明,当1-丁基-3-甲基咪唑氯盐([Bmim][Cl])的浓度小于10%时,CO2的吸收量变化较小;此外通过二次多项式对CO2在离子型溶剂中的溶解度数据进行关联,所得计算值与实验值的相对偏差不超过3%,关联结果较好。该研究结果为下一步探讨离子型溶剂捕集CO2的能耗提供了基础数据。
离子型溶剂;离子液体;密度;黏度;CO2溶解度
随着温室效应日益加剧,CO2的捕集与封存成为当今社会关注的热点[1]。目前传统乙醇胺法是工业上捕集CO2的常用方法,然而由于该方法存在溶剂损失大、再生能耗高等缺点,越来越多的学者开始探索新的 CO2捕集技术[2]。自 Brenneke课题组[3]首次发现离子液体(IL)中可溶解一定量的CO2后,由于离子液体与其它分子溶剂相比具有液程范围宽、蒸气压小和热稳定性高等优点,利用离子液体吸收CO2逐渐成为研究的热点[4-7]。然而,大多数室温离子液体CO2吸收量较低,功能化离子液体黏度较大且大规模制备IL时需要涉及多步反应和纯化,因此单独使用IL作为捕集CO2的吸收剂很难实现工业化。
自2008年Noble等[8]提出了将IL与醇胺复配成离子型溶剂来捕集CO2的方法后,用离子型溶剂吸收CO2的方法逐渐受到关注,然而在这些研究中,离子溶剂中所选用的胺大多限于三级胺如MDEA,而一级胺如MEA却很少有人报道,而且研究中所使用的IL大多黏度较大、成本较高且热稳定性较差;此外,有关MEA+IL+H2O复配溶剂的物化性质也鲜有报道。为此,本文选用易溶于MEA水溶液的[Bmim][Cl]与30%MEA水溶液复配成离子型溶剂,对该类离子型溶剂吸收CO2的性能进行了相关实验,该研究将为进一步探索离子型溶剂吸收CO2的能耗提供一定的基础数据。
本工作配制了离子型溶剂(MEA+[Bmim][Cl]+H2O),测定了该离子型溶剂的密度、黏度随温度和离子液体浓度的变化规律,并分别通过二次多项式方程和阿伦尼乌斯方程对密度、黏度数据进行关联;初步考察了离子型溶剂吸收CO2的性能,并通过二次多项式对CO2在离子型溶剂中的溶解度数据进行关联。
1 试验部分
1.1 原料与装置
1.1.1 试验原料与离子型溶剂的制备
1.1.1.1 试验原料
1-丁基-3-甲基咪唑氯盐([Bmim][Cl]) (河南利华制药有限公司)纯度大于99%,使用前真空干燥24 h;MEA(分析纯,>99%);二氧化碳(分析纯,>99.95%),北京北温气体公司。
1.1.1.2 离子型溶剂(MEA+[Bmim][Cl]+ H2O)的制备
按一定的质量比配制了以下溶剂:MEA+[Bmim][Cl]+H2O(ω1=0.3,ω2=0.1),MEA+[Bmim][Cl]+H2O(ω1=0.3,ω2=0.2),MEA+[Bmim][Cl]+H2O(ω1=0.3,ω2=0.3),MEA+[Bmim][Cl]+H2O(ω1=0.3,ω2=0.5),其中,ω1,表示MEA在混合气中的质量分数,ω2表示[Bmim]Cl2在混合气中的质量分数。
1.1.2 试验装置与分析仪器
1.1.2.1 分析仪器
离子型溶剂均由精度为±0.0001 g的高精度天平(BS124S)进行称量配制,密度采用DMA5000型高精度密度仪(精度为1×10-6g/cm3,奥地利安东帕公司)测定,黏度用AMVn全自动落球式黏度仪(奥地利安东帕公司)测定。
1.1.2.2 CO2吸收装置
CO2在离子型溶剂(MEA+[Bmim][Cl]+ H2O)中溶解度和吸收速率的测定采用如图1所示的气液相平衡装置。试验装置主要包括平衡釜、气体储罐、磁力搅拌器、带磁力搅拌的恒温水浴、压力变送器、温度传感器和真空泵。其中,平衡釜和气体储罐压力范围是0~2.5 MPa,订做于北京理化技术研究所;带磁力搅拌的恒温水浴,温度范围是室温~90℃,控温精度为±0.1℃,磁力搅拌(50 Hz,800 W),订做于北京东方精瑞科技发展有限公司; 3051TA3A2B21AB4M5罗斯蒙特压力变送器,测量范围0~1 MPa,精度为±0.075%,购于北京蓝宇海天科技有限公司;SWD-H温度传感器,量程0~100℃,精度为±0.1℃,购于北京中能博宇电气技术有限公司。
1.2 密度、黏度的测定

图1 气液相平衡试验装置
为考察离子型溶剂(MEA+[Bmim][Cl]+H2O)的物理性质,测定了不同配比体系的密度黏度。
1.2.1 密度
密度的测定采用安东帕公司生产的密度计Anton Paar DMA 5000,考察不同配比体系密度随温度变化的情况,并对密度数据进行了关联。密度计的密度、温度和压力范围分别为0~3 g/cm3、0~90℃和0~1000 kPa,其中密度的准确度和重现性分别为5×10-6g/cm3和1×10-6g/cm3,温度的重现性为0.01℃;此外,在测定密度的过程中,每次使用的样品量最少为1 mL。
1.2.2 黏度
黏度的测定采用安东帕公司生产的黏度计Anton Paar AMVn,考察了不同配比体系黏度随温度变化的情况,并对黏度数据进行了关联。黏度计的黏度、时间和温度范围分别为0.3~2 500 mPa·s、0~250 s和5~135℃,其中黏度的重复性<0.1%,再现性<0.5%,时间和温度的精度分别小于0.002 s和0.05℃。
1.3 CO2在离子型溶剂(MEA+[Bmim][Cl]+ H2O)中溶解度的测定
1.3.1 溶解度的测定方法
首先关闭阀门1、2、3、7,打开阀门4、5、6,对整个体系抽真空,关闭阀门6,使平衡釜在高于复配溶剂饱和蒸气压5 kPa、气体储罐压力接近0下保持30 min。然后打开阀门7,利用釜内外压差将约15 mL溶液压入釜中,记录进液前后溶液的质量m1、m2;关闭阀门7,打开搅拌,使釜内溶液稳定在设定温度,并处于自身的饱和蒸气压下,记下平衡釜气相压力p0。接下来打开阀门2、3、5,向气体储罐中充入一定气体后关闭阀门2、3、5。最后,打开阀门6,向平衡釜进入一定量气体,关闭阀门6;记录进气前后气体储罐压力值p1i、p1f;当平衡釜上方压力表显示数值在2 h内不再发生变化时,可认为气体与溶剂已达到平衡状态,这时记下平衡釜平衡气相压力P2。
进液前后液体的质量之差m1-m2为进入平衡釜中液体的质量m(溶液),根据事先测定的复配溶剂的密度ρ可以算出平衡釜中液体的体积VECl,再通过校正后的p VT方程,由平衡釜总体积VEC、实验中所记录的压力值p0、p1i、p1f和p2,可计算出气体在溶剂中的溶解度α(摩尔分数)。
1.3.2 溶解度的计算方法
1.3.2.1 压缩因子z的计算
通过物性数据手册查得CO2临界性质:Tc= 304.2 K,pc=7.376 MPa,ω=0.225,其中Tc为临界温度,pc为临界压力,ω为偏心因子。
根据对比态原理,可得对比温度Tr,如式(1)所示

由普遍化第二Virial关系式可以求得B,如式(2)~(4)所示

通过Virial方程可以得到压缩因子z,如式(5)所示
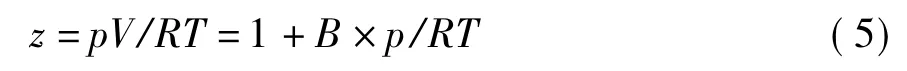
1.3.2.2 溶解度α的计算

由式(6)可以计算出平衡釜中CO2总摩尔数由式(7)可以计算出平衡釜气相中CO2的摩尔数

因此,平衡釜液相中CO2的摩尔数可以通过式(8)获得

最后得出CO2在复配溶剂中的溶解度α(mol CO2/mol MEA),如式(9)所示

在式(6)中,VGR是气体储罐体积,p1i是进气前气体储罐压力,p1f是进气后气体储罐压力;在式(7)中VEC是平衡釜体积,VECl平衡釜液相体积,p0是进液后未通气前平衡釜气相压力,p2平衡釜平衡时气相压力。
2 结果与讨论
2.1 离子型溶剂(MEA+[Bmim][Cl]+H2O)密度、黏度的测定结果及关联
为检验实验中所使用的密度、黏度计的准确性,我们对30%MEA水溶液的密度、黏度进行了测定,并把试验值与文献值进行对比,实验结果如表1所示。

表1 30%MEA的密度、黏度与文献值对比
2.1.1 密度、黏度测定结果
密度、黏度测定结果如表2所示。对比表1和表2可知,相同条件下离子型溶剂的密度、黏度均略大于30%(质量分数)醇胺水溶液。此外,表2中的数据表明,离子型溶剂(MEA+[Bmim][Cl]+ H2O)的密度和黏度均随温度的升高而降低,随离子液体浓度的增加而升高。
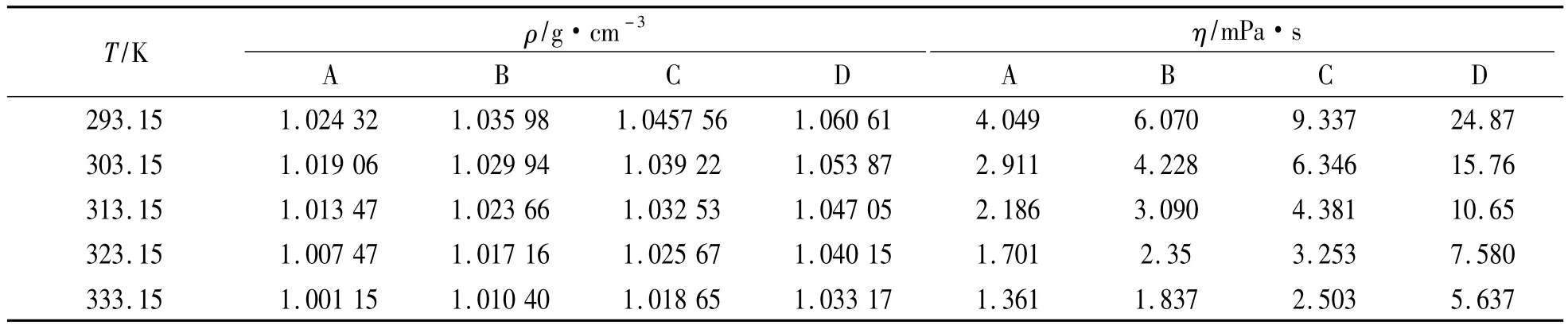
表2 T=(293.15~333.15)K时MEA+[Bmim][Cl]+H2O的密度、黏度
2.1.2 密度、黏度数据的关联
对离子型溶剂(MEA+[Bmim][Cl]+H2O)的


密度、黏度对温度分别用式(10)、(11)进行了关联,关联结果如图2所示。此外,用式(12)、(13)对关联的平均偏差进行了分析,结果列于表3中,由结果可以看出关联结果较好。
2.2 离子型溶剂(MEA+[Bmim][Cl]+H2O)吸收CO2性能研究

图2 MEA+[Bmim][Cl]+H2O在不同温度不同[Bmim][Cl]质量分数的密度、黏度
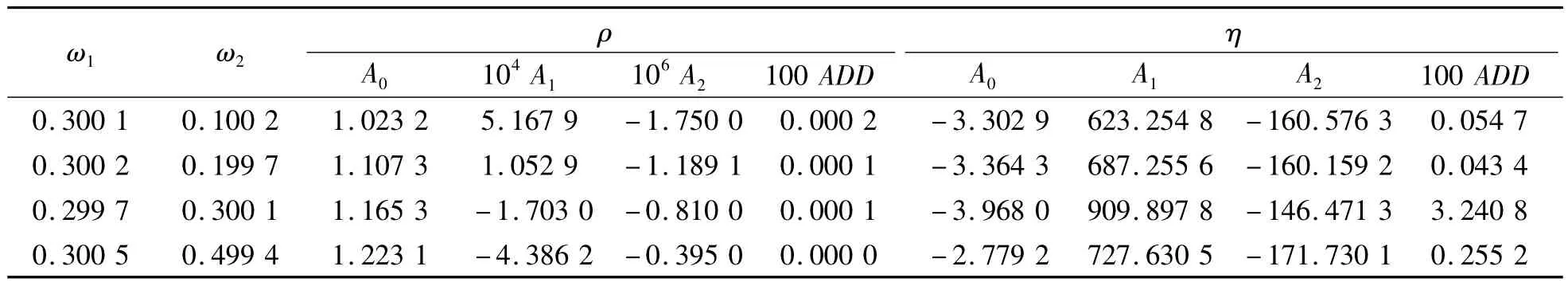
表3 MEA+[Bmim][Cl]+H2O密度、黏度与温度关系的拟合参数和平均偏差
为验证实验装置的可信性,利用1.1.2中所述的装置在40℃下进行了三次30%MEA水溶液吸收CO2的气液相平衡实验,并与Jou et al.Shen and Lietal.和Lee etal.等报道的文献值相比较,结果如图3所示。
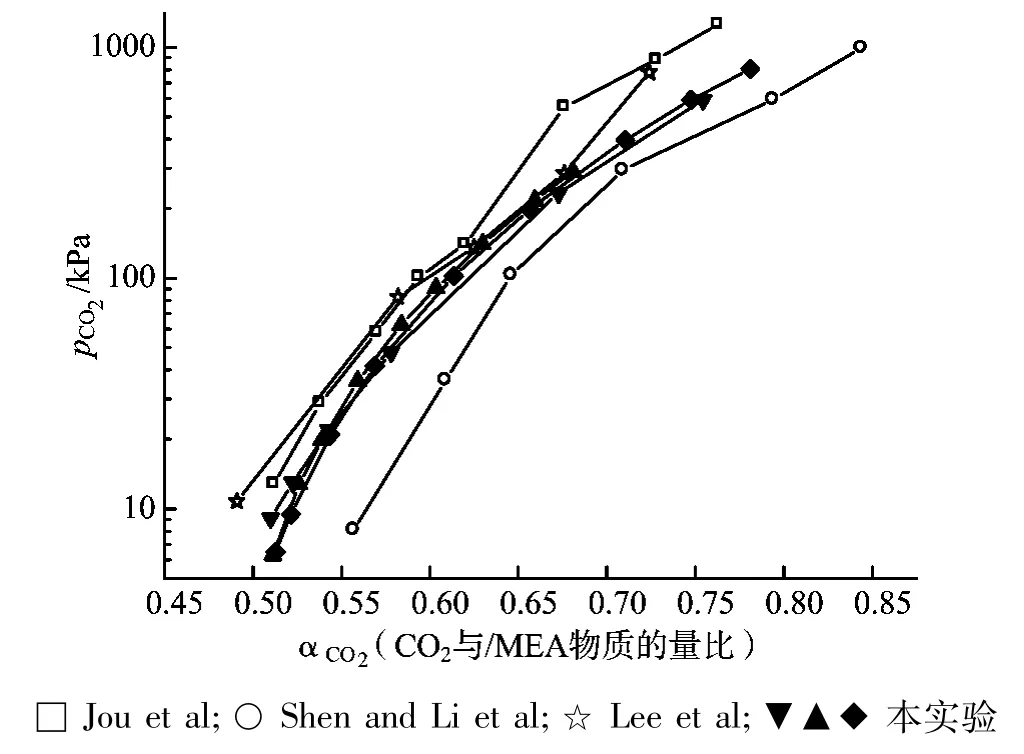
图3 40℃下CO2在30%MEA水溶液中的溶解度
由图3可知,三次试验的试验值均在文献值之间,因此证明了试验装置的可靠性;此外,三次试验结果平行性较好,证明了试验装置的准确性。
2.2.1 溶解度的测定结果
313.15 K下,CO2在离子型溶剂(MEA+[Bmim][Cl]+H2O)中溶解度试验结果列于表4中。用Origin对表4中的数据作图,结果见图4。

图4 313.15 K下CO2在含有不同[Bmim][Cl]浓度的MEA+[Bmim][Cl]+H2O离子型溶剂中的溶解度
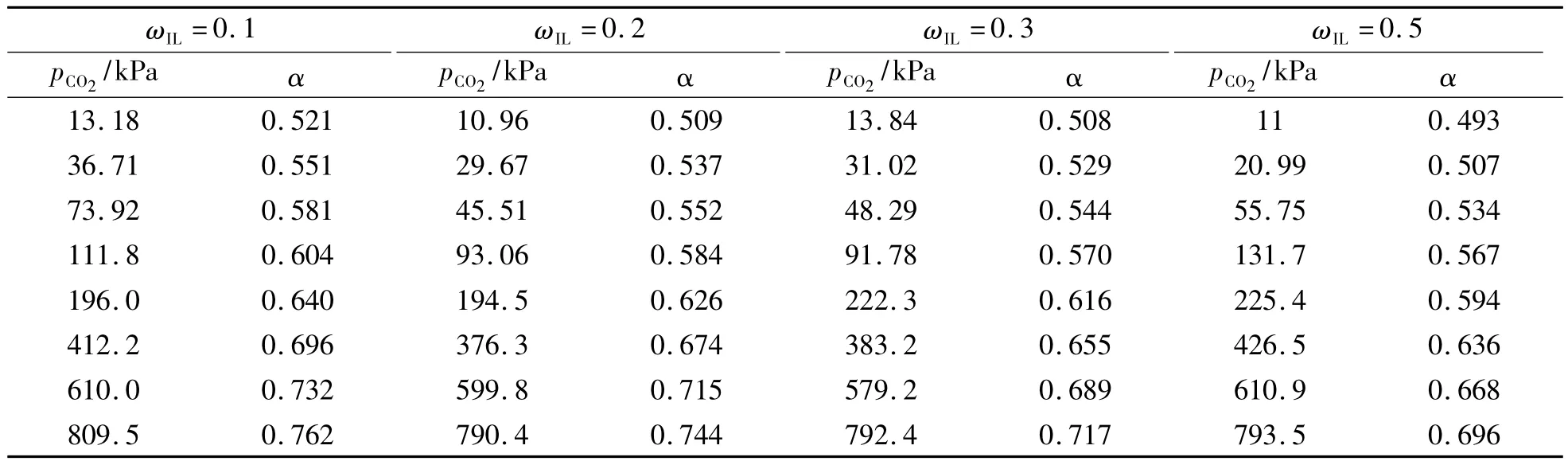
表4 313.15 K下CO2在含有不同[Bmim][Cl]质量分数下的MEA+[Bmim][Cl]+H2O离子型溶剂中的溶解度
图4显示了313.15 K下 CO2在含有不同[Bmim][Cl]质量分数的MEA+[Bmim][Cl]+ H2O复配体系中的溶解度随CO2平衡压力变化的曲线。从图4中的结果可以看出当加入IL的浓度由10%增长至50%时,吸收剂的吸收能力逐渐降低,呈现良好的平行性,且当IL浓度<10%时,溶解度变化较小,几乎可以忽略。
2.2.2 溶解度数据的关联
对CO2在离子型溶剂中的溶解度对压力用二次多项式(14)进行了关联[14],

按式(14)进行关联后各体系对应的系数值列于表5中。对计算值与试验值进行了比较,结果见图5。结果表明,当压力为10~800 kPa时,计算值与试验值的相对偏差不超过3%,关联结果较好。

表5 MEA+[Bmim][Cl]+H2O按式(14)进行关联后各体系对应的系数值

图5 313.15 K下CO2在离子型溶剂中溶解度的计算值与试验值对比图
3 结论
测定了离子型溶剂(MEA+[Bmim][Cl]+ H2O)的密度、黏度随温度和离子液体浓度的变化规律,结果显示:相同离子液体浓度下,离子型溶剂的密度随温度的升高而逐渐降低,对于黏度,当离子型溶剂中离子液体浓度较高时,黏度随着温度的升高而迅速降低,当浓度较低时,黏度随着温度的升高而缓慢降低;相同温度下,离子型溶剂的密度随离子液体浓度的升高而逐渐升高,黏度随离子液体浓度的升高而迅速升高。通过二次多项式方程和阿伦尼乌斯方程分别对密度、黏度数据进行关联,所得的MEA+[Bmim][Cl]+H2O离子型溶剂密度、黏度的平均偏差分别小于0.000 2%和3.24%,说明二次多项式方程和阿伦尼乌斯方程能够很好地关联离子型溶剂的密度和黏度。初步考察了离子型溶剂(MEA+[Bmim][Cl]+H2O)吸收CO2的性能,结果表明:CO2的溶解度随CO2分压的增大而增大,且当压力较低时溶解度随着压力的增大而迅速增大,当压力较高时溶解度随着压力的增大而缓慢增加;CO2在离子型溶剂中的溶解度随着离子液体含量的增加而逐渐降低,当IL浓度小于10%时,CO2的溶解度变化较小,几乎可以忽略不计。通过二次多项式对CO2在离子型溶剂中的溶解度数据进行关联,所得计算值与试验值的相对偏差不超过3%,关联结果较好。
[1] Camper D,Bara JE,Gin D L,et al.Room-temperature ionic liquid-amine solutions:tunable solvents for efficient and reversible capture of CO2[J].Ind Eng Chem Res,2008,47(21):8496-8498.
[2] Zhang Xiangping,Zhang Xiaochun,Dong Haifeng,et al. Carbon capture with ionic liquids:overview and progress[J].Energy Environ Sci,2012,5(5):6668-6681.
[3] Blanchard L A,Hancu D,Beckman E J,et al.Green processing using ionic liquids and CO2[J].Nature,1999,399(6731):28-29.
[4] KampsÁPS,Tuma D,Xia J,etal.Solubility of CO2in the ionic liquid[Bmim][PF6][J].JChem Eng Data,2003,48(3):746-749.
[5] Finotello A,Bara J E,Camper D,et al.Room-temperature ionic liquids:temperature dependence of gas solubility selectivity[J].Ind Eng Chem Res,2008,47(10): 3453-3459.
[6] Finotello A,Bara JE,Narayan S,et al.Ideal gas solubilities and solubility selectivities in a binary mixture of room-temperature ionic liquids[J].J Phys Chem B,2008,112(8):2335-2339.
[7] Lee BC,Outcalt SL.Solubilities of gases in the ionic liquid 1-n-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide[J].JChem Eng Data,2006,51(3): 892-897.
[8] Camper D,Bara JE,Gin D L,et al.Room-temperature ionic liquid-amine solutions:tunable solvents for efficient and reversible capture of CO2[J].Ind Eng Chem Res,2008,47(21):8496-8498.
[9] LiM H,Lie Y C.Densities and viscosities of solutions of monoethanolamine+N-methyldiethanolamine+water andmonoethanolamine+2-amino-2-methyl-1-propanol+water[J].JChem Eng Data,1994,39(3):444-447.
[10] Amundsen TG,Φi L E,Eimer D A.Density and viscosity of monoethanolamine+water+carbon dioxide from (25 to 80)℃[J].J Chem Eng Data,2009,54(11): 3096-3100.
[11] Jou F Y,Mather A E,Otto F D.The solubility of CO2in a 30 mass percentmonoethanolamine solution[J].Can J Chem Eng,1995,73(1):140-147.
[12] Shen K P,LiM H.Solubility of carbon dioxide in aqueous mixtures of monoethanolamine with methyldiethanolamine[J].JChem Eng Data,1992,37(1):96-100.
[13] Lee J,Otto F D,Mather A E.The solubility of H2S and CO2in aqueous monoethanolamine solutions[J].Can J Chem Eng,1974,52(6):803-805.
[14] Jou F-Y,Mather A.Solubility of carbon dioxide in an aqueousmixture ofmethyldiethanolamine and N-methylpyrrolidone at elevated pressures[J].Fluid Phase Equilib,2005,228:465-469.
Study on Density、Viscosity and Solubility of CO2in Aqueous M ixtures of Ionic Liquid([Bm im]Cl+MEA+H2O)
XU Fan,GAO Sichun
(Henan Chemical Design Institute Branch ofWison Engineering Ltd,Zhengzhou 450018,China)
Ionic solvent(MEA+[Bmim][Cl]+H2O)is prepared,density and viscosity of MEA+[Bmim][Cl]+H2O with different ILmass fractions aremeasured at temperature varying from 293.15 to 333.15 K,the density and viscosity data is fitted and regressed by the equations of quadratic polynomial and Arrhenius equation.The solubility of CO2in the aqueousmixtures of MEA+IL ismeasured over a range of CO2partial pressure of10 to 800 kPa and IL concentrations from10 to 50%at313.15 K,the introduction of[Bmim][Cl]could decrease the solubility of CO2in aqueousmixtures of MEA,but when the concentration of IL is less than 10%,the presence of IL in aqueous30%MEA has no obviously effect on CO2solubility.Correlations of solubility as a function of CO2partial pressure have been conducted with deviation of±3%,all the results have provided basis data for further study on the energy consumption of CO2capture using ionic solvents.
Ionic solvent;ionic liquid;density;viscosity;CO2solubility
O611.05
A
1003-3467(2015)10-0029-06
2015-07-28
徐 凡(1988-),女,硕士,从事化工科研及设计工作,电话:18538061077。

