连续排水法测定H2O2分解反应级数和速率常数实验
唐梦环王 良谢永生*谢永刚张路路
(1.重庆三峡学院环境与化学工程学院,重庆万州 404100)(2.中国石油抚顺石化公司石油二厂,辽宁抚顺 113004)
连续排水法测定H2O2分解反应级数和速率常数实验
唐梦环1王 良2谢永生1*谢永刚1张路路1
(1.重庆三峡学院环境与化学工程学院,重庆万州 404100)(2.中国石油抚顺石化公司石油二厂,辽宁抚顺 113004)
利用初始速率法原理,遵循科学的假设检验思维,采用连续排水法准确测量不同时间生成氧气的体积,精确测定了Iˉ催化双氧水分解反应级数和反应速率常数.文章描述的连续排水法测定H2O2分解反应动力学性质实验有效利用常用仪器,操作方便、易于实现,数据精确、重现性好,绿色环保,完全满足高校本科物理化学实验教学要求.
初始速率法;连续排水法;双氧水分解反应动力学;绿色实验
1 引 言
双氧水分解反应级数和反应速率常数的测定实验是高校物理化学实验中的基础实验,也是公认的绿色环保教学实验,被国内多部基础化学实验教材所采用.其方法是在已知双氧水分解反应为一级动力学反应的基础上以KI为催化剂,取一定浓度C0的H2O2与KI混合,用量气管或皂膜流量计测定H2O2分解时释放出氧气的体积,并记录一定体积间隔的反应时间,依据氧气的体积推算出相应H2O2的瞬时浓度Ct,再以对t作图求出反应速率常数.虽然该方法实验成本低、操作简单,但在教学实践中存在一些缺陷和问题:1)采用量气管或皂膜流量计测量瞬时氧气体积,操作虽简单却不可靠,学生在瞬时时间t时准确读取随时间不断增加的氧气体积是非常困难的,容易出现明显的系统误差,导致该实验重复性较差,学生很难得到准确的结果,削弱了实验课的教学效果.2)传统实验总是在实验原理中直接告诉学生:由于反应过程中KI的浓度不变,双氧水催化分解反应为一级动力学反应.这样犯了先入为主的教学大忌,使得整个实验成为验证性实验,无助于学生对理论知识的理解、加深,更无助于学生科研素质的培养.
为解决上述问题,本文利用初始速率法原理,采用连续排水法获得氧气体积,设计了一个新型I-催化双氧水分解反应动力学实验,精确测定了双氧水催化分解反应级数和反应速率常数.图1为实验装置示意图,使用实验室常见玻璃仪器组装.
2 实验原理
初始速率法又称为初始浓度法,是测定动力学反应常数的常用实验方法.反应初始速率是双氧水分解反应中反应速率最快的时候,此时反应物浓度也最大,因此可以进行较明确的计量测定,减少实验相对误差.
本实验是采用排水法测定反应一开始时计时反应时间(tΔ s)所产生的氧气的物质的量,依据化学计量式求算tΔ s时反应物浓度的变化值从而求算平均速率.
双氧水催化反应化学方程式为
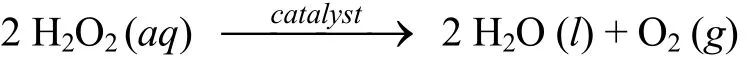
初始速率(r始)被定义为

速率方程为

α、β分别为H2O2和KI的反应分级数,总级数n = α + β,[H2O2]和[I-]均为初始浓度,k为反应速率常数,其单位为
Δt时间时双氧水浓度的变化Δ[H2O2]可由生成氧气物质的量n(O2)求得,而n(O2)可由理想气体定律求得

其中atmP为环境大气压;T为反应体系温度,与
环境温度相同;))(O(2gV为生成氧气的体积,可由排出水的质量m(H2O)和环境温度下的密度ρ(H2O)求得,为反应溶液总体积;R为摩尔气体常数.则初始速率计算公式为

若固定KI的浓度(即[I—])不变,取若干个不同的H2O2初始浓度[H2O2],则

采用假设检验法,假设H2O2反应分级数α = 1、2、3等,以若干个[H2O2]α为横坐标,相应r始为纵坐标,经由Excel作图,满足线性回归方程式r始= k′ [H2O2]α的α值即为H2O2反应分级数,在Excel图上表现为一条直线.
若固定H2O2的初始浓度[H2O2],取若干个不同的KI初始浓度[I-],则

KI反应分级数β采用相同的假设检验法确定.
确定了双氧水催化分解反应的级数α和β后,即可通过Excel的线性回归方程求取k′和k″,依据式(3)或(5)代入初始[I-]或[H2O2]计算得到反应速率常数k.
3 实 验
3.1 仪器和药品
250 mL三颈圆底烧瓶,50 mL容量瓶,恒压漏斗,小试管,50 mL烧杯,温度计,试管,胶塞,玻璃管,胶头滴管,吸耳球,移液管,磁力加热搅拌器,电子分析天平,蒸馏水,15.0% H2O2溶液和0.500 mol/L KI溶液.
3.2 实验过程
(1)按图1装好仪器,在磁力加热搅拌器上安装水浴锅,在水浴锅上固定一个250 mL三颈圆底烧瓶,将一合适小试管放入烧瓶中,使试管底部接触烧瓶底部、试管上口与瓶颈下端齐平,可在试管上端缠绕一定厚度生料带,防止小试管在烧瓶中的晃动.从烧瓶侧口加入适量蒸馏水,用带细长虹吸管的胶塞塞紧烧瓶侧口,将恒压漏斗插入三颈圆底烧瓶中间的瓶口,并使恒压漏斗下端插入烧瓶内试管中,另一瓶口处插入带温度计的胶塞,并调整温度计水银球位置,使水银球位于水面下方,且不接触烧瓶瓶壁.虹吸管由三部分组成,分别是玻璃滴管、胶管及玻璃管,将玻璃管插入烧瓶内,用胶塞固定在烧瓶侧口上,移动烧瓶外胶管、改变玻璃滴管管口位置可改变烧瓶内水位.
(2)组装好仪器后,检查装置的气密性.用吸耳球使虹吸管充满水,调节虹吸管管口位置,将瓶内水位和虹吸管口处于水平位置(虚线),静置,看虹吸管内水是否产生溢出或倒吸,若水未倒吸或溢出,则表示装置气密性较好.
(3)在水浴锅中灌入适量水,打开磁力加热搅拌器,调整烧瓶内温度稳定在20 ℃则将其中加入少量蒸馏水,待烧瓶内蒸馏水温度稳定在20 ℃时,记录温度.取洁净干燥的50 mL烧杯,用分析天平称其质量,并记录.
(4)用移液管依次将规定量(见表1和表3)的蒸馏水V(H2O) mL和双氧水溶液V(15.0 % H2O2) mL加入烧瓶内的反应试管中,再将对应量的KI溶液V(0.500 mol L-1KI) mL加入至恒压漏斗中,用胶塞塞紧烧瓶恒压漏斗瓶口.调整虹吸管管口的位置与烧瓶内蒸馏水位平行.将已称量的50 mL烧杯放置在虹吸管玻璃滴管管口处,并使管口贴紧烧杯内壁.打开恒压滴液漏斗旋塞,当两种试剂接触时开始计时.tΔ s时移开接收烧杯,冷却至室温后称重、去皮即得tΔ s时生成氧气排出水的质量m(H2O) ɡ.
3.3 结果和讨论
1)确定H2O2的反应分级数
固定反应溶液总体积(5 mL)和反应溶液中[KI](0.100 mol·L-1),按照表1所示比例调节5个实验反应溶液中[H2O2],收集60 s左右时生成氧气排出的水,依据公式(1)计算初始速率,结果见表2.据表2以[H2O2]α(假设α = 1或 2)为横坐标,初始速率(Rate)为纵坐标经Excel作散点图2.由图2可知,α = 1时满足等式(2),线性回归方程式为

上式表明H2O2的反应分级数α = 1
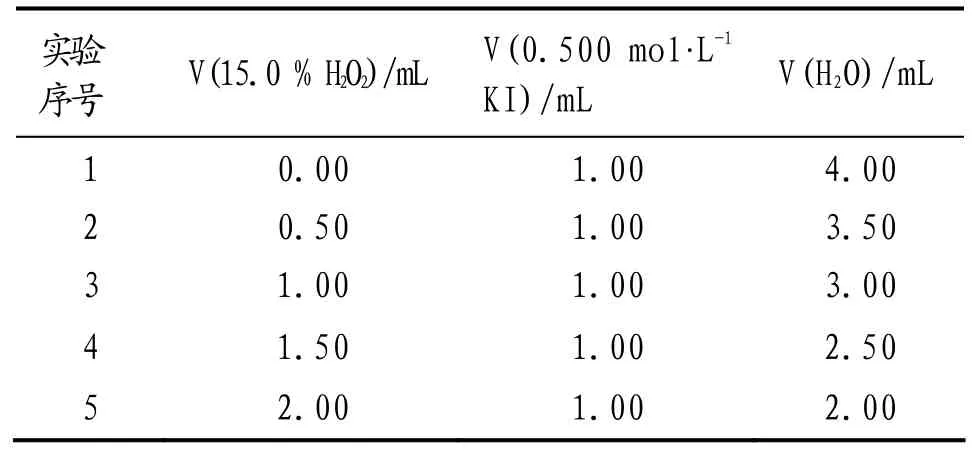
表1 H2O2反应分级数测定实验投料比例

表2 [H2O2]对初始速率(Rate)的影响

图2 [H2O2]α对初始速率(Rate)的影响
2)确定KI的反应分级数
固定反应溶液总体积(5 mL)和反应溶液中过氧化氢的浓度([H2O2] = 0.940 mol·L-1),按照表3所示比例调节5个实验反应溶液中[KI],收集60 s左右时生成氧气排出的水,依据公式(1)计算初始速率,结果见表4.据表4以[KI]β(假设β = 1 或 2)为横坐标,初始速率(Rate)为纵坐标经Excel作散点图3.由图3可知,β = 1时满足等式(4),线性回归方程式为

上式表明KI的反应分级数β = 1.

表3 KI反应分级数测定实验投料比例

表4 [KI]对初始速率(Rate)的影响

图3 [KI]β对初始速率(Rate)的影响
3)确定反应速率常数
由线性回归方程(6)确定斜率k′ = 0.001 10,依据等式(3)可求得在20 ℃时的反应速率常数k = 0.011 0 L·mol-1· s-1.
同理,由线性回归方程(7)确定斜率k″ = 0.010 2和等式(5)可求得20 ℃时的反应速率常数k = 0.010 8 L·mol-1· s-1.
采用10名学生实验结果,基于线性回归方程(6)和等式(3)测定的反应速率常数平均值为0.011 0 ± 0.000 4 L·mol-1· s-1,基于线性回归方程(7)和等式(5)测定的反应速率常数平均值为0.010 8 ± 0.000 4 L·mol-1· s-1.结果表明新型双氧水催化分解反应动力学实验结果重现性非常好,精密度很高.
4 结 论
新型双氧水催化分解反应动力学实验具有以下优点:
1)采用实验室常用玻璃仪器,组装简单,易于实现,占地面积小,便于同时开展多组学生实验.
2)采用排水法间接测量生成氧气的量,准确度高,易于实现.采用量气管或皂膜流量计准确读取某一时刻随时间变化的氧气体积是困难的,容易导致读数偏差.采用排水法间接测量生成氧气的量时由电子分析天平称重与生成氧气等体积的水的质量来计算生成氧气的体积,有效避免读数时造成的明显误差.在需要的时刻(tΔ时),可迅速移开接收试管,准确测定此时刻的氧气体积,实验操作易于实现.
3)采用假设检验法确定反应级数是提出问题后解决问题的教学方法,符合教学规律.新型实验将传统验证实验变为探索研究型实验,利于提高学生实验兴趣,培养学生科研素质.
4)初始速率法测定双氧水催化分解反应级数和速率常数实验结果重现性好、精密度高.
总之,初始速率法测定双氧水催化分解反应动力学常数实验有效利用常用玻璃仪器,操作方便、易于实现、数据精确、重现性好,是符合高校本科物理化学实验教学要求的探索研究型实验.

图1 实验装置示意图
[1]李三鸣.物理化学实验[M].北京:中国医药科技出版社,2007.
[2]李云平,辛凌云,李森兰,等.KI催化H2O2分解的速度常数、活化能测定研究[J].洛阳师范学院学报,2006,25(5):79-81.
(责任编辑:张新玲)
An Experiment of to Determine the Reaction Rate and Rate constants of H2O2with the Method of Continuous Drainage
TANG Menghuan WANG Liang XIE Yongsheng* XIE Yonggang ZHANG Lulu
(School of ENvirnment and Chemistry Engineering, Chongqing Three Georges University, Wanzhou, Chongqing 404100)
This paper, under the principle of initial rate method and with scientific hypothetic test thinking, adopts continuous drainage method to accurately measure the volume of oxygen generated in different periods of time and the reaction rate and rate constants in the decomposition reaction of catalytic hydrogen peroxide. Ordinary glasses are effectively used in dynamics experiment of the H2O2decomposition reaction, thus the experiment is easy to operate, the data are accurate, and re-experimenting proves sound and environment-friendly. It can meet the requirements of the experimenting courses in universities.
initial rate method; continuous drainage method; dynamics of decomposition of hydrogen peroxide; environment-friendly experiment
O6-3
A
1009-8135(2015)03-0083-04
2015-01-11
唐梦环(1994-),女,重庆城口人,重庆三峡学院学生.
谢永生(1980-),男,山东安丘人,重庆三峡学院讲师,博士,主要研究药物化学.
重庆三峡学院青年教师项目资助(13QN21)阶段性成果

