猪圆环病毒2型贵州株ORF1基因的生物信息学分析
杨利勇,李春凤,周继勇
(1.浙江大学 动物科学学院,浙江 杭州310058;2.贵州福斯特生物科技有限公司,贵州 贵阳550014)
猪圆环病毒(Porcine cirvovirus,PCV)属圆环病毒科圆环病毒属,被国际病毒分类委员会(ICTV)第6次学术报告列为一个新的病毒。PCV 最早在PK-15 细胞中发现,开始认为是一种细胞污染物[1-2]。PCV分为2个主要的基因型,即PCV1 与PCV2型,其中PCV2被认定是导致仔猪断奶后多系统衰竭征(PMWS)的主要病原[3]。PCV2常与细小病毒(PPV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪肺炎支原体 (MPS)、伪狂犬病毒(PRV)混合感染,造成猪的免疫失败[4-5]。PCV2基因组有11个开放性阅读框,其中ORF1是PCV2基因组中最大的阅读框,编码病毒复制相关蛋白(Rep)[6],Rep蛋白能被原核表达系统所表达[7],为在蛋白水平上研究Rep 蛋白提供了良好的工具。将体外表达的ORF1编码蛋白与表达粒细胞-巨噬细胞集落刺激因子的真核表达质粒联合免疫猪群,能起到抵抗PCV2攻击的作用,表明针对ORF1基因编码蛋白的抗体可能具有中和病毒的作用[8]。鉴于此,笔者针对PCV2ORF1基因序列设计1对特异性引物,以PCV2阳性病料所提DNA 为目标,获取PCV2贵州株(PCV2-GZ)ORF1基因,并分析其生物信息学特性,旨在为后续的疫苗研究奠定基础。
1 材料与方法
1.1 病料及试剂
PCV2贵州株(PCV2-GZ)阳性病料,由贵州大学动物疫病研究所保存。DNAiso Reagent提取试剂盒,pMD18-T 载体,dNTPs,200bp DNA Marker,Amp,购自大连宝生物有限公司;Gel Extraction Kit(50×)胶回收试剂,E.Z.N.ATMPlasmid Mini Kit质粒提取试剂盒,购自OMEGA 公司;Taq酶,购自北京天根生化科技有限公司;限制性内切酶(BamH Ⅰ、HindⅢ),购自MBI公司;其他试剂均为国产分析纯。
1.2 引物的设计与合成
参考GenBank 登录PCV2 代表性毒株ORF1基因序列,以Prime 5.0软件设计针对ORF1基因的 特 异 性 引 物, P-F: 5′-ATGCCCAGCAAGAAGAATG-3′, P-R:5′-TCAGTAATTTATTTCATATGGAA-3′,大小945bp,由上海捷瑞生物有限公司合成。
1.3 目的基因的获取、克隆及序列测定
PCV2-GZ阳性病料无菌研磨处理后,按DNA提取试剂盒说明书提取病料总DNA,以总DNA 为模板,用引物P-F/P-R 进行PCR 扩增。反应体系:引物(10pmoL/μL)各2μL,10×PCR Buffer(含MgCl2)5μL,dNTP(10 mmol/L)1 μL,Taq 酶(5U/μL)1μL,灭菌双蒸水补足50.0μL。反应条件:95℃预变性5 min;94℃变性30s,60℃退火30s,72℃延伸30s,35 个循环;72℃延伸10 min。取扩增产物进行琼脂糖凝胶电泳,以胶回收试剂盒纯化回收目的基因。按常规T 载体克隆方法进行重组质粒构建及PCR;将扩增片段克隆到pMD18-T中,所得重组质粒以EcoRⅠ/HindⅢ进行双酶切鉴定;将初步鉴定为阳性的重组质粒进行测序。
1.4 PCV2ORF1 生物信息学分析
用DNAStar软件对PCV2-GZ 与国内外毒株(表)进行ORF1 基因核苷酸、氨基酸同源性分析,并分别分析其编码蛋白的α-螺旋、β-折叠、T-转角、无规则卷曲及亲水性、表面可及性和抗原指数,对蛋白二级结构和B 细胞抗原表位进行预测,用Karplus-Schulz方法预测其柔性区域;用MegAlign软件绘制系统进化树,比较分离株亲缘关系;用InterProScan软件分析蛋白结构域;用SWISS-Model软件预测蛋白的三维空间结构。

表 PCV2 ORF1核苷酸序列的登录信息Table The genbank accession information of different PCV2strains
2 结果与分析
2.1 目的基因的扩增
从 图1 可 知,PCV2-GZ 阳 性 病 料 经PCV2ORF1特异性引物扩增出945bp的特异性条带,与预期扩增片段大小相符。

图1 PCV2 ORF1基因的PCR 扩增电泳图谱Fig.1 PCR results of ORF1PCV2
2.2 重组质粒酶切鉴定
经双酶切鉴定,电泳检测到961bp和2 692bp的2条谱带(图2),酶切结果与预期相符,初步证明所克隆的目的基因成功插入pMD18-T 载体,可进行后续基因序列测定。
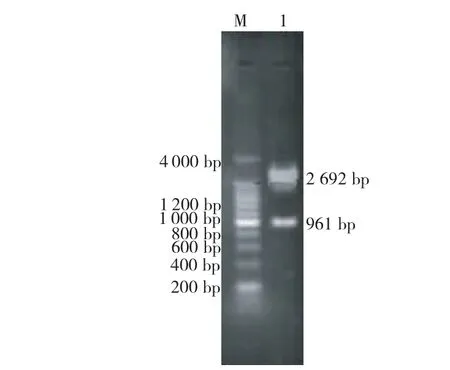
图2 重组质粒的双酶切结果Fig.2 The double digestion of restructuring plasmid
2.3 PCV2-GZ ORF1基因序列
经测序,PCV2-GZORF1基因全长945bp,编码Rep蛋白共314个氨基酸(图3)。测序结果登陆GeneBank,获取登录号为KF152883。
2.4 ORF1基因的同源性
经同源性分析,PCV2-GZORF1基因与其他14株毒株的核苷酸同源性为96.8%~99.7%,与国内HUB-5和ZJ-38的同源性最高,均为99.7%。推导的氨基酸序列同源性,PCV2-GZ编码的Rep蛋白与韩国P710-1和国内HUB-5、SC-10、ZJ-38株的较高,均为99.4%。
2.5 系统进化树
从图4可知,PCV2-GZORF1基因与国内毒株相应序列同属于一个分支,而与国外毒株(韩国P710-1株)的亲缘关系相距较远。

图3 PCV2-GZORF1 基因的序列Fig.3 The sequeces of the PCV2-GZ ORF1gene strain

图4 PCV2 ORF1基因的核苷酸系统进化树Fig.4 Phylogenetic tree of ORF1gene nucleotide

图5 PCV2-GZ Rep蛋白的二级结构Fig.5 Secondary structure prediction of PCV2-GZ Rep protein
2.6 Rep蛋白的二级结构及抗原表位
经预测,Rep蛋白柔性区域呈散在性分布,以β-折叠、T-转角和无规则卷曲为主(图5)。可能的抗原表 位区为N 端第2~18 位、23~34 位、86~98位、159~167位、189~205位、287~297位(图6),推测PCV2-GZ Rep蛋白可形成优势抗原表位。
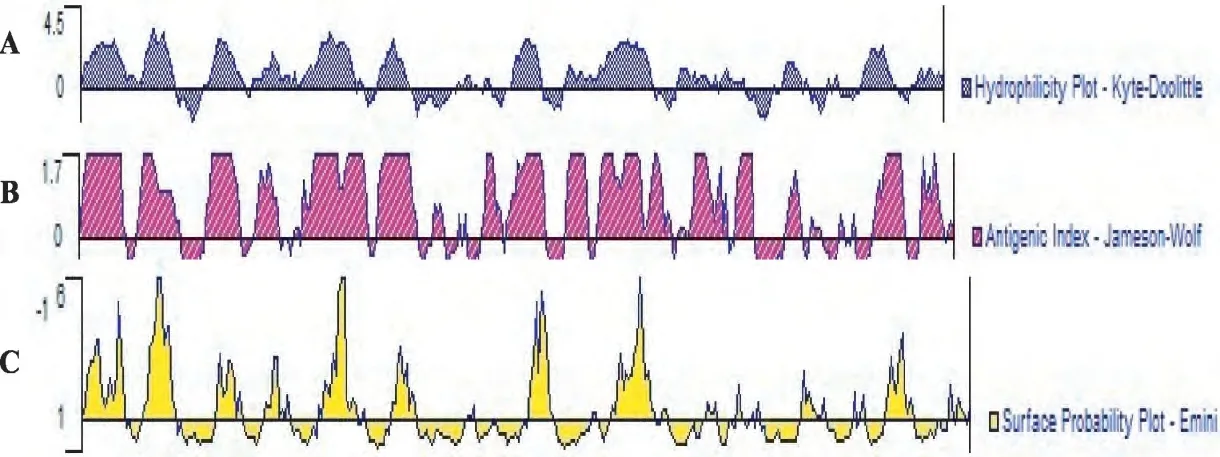
图6 PCV2-GZ Rep蛋白的抗原表位Fig.6 Epitope prediction of PCV2-GZ Rep protein

图7 PCV2-GZ ORF1基因Rep蛋白的结构域Fig.7 The Rep protein domain of ORF1gene of PCV2isolation GZ

图8 PCV2-GZ ORF1基因Rep蛋白的三维结构Fig.8 The Rep protein domain of ORF1gene of PCV2isolation GZ
2.7 蛋白结构域及蛋白三维结构
从图7 可知,PCV2-GZ Rep 蛋白第171~257位氨基酸处存在解旋酶;在N 端15~100位氨基酸处存在病毒复制相关蛋白;在111~285位氨基酸处存在P-loop,是dNTP 结合的位点,具有潜在的ATP水解酶功能,且不存在跨膜结构和信号肽。
经预测,PCV2-GZORF1基因Rep蛋白含有β-折叠和T-转角(图8)。
3 结论与讨论
Rep蛋白由PCV 最大的开放阅读框ORF1编码,ORF1 基因由病毒的正向链转录而成,与PCV基因组滚环复制相关[9]。Rep蛋白和Rep’蛋白是PCV 病毒复制所必需。PCV1Rep基因的启动子位于728~838位核苷酸区域[10]。Rep 蛋白具有与典型滚环复制(RCR)相关的3个保守结构,分别为Ⅰ(FTLNN)、Ⅱ(HLQG)、Ⅲ(YCSK)以及结合dNTPs的P环(P-loop)结构(序列为G-GKS),对维持Rep蛋白的功能至关重要,缺失或突变均会影响病毒的复制[11]。PCV2Rep基因位于第51~995位核苷酸,含有945个碱基,编码315个氨基酸,编码病毒复制相关蛋白。PCV1与PCV2相比,氨基酸序列同源性达86%,但Rep 蛋白相对比较保守,2种血清型PCV 病毒有抗原交叉。曾朔等[12]研究表明,圆环病毒Rep基因可能是原核生物解旋酶编码基因间的重组产物。
研究结果表明,PCV2-GZORF1 基因全长为945bp,编码314个氨基酸,与国内外流行毒株的同源性(98.1%~99.4%)较高。核苷酸序列与国内毒株的同源性较高,可能是由于近年来贵州畜牧业的快速发展,大量跨区引种,猪群流动性增加所致[13]。Rep蛋白是PCV 病毒在复制早期利用宿主细胞的蛋白合成系统,由自身基因组上的ORF1 转录、翻译及加工而成,主要功能是在截短蛋白Rep’的协同作用下,启动和终止病毒DNA 滚环式复制[14]。Rep蛋白不存在于病毒粒子中,在体外培养细胞(如PK-15)中含量也较少,要获取足量的一定纯度的天然Rep蛋白变得极为困难,一般采用体外表达来获取该蛋白[15]。利用软件对PCV2-GZORF1 基 因Rep蛋白结构预测表明,Rep蛋白可形成优势抗原表位,且不存在跨膜结构和信号肽,推测可进行PCV2ORF1基因的全基因表达[16]。
[1]Gillespie J,Opriessnig T,Meng X J,et al.Porcine circovirus type 2and porcine circovirus-associated disease[J].Vet.Intern.Med.,2009,23(6):1151-1163.
[2]Harding J C S,Ellis J A,McIntosh K A,et al.Dual heterologous porcine circovirus genogroup 2a/2binfection induces severe disease in germfree pigs[J].Vet Microbiol,2010,145(3-4):209-219.
[3]王先炜,姜 平,李玉峰,等.华东地区PMWS患病猪群PCV-2的检测及其基因特征[J].中国兽医学报,2004,24(3):240-242.
[4]王宪文,姚四新,王丽荣,等.猪圆环病毒Ⅱ型流行病学新特点及致病机理研究进展[J].中国畜牧兽医,2012,39(12):190-194.
[5]Laila Darwich,Enric Mateu.Immunology of porcine circovirus type 2(PCV2)[J].Virus Res,2012,164(1-2):61-67.
[6]Benjamin R Trible,Raymond Rowland.Genetic variation of porcine circovirus type 2(PCV2)and its relevance to vaccination,pathogenesis and diagnosis[J].Virus Res,2012,164(1-2):68-77.
[7]Finsterbusch.Interaction of the replication proteins and capsid protein of porcine circovirus type 1and 2 with host proteins[J].Virology,2009,386(1):122-131.
[8]刘 丹,王一平,吴洪丽,等.猪圆环病毒2 型Rep/Rep'和Cap蛋白亚单位疫苗免疫保护性试验[J].中国预防兽医学报,2013,35(11):916-919.
[9]王亚丹,卢权威,陈红英,等.猪圆环病毒2型河南株全基因组的克隆与序列分析[J].中国兽医学报,2012,32(10):1429-1434.
[10]李 杰,葛 猛,罗 维,等.猪圆环病毒2型Rep蛋白ELISA 抗体检测方法的建立[J].中国预防兽医学报,2012,11(34):894-897.
[11]Guo L J,Lu Y H,Wei Y W,et al.Porcine circovirus type 2(PCV2):genetic variation and newly emerging genotypes in China[J].Virol,2010(7):273.
[12]曾 朔,吴星星,冉多良,等.猪圆环病毒Ⅱ型ORF1基因的克隆与原核表达[J].新疆农业大学学报,2011,34(4):307-310.
[13]崔亚兰,王开功,张 华,等.2007—2011年贵州省猪圆环病毒感染的流行病学调查[J].畜牧与兽医,2013,45(3):70-73.
[14]Andrew K C.Porcine circovirus:Transcription and DNA replication[J].Virus Res,2012,164(1-2):46-53.
[15]Cino-Ozuna,Henry S,Hesse R,et al.Characterization of a new disease syndrome associated with porcine circovirus type 2 (PCV2)in previously vaccinated herds[J].Clin Microbiol,2011,49(5):2012-2016.
[16]Nathan M B,Meng X J.Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2 (PCV2)[J].Virus Research,2012,164(1-2):33-42.

