HPLC 同时测定甘薯茎叶中叶黄素和β–胡萝卜素
邢鹏,包兢兢,秦玉芝,陆英,2*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
类胡萝卜素是一类具有多种生理功能的天然色素,可以预防人心血管疾病、癌症及许多其他慢性疾病[1–2],其中叶黄素、β–胡萝卜素、玉米黄素、番茄红素等10 余种已被广泛用作抗氧化剂和食品、医药添加剂,在医药、食品、饲料和化妆品工业中发挥着重要作用。
中国是世界上甘薯栽培第一大国,年产量约1.2亿t,占世界总产量的85.9%[3]。甘薯茎叶作为甘薯产业的副产物,除部分食用或作牲畜饲料外,绝大部分被丢弃,造成了资源的极大浪费。近年来,人们逐渐发现甘薯茎叶中含有多种生物活性成分,如黄酮类、绿原酸类等,同时还含有较高的叶黄素和β–胡萝卜素,具有广阔的开发利用前景[4–6]。不同植物品种含有的类胡萝卜素种类、含量均有很大差异。采用HPLC 测定蔬菜果实中多种类胡萝卜素组分时有的提取溶剂不同[7–8],有的还进行了皂化处理[9–10],类胡萝卜素总量或单个类胡萝卜素都有降解损失,且甘薯或茎叶中叶黄素和β–胡萝卜素的HPLC 测定多为单一组分,提取方法、流动相组成等也不相同。本研究在对提取条件考察优化的基础上,建立了HPLC 同时测定甘薯茎叶中叶黄素和β–胡萝卜素的方法,操作简便,方法可靠,并对11个品种甘薯茎叶进行了叶黄素和β–胡萝卜素含量测定,现将结果报道如下。
1 材料与方法
1.1 材料
供试甘薯品种为水果薯、水果花叶薯、紫羽1号、紫羽2号、农大紫1号、农大紫2号、浙紫1号、紫薯2号、高淀粉、叶用薯1号、叶用薯2号等,均采自湖南农业大学园艺园林学院蔬菜基地。60℃下烘干、粉碎,备用。
叶黄素和β–胡萝卜素对照品纯度为90%,购于合肥博美生物科技有限公司。乙醇、正己烷、丙酮、三氯甲烷、乙酸乙酯、甲醇均为分析纯;甲醇、四氢呋喃、乙腈均为色谱纯,购自恒兴化学制造有限公司。
1.2 主要仪器与设备
LC–10AT岛津高效液相色谱仪,配有PDA检测器,色谱柱WondasilTMC18(5 μm,4.6 mm×250 mm,日本岛津公司);SB3200DT超声波清洗仪(宁波新芝科技股份有限公司);HH数显恒温水浴锅(江苏省金坛市金城国胜实验仪器厂)。
1.3 方法
1.3.1 色谱条件
流动相A 为甲醇–水(体积比为95∶5); 流动相B 为甲醇–乙腈–四氢呋喃(体积比为70∶20∶5),梯度洗脱:0~10min,100% A;10~30min,100%~70% A,0%~30% B。检测波长为445 nm。流速为1.0mL/min。柱温20℃。
1.3.2 标准曲线的绘制
称取叶黄素14.10mg、β–胡萝卜素15.30mg于10mL 容量瓶中,用甲醇溶解,配制成1.269mg/mL 和1.377mg/mL 的储备液,测定时逐级稀释至0.253 8mg/mL、0.126 9mg/mL、0.0253 8mg/mL、0.0126 9mg/mL、0.634 5μg/mL、0.126 9μg/mL、0.063 45μg/mL,进样量10 μL,以进样质量为横坐标,峰面积为纵坐标绘制标准曲线。
1.3.3 样品溶液制备方法
1) 提取溶剂的确定。称取紫羽1 号茎叶混合原料6 份,每份1.0g,分别加入40mL 甲醇、乙醇、正己烷、丙酮、三氯甲烷、乙酸乙酯,室温下避光浸润12 h,然后超声提取20min,过滤,定容至50mL,过膜进样,测量不同提取溶剂中叶黄素和β–胡萝卜素含量。重复2次,确定最佳提取溶剂。
2) 提取次数的确定。称紫羽1 号茎叶样品5份,按1)中确定的提取溶剂分别提取1、2、3、4、5次,根据提取效果确定提取次数。
3) 提取条件的优化。采用1)中确定的提取溶剂,以料液比、超声温度、超声时间为主要影响因素,进行L9(33)正交试验(表1),滤渣同法再提取1次,合并滤液,定容至100mL,进样,对提取效果进行正交试验分析,确定最优提取条件。
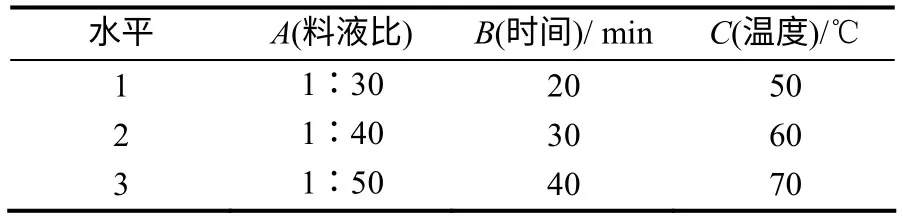
表1 正交试验因素及水平 Table 1 Orthogonal factors and levels table
1.3.4 方法学考察
1) 精密度试验。取叶黄素与β–胡萝卜素混合标准品连续进样5次,以峰面积计算叶黄素和β–胡萝卜素的RSD。
2) 稳定性试验。称取粉碎的紫羽1 号茎叶混合原料1.0g,加入30mL 甲醇,50℃超声提取40min,过滤,滤渣同法再提取2次,合并滤液,定容至100mL,取20 μL 分别在0、1、2、4、6、8、24 h 进行HPLC 分析,以峰面积计算叶黄素和β–胡萝卜素的RSD。
3) 重现性试验:称取紫羽1 号茎叶混合原料5份,每份1.0g,按稳定性试验方法制备成甲醇提取液, 以峰面积计算叶黄素和β–胡萝卜素的RSD。
4) 回收率试验:称取紫羽1 号茎叶混合原料3份,每份1.0g,加入一定量标准品(叶黄素和β–胡萝卜素分别为0.125 和0.137mg、0.252 和0.275mg、0.377 和0.413mg),按稳定性试验方法制成供试液,进样,计算加标回收率。
1.3.5 样品的测定
称取粉碎的样品1.0g,加入30mL 甲醇,50℃超声提取40min,过滤,滤渣同法再提取2次,合并滤液,定容至100mL,取20 μL 进行HPLC 分析,根据标准曲线计算样品中叶黄素、β–胡萝卜素含量。
2 结果与分析
2.1 甘薯叶提取物的HPLC 分析
叶黄素和β–胡萝卜素标准品及甘薯叶提取物的HPL 色谱图见图1。以峰面积为纵坐标(Y),进样量为横坐标(X),叶黄素的回归方程为Y=9.7×106Χ– 1.9×105(R2=0.999 1),线性范围0.000 635~2.538μg;β–胡萝卜素的回归方程为Y=7.4× 106Χ– 50 189 (R2=0.999 3),线性范围0.006 885~ 2.538μg。

图1 叶黄素和β–胡萝卜素标准品及甘薯叶提取物的HPLC 色谱图 Fig.1 HPLC chromatogram of lutein , beta-carotene standers and extracts of sweet potato leaves
2.2 试验条件的优化结果
2.2.1 最适提取溶剂
从表2 可知,甲醇、乙醇对叶黄素的提取效果较好,对β–胡萝卜素的提取效果与其他常用提取溶剂的提取效果相近,但采用乙醇为提取溶剂,测定出的叶黄素峰形矮胖,柱效差,因此,选用甲醇作提取溶剂。
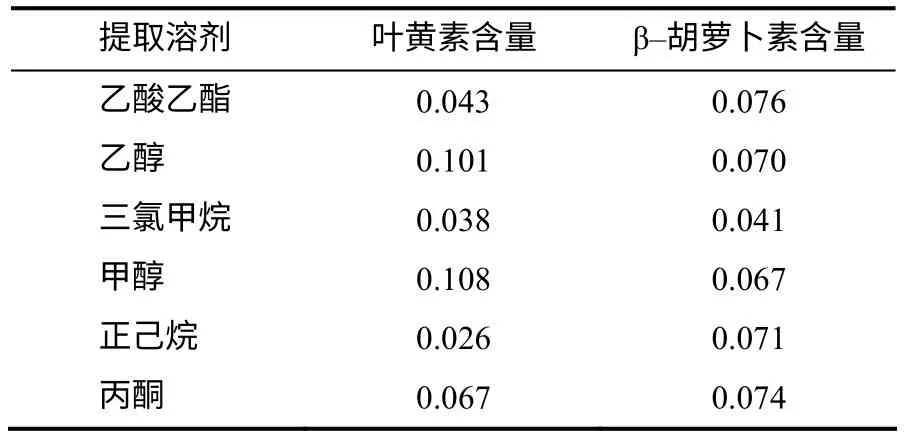
表2 不同溶剂提取的叶黄素和β–胡萝卜素的含量 Table 2 Contents of different solvents on the efficiency of lutein and beta-carotene mg/g
2.2.2 最适提取次数
由表3 可见,叶黄素和β–胡萝卜素的提取得率随着提取次数的增加而增加,提取3次后2个目标物的提取量已趋于稳定,因此,确定试验提取次数为3次。
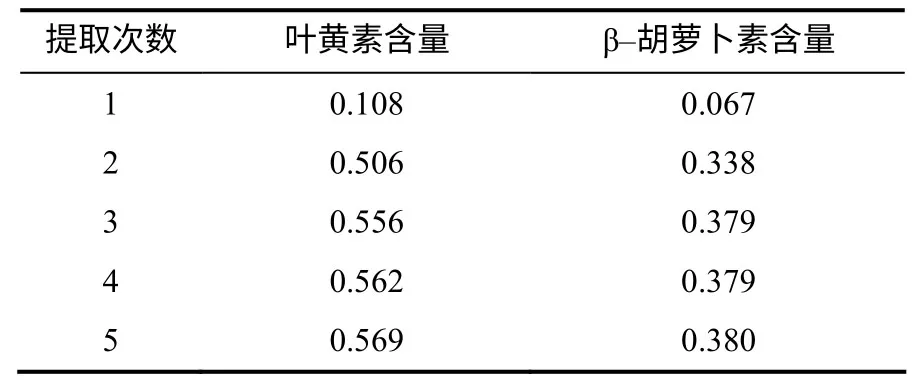
表3 各提取次数下的叶黄素和β–胡萝卜素含量 Table 3 Contents of sequence on effect extract efficiency mg/g
2.2.3 正交试验结果
正交试验的提取效果见表4。从表4 可知,最佳的提取方案为A1B3C1,即固液比1∶30,超声温度50℃,超声时间40min。

表4 正交试验结果 Table 4 Results of orthogonal experimen
2.3 方法学考察结果
精密度试验结果,叶黄素和β–胡萝卜素的峰面积RSD 为0.9%和1.8%,表明该方法具有较高精密度; 6 h 内叶黄素与β–胡萝卜素测定值基本稳定,峰面积RSD 分别为1.2%和1.4%,表明该方法稳定性好;重现性试验中,叶黄素与β–胡萝卜素峰面积RSD 分别为1.3%和1.8%,表明该方法重复性好;叶黄素与β–胡萝卜素的回收率分别为105.8%和101.5%,表明该方法具有较高的准确度。
2.4 甘薯茎叶中叶黄素及β–胡萝卜素含量的测定
由表6 可见,11 份不同品种甘薯茎叶中的叶黄素及β–胡萝卜素含量最高的是成熟叶,其次为新中叶,茎的含量最低,同一部位不同品种间的含量存在差异,成熟叶中的叶黄素含量0.504~1.031mg/g,β–胡萝卜素含量0.188~0.467mg/g;新叶中叶黄素含量0.409~0.617mg/g,β–胡萝卜素含量0.141~ 0.242mg/g;叶柄中叶黄素含量0.094~0.195mg/g,β–胡萝卜素含量0.040~0.082mg/g;茎叶黄素含量0.053~0.103mg/g,β–胡萝卜素含量0.036~0.045mg/g,其中花叶水果薯和紫羽1 号中的含量较高,其成熟叶中的叶黄素含量大于1mg/g,β–胡萝卜素含量大于0.4mg/g。
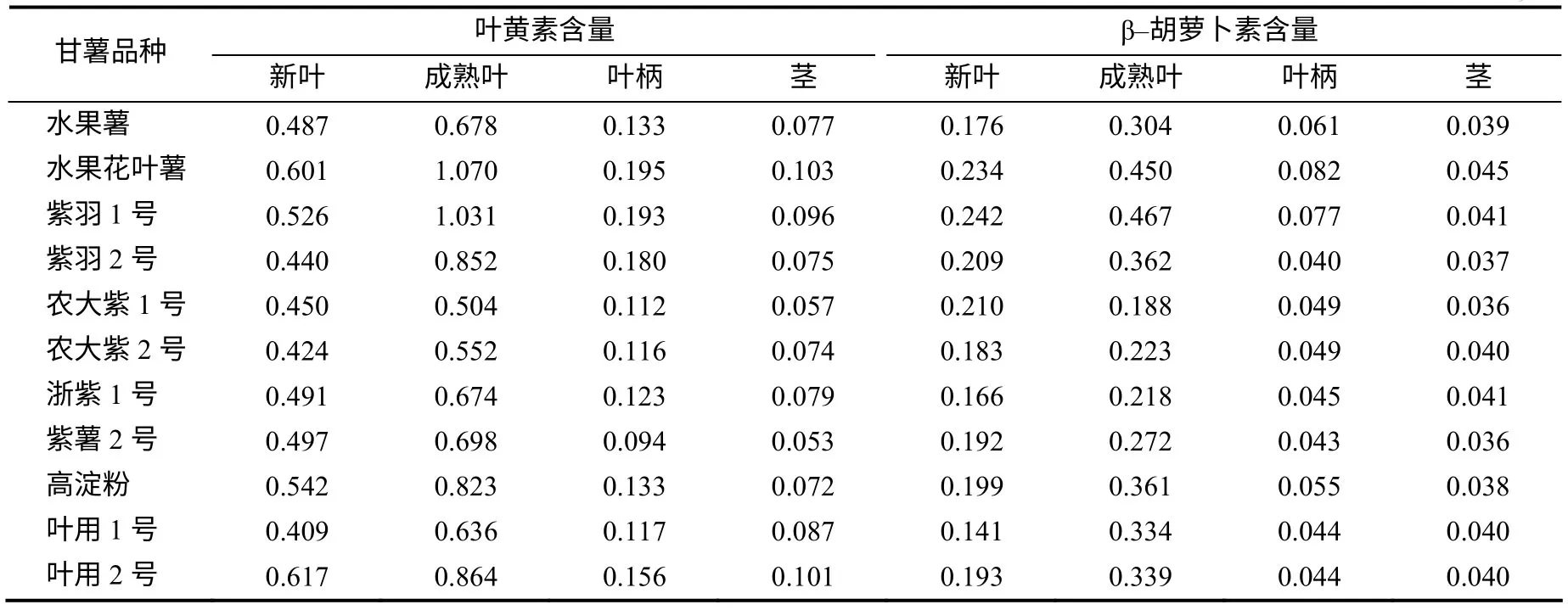
表5 不同品种甘薯茎叶中的叶黄素和β–胡萝卜素含量 Table 5 Lutein and beta-carotene content in sweet potato leaves and stems mg/g
3 讨论
叶黄素与β–胡萝卜素虽然都属类胡萝卜素,但叶黄素极性较大,可溶于大多数有机溶剂,而β–胡萝卜素极性较小,不溶于水,易溶于氯仿、正已烷等溶剂,因此,测定时的提取溶剂及处理方法均有不同,需要针对不同的提取溶剂进行比较。本研究采用了乙酸乙酯、乙醇、三氯甲烷、甲醇、正己烷、丙酮等作为提取溶剂,发现以甲醇为提取溶剂,对甘薯茎叶中的这2种组分提取效果均较好,经3次提取后可基本提取完全。提取液直接注入HPLC 色谱仪,经梯度洗脱,叶黄素和β–胡萝卜素得到很好分离,方法稳定,重复性好,回收率高,确定该方法准确可信。
近年来,人们逐渐发现甘薯茎叶中含有多种生物活性成分,如黄酮类、绿原酸类以及类胡萝卜素等。本研究结果表明,非叶用品种与叶用品种的甘薯茎叶中叶黄素和β–胡萝卜素含量差异不大,因此,不同品种的甘薯叶作为食用蔬菜均有较高的价值。
甘薯茎叶中叶黄素含量与普通万寿菊叶黄素含量(16~20mg/g)[7]的差距很大,但由于甘薯茎叶产量大,价格低,来源广,安全性高。因此,甘薯茎叶在提取方面仍具有一定优势,作为膳食补充剂开发,具有一定的发展前景。
在鸡日粮中添加5%~8%的银合欢粉(叶黄素含量为0.950mg/g),蛋黄颜色会加深,添加8%~12%的苜蓿粉(胡萝卜素含量为0.500mg/g),蛋黄和皮肤的颜色也可以加深[11],因此,甘薯叶作为饲料添加剂开发也具有较好的发展前景。
[1] Rao A V,Rao L G.Carotenoids and human health [J]. Pharmacological Research,2007(55):207–216.
[2] Paiva S A,Russell R M.Beta-carotene and other carotenoids as antioxidants[J].Journal of the American College of Nutrition,1999,18(5):426–433.
[3] 张彧,吴祎南,陈莉,等.红薯茎叶化学组成的研究进展[J].食品科学,2006(3):252–256.
[4] Hiroshi Ishida,Hiroko Suzuno,Noriko Sugiyama,et al. Nutritive evaluation on chemical components of leaves,stalks and stems of sweet potatoes (Ipomoea batatas poir)[J].Food Chemistry,2000(68):359–367.
[5] Aurea M Almazan,Fatima Begum,Colette Johnson. Nutritional quality of sweet potatogreens fromgreenhouse plants[J].Journal of Food Composition and Analyisi,1997,10(3):246–253.
[6] Harald M.Determination of the carotenoid content in selected vegetables and fruit by HPLC and photodiode array detection[J] . European Food Research and Technology,1997(38):88–94.
[7] 叶兆伟,李洵,刘柱明,等.万寿菊中叶黄素的三种提取方法比较[J].湖北农业科学,2014,4(5):874–876.
[8] 陶俊,张上隆,徐建国.等.柑橘果实主要类胡萝卜素成分及含量分析[J].中国农业科学,2003,36(10):1202–1208.
[9] 石晋.甘薯中类胡萝卜素分析[D].大连:大连理工大学,2008.
[10] 孙健,彭宏祥,董新红,等.甘薯中β–胡萝卜素 HPLC测定方法分析[J].食品科技,2009,34(1):236–238.
[11] 谢仲权,牛树琦.天然植物饲料添加剂生产技术与质量标准[M].北京:中国农业科学技术出版社,2004:76–77.

