Tfh细胞在重症肌无力患者胸腺中的表达及作用机制
张晓燕 常婷 刘沙沙 杨琨 李柱一
Tfh细胞在重症肌无力患者胸腺中的表达及作用机制
张晓燕 常婷 刘沙沙 杨琨 李柱一
目的 探讨Tfh细胞在重症肌无力(MG)患者胸腺中乙酰胆碱受体抗体(AChR-Ab)产生中的作用及机制。方法 收集28例MG患者、9例无胸腺异常的先天性心脏病患者和9例未合并MG的胸腺增生患者。采用流式细胞术检测胸腺中滤泡辅助T(Tfh)细胞和B细胞的比例,分别通过RT-PCR和Western-Blotting技术检测胸腺中Th1、Th2和Tfh细胞特异性转录因子T-bet、GATA-3、Bcl-6 mRNA水平和细胞因子干扰素γ(IFN-γ)、白细胞介素4(IL-4)、IL-21表达;采用HE和多标免疫荧光染色观察胸腺中生发中心以及Tfh细胞和B细胞之间的组织结构关系;采用放射免疫沉淀技术(RIA)检测MG患者胸腺和血清中AChR-Ab滴度;免疫磁珠提取胸腺中Tfh细胞和B细胞共培养,检测培养上清中IL-21和AChR-Ab滴度水平。结果 MG患者胸腺中Tfh细胞和B细胞比例及Tfh细胞相关转录因子Bcl-6 mRNA水平和细胞因子IL-21表达均较对照组增高(P<0.01);MG患者胸腺中抗AChR-Ab滴度较对照组增高(P<0.01);MG患者胸腺中存在异位生发中心,且在生发中心内Tfh细胞和B细胞存在共定位;MG患者胸腺Tfh和B细胞共培养上清中IL-21和AChR-Ab水平较对照组增多(P<0.01),且AChR-Ab产生可以被IL-21中和抗体阻断。 结论 Tfh细胞通过在MG患者胸腺中辅助B细胞形成异位生发中心及促进抗AChR-Ab产生参与MG的发生和发展。
T淋巴细胞,辅助诱导;重症肌无力;胸腺增生;生发中心;受体,胆碱能;抗体
重症肌无力(myasthenia gravis,MG)是神经系统自身免疫性疾病,80% 的MG是由乙酰胆碱受体抗体(acetylcholine receptor antibody,AChR-Ab)介导的主要累及神经肌肉接头突触后膜上烟碱型乙酰胆碱受体(AChR)的免疫性疾病[1]。MG患者的胸腺在AChR-Ab产生中具有重要作用[2]。80%的MG患者合并胸腺增生或者胸腺瘤;胸腺切除可使MG患者的临床症状得到显著改善[3]。目前触发抗AChR-Ab产生的机制尚不明确。滤泡辅助性T细胞(T follicular helper cells, Tfh)是近期发现的T辅助细胞(T help,Th)亚群。Tfh细胞定位于生发中心,在辅助B细胞成熟及抗体产生中发挥核心作用[4]。近期研究显示Tfh细胞参与了多种自身免疫性疾病的发生和发展[5]。MG患者外周血中Tfh细胞比例增高,且与疾病的严重程度呈正相关,表明Tfh细胞参与了MG的病理过程。但目前关于MG患者胸腺中Tfh细胞的表达及其作用机制尚不明确。
1 对象和方法
1.1 观察对象 收集2012-05-2013-11第四军医大学唐都医院神经内科就诊的确诊为MG合并胸腺增生患者28例,其中男16例,女12例,发病年龄1.4~78.6岁,病程0.5~156个月。所有患者进行Ossermann分型,其中Ⅰ型9例,Ⅱ型6例,Ⅲ型6例,Ⅳ型7例。根据MG评分(quantitative MG scoring system, QMGs)对疾病的严重程度进行评估[6]。收集无胸腺异常的先天性心脏病患者9例,其中男5例,女4例,年龄0.9~38岁,术中为充分暴露术野而取其胸腺组织;另收集不合并MG的胸腺增生(Non-myasthenia gravis,NMG)患者9例,其中男5例,女4例,年龄21.2~78.1岁。
1.2 主要试剂和仪器 人淋巴细胞分离液购于MP Biomedicals公司;CD4-FITC、CXCR5-APC、ICOS-PE单克隆抗体购于Biolegend公司;反转录试剂盒购于Takara公司;抗人白细胞介素-21(IL-21)、β-actin单克隆抗体购于Millipore公司;抗人干扰素γ(IFN-γ)单克隆抗体购于Abcam公司;抗人IL-4单克隆抗体购于Cell Signaling Tech公司;PCR引物由上海生工公司合成。T-bet,上游引物:5′-CTTGGTGTGGACTGAGATTGC-3′,下游引物:5′-ACTGGAAGGATAGGGGGACA-3′;GATA-3,上游引物:5′-AGACCACCACAACCACACTCT-3′,下游引物:5′-GATGCCTTCCTTCTTCATAGTCA-3′;Bcl-6,上游引物:5′-CCAGCAAAGAAGAAGAGAGACC-3′,下游引物:5′-CTGTGGACTAACCAGACCCTTC-3′;GAPDH,上游引物:5′-GACCTGACCTGCCGTCTA-3′,下游引物:5′-AGGAGTGGGTGTCGCTGT-3′;流式细胞仪购于BD公司;荧光定量PCR仪购于Bio-Rad公司;高速低温离心机购于Eppendorf公司。
1.3 方法
1.3.1 流式细胞术检测胸腺单细胞悬液中Tfh细胞比例:采用机械方法分离胸腺中单细胞悬液。取1×105个胸腺细胞加入抗人CD4-FITC、CXCR5-ACP、ICOS-PE、CD3-APC、CD19-PE单克隆抗体避光孵育30 min,洗液、固定后使用流式细胞仪检测CD4+CXCR5+ICOS+Tfh细胞和CD3-CD19+B细胞比例。
1.3.2 胸腺CD4+T细胞亚群特异性转录因子和细胞因子检测:将胸腺组织匀浆后离心,提取上清液。采用RT-PCR检测T-bet、GATA-3、Bcl-6 mRNA水平;采用Western-Blot检测胸腺中IL-21、IL-4、IFN-γ表达水平。
1.3.3 胸腺组织上清中抗AChR-Ab滴度检测:采用放射免疫沉淀法检测。取外伤截肢患者的肌肉组织,使用低温高速离心机离心机提取AChR,加人血清或胸腺组织匀浆上清,再加入125I标记的α-BuTx充分混匀后4 ℃过夜;加入兔抗人γ-球蛋白IgG,混匀后4 ℃静置2 h,4 ℃离心、洗涤后γ计数仪中计数,抗体滴度以nmol/L表示。
1.3.4 胸腺组织HE和免疫荧光染色:取新鲜胸腺组织,OTC包埋,连续切片制成10 μm冷冻切片。通过HE染色,光镜下观察生发中心的数量并拍照;将切片用5% (质量浓度)BSA封闭1 h后加入抗人CD4、CD19、CD35、CXCR5单克隆抗体,4 ℃孵育过夜。第2天洗涤后加入荧光标记二抗FITC、PE、Percp-cy5.5,37 ℃避光孵育2 h后洗涤,50%(体积分数)的甘油封片,共聚焦显微镜下观察CD4+CXCR5+、CD19+、CD35+细胞之间的组织结构关系并拍片。
1.3.5 胸腺细胞体外培养:取MG患者胸腺和正常胸腺组织各6例,使用细胞免疫磁珠分离胸腺单细胞悬液中CD4+CXCR5+Tfh细胞和CD19+B细胞共孵育7 d,体系中加入100 ng/mL金黄色葡萄球菌肠毒素B刺激。通过ELISA和放射免疫沉淀检测上清中IL-21浓度及抗AChR-Ab滴度。
1.4 统计学处理 应用SPSS 17.0统计软件进行统计学分析,对数据进行正态性检验,不符合正态分布的计量资料以中位数表示,采用Wilcoxon秩和检验。相关性检验采用Spearman法分析。以双侧P<0.05为差异具有统计学意义。
2 结果
2.1 各组胸腺Tfh细胞比例、相关细胞因子及转录因子水平 MG患者胸腺单细胞悬液中Tfh细胞比例、Bcl-6 mRNA、IL-21水平较对照组均显著升高(均P<0.01),且Tfh细胞比例和IL-21表达水平均与QMG评分呈正相关(P<0.01)。而Th1和Th2细胞转录因子T-bet、GATA-3,细胞因子IL-4和IFN-γ在各组之间比较差异无统计学意义(P>0.05)。结果见图1~8。
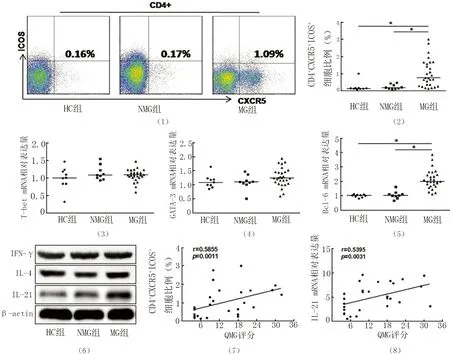
HC:正常胸腺组,NMG:未合并重症肌无力的胸腺增生组,MG:重症肌无力组,图2~6、图9~11同
图1 流式细胞术检测各组胸腺Tfh细胞比例
图2 各组胸腺Tfh细胞比例检测结果分析(*P<0.01)
图3 各组胸腺T-bet mRNA相对表达水平比较
图4 各组胸腺GATA-3 mRNA相对表达水平比较
图5 各组胸腺Bcl-6 mRNA相对表达水平比较(*P<0.01)
IFN-γ:干扰素γ,IL-4:白细胞介素4,图16同
图6 Western-Blot检测各组胸腺组织中IFN-γ、IL-4、IL-21的相对表达水平
图7 MG患者胸腺Tfh细胞比例和QMG评分的相关性分析
图8 MG患者胸腺IL-21 mRNA表达相对水平和QMG评分的相关性分析
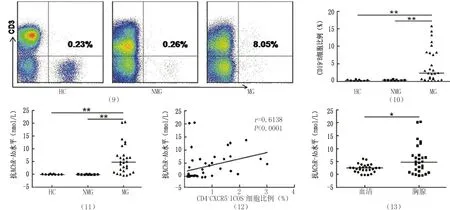
图9 流式细胞术检测各组胸腺中B细胞比例
图10 各组胸腺中B细胞比例比较(**P<0.01)
AChR-Ab:乙酰胆碱受体抗体,图12、13、16同
图11 各实验组胸腺中抗AChR-Ab滴度比较(**P<0.01)
图12 MG患者胸腺中Tfh细胞和抗AChR-Ab滴度的相关性分析
图13 MG患者血清和胸腺中抗AChR-Ab滴度比较(*P<0.05)
2.2 各组胸腺B细胞比例及抗AChR-Ab水平 MG患者胸腺中B细胞比例较对照组显著增高(P<0.01),而正常胸腺组和NMG组之间比较无统计学差异(P>0.05)。MG患者胸腺中抗AChR-Ab滴度较对照组显著增高(P<0.01),且较MG患者血清中AChR-Ab滴度增高(P<0.05);MG患者胸腺中AChR-Ab滴度与胸腺中Tfh细胞比例呈正相关(P<0.01)。结果见图9~13。
2.3 胸腺生发中心Tfh和B细胞相互作用 HE和多标免疫荧光染色发现MG患者增生的胸腺中存在异位生发中心,而正常人胸腺中无生发中心结构;MG患者胸腺生发中心中Tfh细胞与B细胞之间存在共定位(图14、15)。
2.4 MG患者胸腺细胞体外培养上清液IL-21和抗AChR-Ab水平 MG患者胸腺Tfh细胞和B细胞共培养可产生大量的IL-21和抗AChR-Ab,经IL-21中和抗体阻断Tfh细胞作用后抗体滴度明显下降(图16)。
3 讨论
胸腺异常在MG的发病机制中具有重要作用[7]。多项研究证实MG患者胸腺中具有表达AChR的肌样细胞,抗原提呈细胞-滤泡树突状细 胞,参与自身反应的T、B细胞及T-B细胞相互作用的场所——异位生发中心,具备了针对AChR异常免疫反应的必须条件,但抗体产生的始动机制尚不明确。
Tfh细胞是近期发现的Th细胞亚群,主要在辅助B细胞促进病理性自身抗体产生中发挥重要作用[4],但迄今为止,Tfh细胞在MG患者胸腺中的表达及作用机制尚不明确。该研究发现,MG患者增生的胸腺中Tfh细胞比例较健康对照和单纯胸腺瘤组增高,且与患者疾病严重程度呈正相关。Bcl-6是Tfh细胞特异性的转录因子,负责Tfh细胞的分化和增殖,是Tfh细胞区别于Th1、Th2和Th17细胞的标志物[8]。IL-21是Tfh细胞特异性的细胞因子,在Tfh细胞发育及胸腺生发中心B细胞的活化和存活中发挥重要作用。该研究结果显示,MG患者胸腺中Bcl-6和IL-21表达水平均较健康对照和单纯胸腺瘤组增高,而Th1和Th2细胞的特异性转录因子T-bet、GATA-3和细胞因子IFN-γ、IL-4在各组之间比较差异无统计学意义,提示MG患者胸腺中发挥主要作用的是Tfh细胞而并非Th1和Th2细胞。
B细胞产生抗体需要Th细胞的辅助。既往研究认为Th2细胞通过其分泌的细胞因子IL-4作用于B细胞,辅助B细胞增殖及抗体类别转换[9]。但IL-4缺陷的小鼠仍然能够产生T细胞依赖的抗体[10],因此提示其他Th细胞同样具有辅助B细胞产生抗体的作用。2008年King等[11]研究证实了Tfh细胞在辅助B细胞产生抗体的过程中发挥核心作用,但Tfh细胞在MG发病中的作用和机制尚不明确。该研究通过免疫荧光染色法观察到在MG患者增生的胸腺中存在异位生发中心。生理性的生发中心存在于二级淋巴器官,但在类风湿关节炎患者的关节滑膜组织、系统性红斑狼疮患者的脊髓及MG患者的胸腺中均发现存在异位生发中心,是自身免疫性疾病的特征性标志[12]。然而MG患者胸腺中异位生发中心形成的启动机制尚不明确。本研究发现MG患者胸腺的异位生发中心中Tfh细胞和B细胞明显增多,并存在共定位,提示MG患者胸腺中Tfh细胞和B细胞存在相互作用可能促进异位生发中心形成。生发中心是T-B细胞相互作用产生抗体的场所。因此,作者推测在MG患者胸腺中Tfh细胞参与了辅助B细胞产生抗AChR-Ab的过程。为了进一步研究Tfh/B细胞相互作用的效应机制,本研究从MG患者增生的胸腺和健康人胸腺中分别分离出Tfh细胞和B细胞进行共培养,通过对共培养上清的检测发现MG患者Tfh细胞可分泌出大量的IL-21,提示Tfh细胞发挥其效应需要IL-21的参与;MG患者胸腺中B细胞与MG患者或健康人Tfh细胞共培养均可以产生高浓度的抗AChR-Ab,进一步表明Tfh细胞的作用是辅助B细胞产生抗体;通过向培养体系中加入IL-21中和抗体阻断IL-21的作用后抗AChR-Ab滴度明显下降。以上结果表明MG患者胸腺中Tfh细胞通过IL-21作用于B细胞诱导自身抗体产生,部分阐明了MG患者胸腺中异常免疫反应的病理机制。

A:MG患者增生的胸腺中胸腺正常组织结构存在,可见胸腺小叶,并有多发的异位生发中心;B:MG患者胸腺中异位生发中心(GC)周围可见Hassall’s小体;C:健康人胸腺
图14 胸腺HE染色结果
A:MG患者胸腺中可见由T细胞、B细胞及树突状细胞构成的异位生发中心;B:健康人胸腺;C:MG患者胸腺异位生发中心存在大量Tfh细胞;D:MG患者胸腺生发中心存在大量B细胞;E~F:MG患者胸腺生发中心Tfh细胞和B细胞之间存在共定位(图F为图E方框部分的放大图)
图15 胸腺免疫荧光染色结果

图16 MG患者胸腺细胞体外培养上清液IL-21(A)和抗AChR-Ab(B)水平比较
综上所述,本研究证实了Tfh参与了MG患者的病理过程,且其主要作用是辅助B细胞在MG患者胸腺中形成异位生发中心,并促进自身抗体产生,提示通过研究Tfh细胞和B细胞之间的相互作用可能为治疗MG提供新的作用靶点。
[1]Berrih-Aknin S,Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms[J]. J Autoimmun,2014,52(8):90-100.
[2]Marx A,Pfister F,Schalke B,et al. The different roles of the thymus in the pathogenesis of the various myasthenia gravis subtypes[J]. Autoimmun Rev,2013,12(9):875-884.
[3]Spillane J,Hayward M,Hirsch NP, et al. Thymectomy: role in the treatment of myasthenia gravis[J]. J Neurol,2013,260(7): 1798-1801.
[4]Tangye SG,Ma CS,Brink R,et al. The good, the bad and the ugly-TFH cells in human health and disease[J]. Nat Rev Immunol,2013,13(6): 412-426.
[5]Ma CS,Deenick EK. Human T follicular helper (Tfh) cells and disease[J]. Immunol Cell Biol,2014,92(1): 64-71.
[6]Jaretzki A 3rd,Barohn RJ,Ernstoff RM,et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America[J]. Ann Thorac Surg,2000,70(1): 327-334.
[7]Le Panse R,Bismuth J,Cizeron-Clairac G,et al. Thymic remodeling associated with hyperplasia in myasthenia gravis[J]. Autoimmunity,2010,43(5-6):401-412.
[8]Yu D,Rao S,Tsai LM, et al. The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment[J]. Immunity,2009,31(3): 457-468.
[9]Link J,Navikas V,Yu M, et al. Augmented interferon-gamma,interleukin-4 and transforming growth factor-beta mRNA expression in blood mononuclear cells in myasthenia gravis[J]. J Neuroimmunol,1994,51(2):185-192.
[10]Kopf M, Le Gros G,Coyle AJ, et al. Immune responses of IL-4, IL-5, IL-6 deficient mice[J]. Immunol Rev,1995,148(12): 45-69.
[11]King C,Tangye SG,Mackay CR. T follicular helper (TFH) cells in normal and dysregulated immune responses[J]. Annu Rev Immunol,2008,26(4):741-766.
[12]Weyand CM,Kurtin PJ,Goronzy JJ. Ectopic lymphoid organogenesis:a fast track for autoimmunity[J]. Am J Pathol,2001,159(3):787-793.
(本文编辑:时秋宽)
The role of intrathymic Tfh cells in myasthenia gravis
ZHANGXiaoyan,CHANGTing,LIUShasha,YANGKun,LIZhuyi*.
*DepartmentofNeurology,TangduHospital,TheFourthMilitaryMedicalUniversity,Xi’anShaanxi710038,China
Li Zhuyi, Email: lizhuyi@fmmu.edu.cn
Objective To study the role of T follicular helper (Tfh)cells in the pathogenesis of myasthenia gravis(MG).Methods Twenty-eight MG patients were recruited in our study. Non-MG-associated thymic hyperplasia (NMG) and non-thymic abnormal congenital heart disease patients were used as controls. The frequencies of Tfh cells and B cells in thymocytes were detected via flow cytometry. The transcription factor T-bet, GATA-3 and Bcl-6 mRNA expressions in thymocytes were detected with Reverse Transcription-Polymerase Chain Reaction(RT-PCR). Cytokines interferon γ(IFN-γ), interleukin-4(IL-4) and interleukin-21(IL-21) in thymocytes were measured by Western-Blotting. Anti-human acetylcholine receptor (AChR) antibody in the serum or thymic tissue homogenate supernatant was assayed using the radioimmunoprecipitation method(RIA).CD4, CD19, CD35, CXCR5 in the thymus were observed by hematoxylin-eosin(HE) and immunofluorescence staining. CD19+B cells and CD4+CXCR5+T cells were isolated from thymus using immunomagnetic sorting method and were co-cultured. The IL-21 and anti-AChR antibody secretions in co-culture supernatant were detected after 7 days. Results The frequency of Tfh cells and B cells increased significantly in thymocytes of MG patients compared with NMG and HC, and Tfh cells counts positively correlated with disease severity. Tfh cell-associated transcription factors Bcl-6 mRNA and cytokines IL-21 expression were enhanced in the thymocytes of MG patients. Germinal center structure was observed in MG thymus through HE and immunofluorescence staining, which was not observed in the control group. Tfh cells and B cells co-localized in the germinal center of the MG thymus. High level of IL-21 and anti-AChR antibody concentrations were detected in the co-culture of patients Tfh and B cells but the autoantibody titers decreased dramatically by the presence of anti-IL-21 antibodies. Conclusions The enhanced frequency of Tfh cell was involved in the pathological process of MG, and increased its severity probably via accelerated AChR antibody production in thymus.
T-lymphocytes,helper-inducer; myasthenia gravis; thymic hyperlasia; germinal centers; receptors,cholinergic; antibodies
10.3969/j.issn.1006-2963.2015.05.002
国家自然科学基金资助项目(31270952)
730050 兰州军区兰州总医院神经内科(张晓燕);710038第四军医大学唐都医院神经内科(常婷、刘沙沙、李柱一);710032第四军医大学免疫教研室(杨琨)
李柱一,Email: lizhuyi@fmmu.edu.cn
R746.1
A
1006-2963 (2015)05-0309-06
2015-05-04)

