利用EBV转化单板滑雪U型场地运动员外周B淋巴细胞建立永生化细胞株的研究
赵玉华++刘宇++赵晨琼++朱宝峰++刘冬
摘要:运动基因资源作为人类遗传资源的一部分,为优秀运动员的选拔提供遗传证据。本研究以我国优秀单板滑雪U型场地运动员为实验对象,通过转化由B958细胞培养得到EBV,运用悬浮培养法,提取及保存优秀运动员基因组DNA,成功建立了运动员外周血B细胞永生细胞库,永久保存了我国该项目优秀运动员遗传资源,为以后该项目优秀运动员运动基因的相关研究提供实验材料,为其它雪上项目优秀运动员的永生细胞库的建立提供了理论支持。
关键词:单板滑雪U型场地运动员;永生化;细胞体外培养
中图分类号:G804 文献标识码:A 文章编号:1008-2808(2015) 02-0083-04Abstract:Movement of genetic resources is the part of the human genetic resources, geneticevidence for excellent athletes' selection. This study to our country outstanding athlete snow-boarding halfpipe ground as experimental object, through the transformation from EBV B958cell culture, using the method of suspension culture, extraction and preserve the genomicDNA of excellent athletes, athletes successfully established peripheral B cells immortality li-brary, permanent saved the project the genetic resources of excellent athletes in our country,for the project of excellent athletes sport gene related research provides experimental materi-als, excellent athletes for other snow project of building provides the theoretical support ofthe living cell bank.
Key words:Snowboarding halfpipe athletes; Immortalization, Cells invitro
随着人类基因组计划的完成和分子生物学技术的快速发展,人们越来越重视遗传资源的保存,特别是人类遗传资源的保存[1]。人类遗传资源是指含有人体基因组、基因及其产物的器官、组织、细胞、血液、制备物、重组脱氧核糖核酸(DNA)构建体等遗传材料及相关的信息资料。运动基因遗传资源作为人类遗传资源的一部分,为优秀运动员的选拔提供遗传证据。运动基因遗传资源与运动能力的开发有着密切的联系[2],血管紧张素I转化酶(ACE)是决定人体有氧耐力素质的关键因素之一,影响人体有氧耐力素质的最佳水平,同时影响人体对耐力训练的敏感度[3]。对人体生理特性的研究显示[4],部分运动相关基因如ACTN3基因多态性与肌肉质量和力量相关联,随着人类基因组计划的完善,越来越多的运动基因被发现,对其功能的研究也将更加深入[5]。
运动员群体有别于普通大众的群体,优秀运动员的运动基因更是非常珍贵。我国已经采集优秀运动员刘翔和姚明的遗传资源,即便这些优秀运动员以后退役,科研人员还是可以根据他们保存下来的遗传资源进行研究。随着北京申办2022年冬奥会,冬季项目在竞技体育中地位将显著提升,更多的科研力量将汇聚于冬季项目的研究。根据单板滑雪U型场地技巧(以下简称U型槽)在国际和国内的发展趋势,该项目必然会成为我国冬季雪上项目的优势项目,尤其该项目现役优秀运动员是这个项目发展的第一代运动员,如蔡雪桐、刘佳宇、李爽、史万成等运动员先后在世界杯、世锦赛都获得冠军,也有望冲击冬奥会的奖牌,将这些运动员的运动基因保存下来为未来研究该项目将具有重要意义。本研究将用EBV病毒转化B淋巴细胞使之成为永生化细胞株,建立U型槽运动员的永生细胞库,保存U型槽优秀运动员的运动基因,为该项目运动员的基因选材,运动能力的开发提供科学和现实依据,为我国其它雪上项目运动员保存和建立永生化细胞提供理论技术基础,为构建我国冬季项目优秀运动员基因库贡献一份力量。
1 实验对象与方法
1.1 实验对象
我国优秀U型槽运动员20人,10名男运动员,10名女运动员,包括获得世锦赛冠军的女运动员蔡雪桐以及优秀运动员李爽、刘佳宇、史万成等,所有运动员均为国家一级运动员。
1.2 主要试剂
1N NaOH(4℃保存备用),1N Hepes(4℃保存备用),0.2M L-Giutamine(-20℃保存备用),RP-MI1640基础培养基(4℃保存备用),RPMI1640全培养基(4℃保存备用),95%FBS+5%DMSO冻存液,CyA的制备(-20℃保存备用),血清的灭活,PHA的制备(-20℃保存备用),含PHA的RP-MI1640全培养基(4℃保存备用),B958原代细胞株(中科院遗传与发育所馈赠)。
1.3 主要的仪器及设备
DL-CJ-2N高性能无菌实验台(中国哈尔滨东联电子技术开发有限公司),TDL-40B水平离心机,IX-71倒置相差显微镜,AR1530/C电子天平,37.5℃5%CO,培养箱(德国Heraeus公司),电热恒温水浴锅,Pall超纯水仪,血球计数板,液氮贮存器,超低温冰箱,电动移液器,培养板。endprint
1.4 实验方法
1.4.1 EBV的制备在40℃水浴锅中解冻冻存的B958细胞。将解冻的B958细胞移至装有6mlRPMI1640全培养基的25?培养瓶中,放在37.5℃、5%CO?,培养箱中培养。培养基颜色变成褐黄色时,补充等量的新鲜培养基,继续培养。当细胞达到约3×105/瓶时,可进行传代。将细胞充分摇匀后,等量分别装于2个25?培养瓶内,并向瓶内添加适量新鲜培养基,继续培养。冻存细胞前1天,向培养瓶中加入适量的新鲜培养基;用15ml离心管收集B958细胞,在常温下离心(1500rpm)15min,去上清;用冻存液重悬细胞,调整细胞密度为1×106-3×106细胞/ml,以1ml/管将细胞悬液分装于冻存管中;将冻存管置于冰箱(4℃)30min,放人装有异丙醇的程序降温盒中于-80℃冰箱过夜,投入液氮罐内长期保存。将EBV溶液置于- 80℃冰箱lOmin,随后用37℃水浴冻融,反复操作3次。1800rpm离心15min,用0.22μm滤膜过滤,分装后用-80℃保存备用。
1.4.2 转化实验 用带有肝素钠的一次性抽血管,抽取运动员静脉血4ml/人(血样常温静止放置1~2天)。用加1%的双抗RPMI1640基础培养基,稀释运动员血液,淋巴细胞分离液预热(37.5℃水浴锅),沿管壁渐渐加入4ml淋巴细胞分离液,3000rpm离心10min,使血液分层。将血清下层、红细胞上层的成杨絮状的白膜层,用巴氏管移人装有6ml RPMI1640培养基的离心管中,lOOOrpm离心10min。弃上清液,加入10ml RP-MI1640培养基,1000rm离心10min,弃上清液。重复一次后,弃去上清液,将细胞敲匀待用;将2ml含PHA的全培养基、1.4ml EB病毒、0.4ml CyA以及收集到的白细胞做成混合液,共约4ml;将混合液加入到24孔培养板中,每孔1ml,将24孔培养板置于37.5℃,5%CO,培养箱中培养。
1.4.3 永生化细胞系的培养及冻存永生化细胞从24孔板转移到25m2的培养瓶中继续培养;3~4天进行一次半量换液,每次半量换液就是一次细胞传代。细胞的冻存,收集细胞悬液,1000rm离心lOmin,弃上清。在离心管中放人预定量的冻存液,将细胞轻轻打匀,调整细胞密度为1×106/ml~3×l06/ml,将冻存液分别放到冻存管中,每管1ml。将冻存管放在4℃冰箱30mim,然后于- 80℃的冰箱内过夜后,放人液氮罐中保存。
2 实验结果
EBV转化后的淋巴细胞体外培养稳定,成功建立U型槽运动员永生化细胞库。传代培养的淋巴细胞生长速度要快于转化后原代培养的淋巴细胞,一般3~4天传代。细胞呈形态个分散或者较小的细胞团状,细胞密度底,在显微镜下细胞折光性强。培养3天左右,单个淋巴细胞或较小的淋巴细胞团能聚集生长成较大的淋巴细胞团,细胞密度达到70%~80%;肉眼能见到细沙粒状物铺满培养瓶底部,轻轻摇动培养瓶,就会上浮,培养基的颜色从最初的粉色变为黄色,PH值基本不变;在显微镜下能看到细胞团有“长根”“长毛”“分刺叉”的现象,细胞团发育良好。在传代培养过程中,细胞形态一致,各代次淋巴细胞增殖速度稳定,没有发现随着传代次数的增加而出现淋巴细胞衰老、死亡等现象。
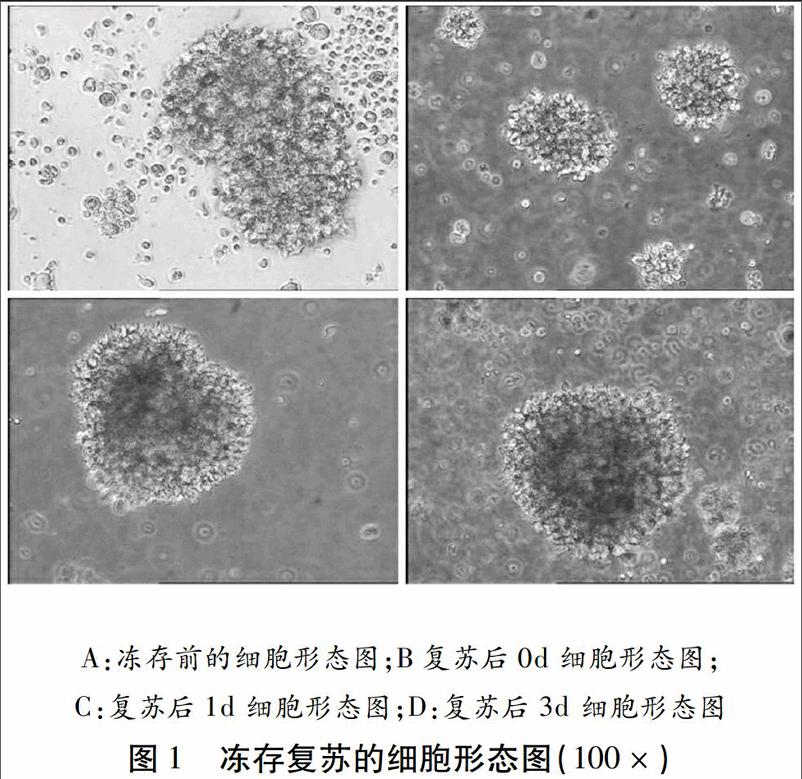
当淋巴细胞团体积增大,细胞的密度达到1×106/ml的时进行冻存(图1A);刚复苏的淋巴细胞部分呈较小的团状,部分呈单个分散状(图1B);培养1天后,淋巴细胞增殖迅速,细胞团体积明显增大(图1C);培养3天后,形成的细胞团数量大量增加,体积较大,显微镜下能发现葡萄球串状细胞团,折光性强,密度可达70%~80%,可进行传代(图1D)。
3 讨论
在实践中,EBV转化B淋巴细胞使其永生化已有诸多应用,如杨静[6]、褚嘉祐[7]等。永生细胞株的建立能永久保存优秀运动员的基因,讨论各运动项群的同异点,在各运动项群中探索抑制运动能力基因的分布、特征学意义、及建立与耐力、力量、速度性相关的项群体系细胞库[8]、基因探针、基因兴奋剂等众多体育科研领域提供大量的细胞和遗传物质[9],所以从发展的角度来看,建立优秀运动员的永生细胞库必将得到越来越多的关注。
EBV来源于EBV感染的绒猴外周血淋巴细胞所产生的B958细胞系,B958细胞的培养是决定EBV质量的关键[10]。因此,在培养B958细胞以及转化后的永生细胞的培养过程中,应该特别注意。
3.1 细胞污染
为了保证细胞培养T作的顺利进行,第一个极为重要的环节就是防止污染[11]。因此,必须清洗与消毒培养用具,以及培养用的各种玻璃器皿(离心管、培养瓶、吸管等)都需要用清水浸泡,刷洗、酸浸和冲洗,并用6. 81kg(15LBS)高压消毒20min等。清洗器皿必须干净透明,无油迹,没有任何残留物质,如某些化学物质仅1/104mg,也可能对细胞产生毒性。
在每次操作前都要用30W紫外线管灯消毒超净台20~30min,用0.2010新吉尔灭擦手以及相关器皿。最后当B958细胞释放出的EBV后,仍然需要对EBV进行一次抽滤,滤器直径选择0.2μm,以达到除掉细菌和支原体,避免EBV的污染。
3.2 细胞换液
B958细胞和永生化细胞大多数会悬浮在培养液中,所以在每次换液过程中,细胞培养瓶从培养箱中转移到无菌操作台上一定要轻拿轻放,尽可能的使细胞沉淀在瓶底,减少在培养液中的悬浮。用移液管沿培养液液面吸出变黄的培养液;最后再将需要的新鲜培养液用移液管注入培养瓶中。细胞培养是系统化过程,根据细胞生长的情况来安排,一般每周对细胞进行2次换液,保证充足的营养。在冻存细胞的前一天,要进行少量换液,保证冻存时有足够的营养物质消耗。
3.3 温度
B958细胞和永生化细胞培养的最适温度是37.5℃,温度过高或过低都会影响细胞的代谢与生长,甚至导致细胞的死亡[12]。虽然细胞在5%CO2、37.5℃培养箱中培养,在由于在实验过程中要进行培养箱外进行观察、传代、冻存等操作,因此要求培养箱内外温差不能过大,细胞离开培养箱时间不能过久,如无菌操作台,倒置显微镜等常用仪器和培养箱的距离尽量接近,可减少细胞污染的几率。endprint
3.4 血清的使用
血清是B958细胞的培养的重要因素之一。在使用血清前先用56℃热灭活30min,消除皿清中原有活性因子。一般血清过多对其生长没有好处,因此用低浓度的血清培养液,尽量使培养条件标准化,实验重复性提高,降低成本,减轻血清有害成分的影响。
在EBV对B淋巴细胞进行永生化时,须用高质量、高营养的血清为培养细胞提供营养,在多次预实验后,GIBCO公司的美国血缘的特级胎牛血清符合要求。在成功转化B淋巴细胞后,类淋巴母细胞数量培养到可以转入培养瓶中,细胞降低对血清的依赖,考虑到实验经费,采用BIOCHROMAG公司生产的德国血缘优级血清,培养效果不变。
3.5 pH值
培养液的pH值对B958细胞和EBV转化后的淋巴细胞也是非常重要的[13],最佳生长环境是pH=7.0。在实验中,细胞换液、传代、冻存等过程中培养瓶会被打开,放出瓶内的C02,培养液pH值升高,一段时间后会导致细胞碱中毒。因此,实验过程中,操作速度要快,操作完毕后最快的放人培养箱中,稍微拧开瓶盖,继续培养。我们用含有肝素钠的采血管采血.也是因为肝素钠的pH值与人类血液的pH值相近,不会影响血液中B淋巴细胞的转化。
3.6 冻存
建立永生化基因库的重要环节之一就是细胞冻存。细胞冻存的最佳温度就是液氮温度(-196℃)。因为在- 196℃时,细胞生命活动几乎停止,而复苏后细胞结构和功能完好。当细胞密度达到1×106/ml的时便可冻存,永生细胞株冻存与其它细胞相同,尽量在代次小时进行冻存。B958细胞与永生化细胞的冻存要慢冻速溶,先将细胞在一80 ℃冰箱中冷冻,然后移到液氮中长时间保存。
在冻存过程中,为减少二甲基亚砜对细胞的毒性,使其较快的渗入细胞内,使细胞内外产生一定的浓度差,降低细胞内外未结冰溶液中电解质的浓度,使细胞内外达到平衡起到保护作用[14]。应先将冻存管置于4℃冰箱30min,然后放人装有异丙醇的程序降温盒中于-80℃冰箱过夜,投入液氮罐内长期保存。
3.7 CyA的使用
在转化细胞时CyA用量很小,但作用很大,它能够有效地抑制T淋巴细胞自身免疫攻击,安全转化B细胞,同时配合PHA的使用能更好的促进B淋巴细胞的生长,切记不能过量使用,否则会对细胞造成伤害[15]。在试验使用中,配置CyA的浓度为200μg/ml,且其物理性质呈油状,在用枪头吸取CyA母液时常常会附着在枪头一部分,如果配置工作液少时就会出现CyA浓度过高的现象,影响B淋巴细胞的转化。所以要尽可能避免枪头附着试剂,并尽可能多的制备其工作液。
3.8 废液的无害化处理
在从永生化细胞培养液中移出的废液,以及接触过永生化细胞、B958细胞和EBV病毒的仪器设备,都要经过1%浓度的PAA浸泡24h,避免留下有害物质[16]。
4 结论与建议
本研究成功的提取和保存了我国优秀的U型槽运动员基因组DNA,完成了B淋巴细胞进行转化、培养、传代的技术体系,永久保存了我国优秀U型槽运动员的遗传资源,为优秀运动员基因相关研究提供实验材料,为日后其它雪上项目优秀运动员运动基因的保存等提供理论技术基础。对运动员的运动基因的研究将是未来发展的一个趋势,建议尽早的建立和保存优秀运动员的运动基因,进一步补充和完善我国冬季项目优秀运动员的永生细胞库,为冬季项目未来的发展贡献力量。
参考文献:
[1] 周旭东.基因保存技术研究进展[J].浙江预防医学,2007,19(3):59-60.
[2] 常芸,何子红.运动能力相关基因研究进展[J].中国运动医学杂志2002,21(2):173.
[3] 张翠苹,张宏伟,基因工程与奥林匹克运动[J].体育学刊,2005,12(5):9-11.
[4] 李丽,赵玉华.遗传因素在速度滑冰运动员选材中的应用[J].哈尔滨体育学院学报,2010,28 (5):20-22.
[5] 张明伟,于晓姚,郭子宽,等.体外长期培养对人骨髓间充质干细胞生物学特性的影响[J].组织工程与重建外科杂志,2005,2(1):51-53.
[6] 杨静,唐发清.EB病毒介导的鼻咽上皮细胞永生化早期阶段的生物学观察[J].中国病理生理杂志,2000,16(10):1033.
[7] 褚嘉秸,徐玖瑾.中华民族永生细胞库的建立[J].国际遗传学杂志,2008,31(4):241 -247
[8] 史晓红,杨泽,等.长寿老人永生细胞库的建立与保存[J].中国老年学杂志,2003,2(23):74-76.
[9] 崔东红,张伟.正常人体淋巴细cDNA文库的构建[J].Hereditas( Beijing),2002,24(2):143-145.
[10] 杨彦春,贾骏,王捍国.细胞衰老和永生化[J].遵义医学院学报,2002,25 (6):568-570.
[11] 王新文.人类细胞永生化的研究进展[J].牙体牙髓牙周病学杂志,2003,13 (4):233-236.
[12] 杨娜娜,王娟.细胞永生化的研究进展[J].中国畜牧兽医,2004,32(1):37-39.
[13] Rickinson A B, Kieff E.Epstein-Barr Virus[M].In; Fields B N,Knipe D M,and HowleyP M, Fields Virology,3rd ed. Philadelphia;Lippincott-Raven Publishers,1996:2397-2446.
[14] 裴丽君.EB病毒转化人类外周血B-淋巴细胞建立永生细胞系[J].中国生育健康杂志,2003 ,14(3):186-188.
[15] jagerM, PrangN, MittererM, et al. Pathogenesisof chronic Epstein-Barr virus infection: de-tection of a virus strain with a high rate of lyt-ic replication[J]. Br J Haematol, 1996, 95(4):626.
[16] Maruo S,Yang L,Takada K.[J].J Gen Vir-01,2001,82(Ptl0):2373-2383.endprint

