热处理豆粕饲喂生长猪的氨基酸消化率
González-Vega J C, Kim B G, Htoo J K,Lemme A,Stein H H
(伊利诺斯州立大学动物科学系,乌尔班纳市 61801)
生大豆含有多种抗营养因子,热处理能改善大豆和豆粕的营养价值,因为热处理能使蛋白变性,破坏蛋白酶抑制因子及生大豆中可能存在的其 他 抗 营 养 因 子 (Goebel 和 Stein,2011;Purushotham等,2007)。然而,过热处理会导致氨基酸被破坏,并产生不能被生物利用的美拉德反应产物(Pahm等,2008)。美拉德反应是氨基酸的氨基和还原糖的缩合反应,在所有氨基酸中赖氨酸是最易发生美拉德反应的氨基酸,因为它含有一个暴露在外的ε-氨基,能与还原糖的羧基相结合(Pahm等,2008)。这个反应的缩合产物转变成希夫碱,经葡糖胺重排形成1-胺基-1去氧-2酮糖化合物。1-胺基-1去氧-2酮糖化合物是早期美拉德反应不能被测定的赖氨酸基团的主要存在形式(Hurrel和 Carpenter,1981)。过热处理豆粕会产生美拉德反应高级产物,如类黑素前体,它能与其他氨基酸反应,从而使这些氨基酸不能被生物利用。因此,热处理的方式和程度能影响豆粕的氨基酸表观回肠消化率(AID)(Chang 等,1987)。然而,关于热处理时间是如何影响豆粕的氨基酸表观回肠消化率(AID)和标准回肠消化率(SID)鲜见报道。因此,本试验的目的是测定豆粕热处理方式和时间是否会影响生长猪的氨基酸表观回肠消化率和标准回肠消化率。
1 材料和方法
本试验方法通过伊利诺伊大学试验动物保护委员会的评审和批准。本试验使用的猪为长白猪(3/4)×大白猪(1/4)的杂交阉公猪。
1.1 试验动物 选择初始体重为(25.3±2.0)kg的10头阉公猪。采用Stein等(1998)所述的方法分别在试验猪只的回肠末端安装一个T-型瘘管。采用5×5拉丁方试验设计,将试验猪随机分成5个处理组,采用基于电子数据表程序来平衡潜在的残差效应。每个拉丁方有5种日粮,5个周期。每只试验猪分别圈养在1.2 m×1.5 m的猪栏里,猪舍内安装空调。猪栏为全漏缝钢筋地板,每栏安装一个饲喂器和一个乳头式饮水器。
1.2 日粮和饲喂方法 常规去壳豆粕被分成4组,一组不经过热处理,另外3组分别在125℃高压蒸汽处理15 min,125℃高压蒸汽处理30 min,125℃烘箱处理30 min(表1)。制定5种日粮配方 (表2和表3)。4组豆粕分别用于一种玉米淀粉-豆粕型日粮配方中,作为该日粮唯一氨基酸来源,另外用无氮日粮来评估基础内源性蛋白和氨基酸损失量。日粮配方中的维生素和矿物质含量满足或超过目前生长猪需要量(NRC,1998),所有日粮添加0.4%氧化铬作标记物。
日粮提供3倍维持能量需要量(NRC,1998),在 08∶00 和 17∶00 时提供同等的日粮。 在每个试验周期开始时校正每头猪的饲料营养水平,每头试验猪进行称重并记录。整个试验周期内猪自由饮水。
1.3 样品采集 每个试验周期持续7 d。其中前5 d为预试期,第6、7天收集8 h的回肠食糜样品。用尼龙扎带将塑料袋扎在瘘管上,食糜流入塑料袋中被收集起来。每隔30 min收集并更换塑料袋,所有食糜样品保存于-20℃条件下,防止食糜中氨基酸被微生物降解。
1.4 测定指标及方法 试验结束时,回肠食糜样品在室温下解冻,混匀同一头猪的收集样品,用于化学分析。回肠食糜样品冻干后碾细用于化学分析。
测定所有试验日粮及食糜样品干物质含量(AOAC 方法 930.15,2007)和粗蛋白质含量(AOAC方法990.03,2007)。测定日粮和豆粕样品的灰分(AOAC方法942.05,2007)和酸水解乙醚提取物含量(AOAC方法954.02,2007)。分析所有样品氨基酸组成,用茚三酮柱前衍生,亮氨酸作内标(日立氨基酸分析仪L8800,日立高新技术美国有限公司,普莱森顿,加拿大)。分析之前,样品用6 mol/L的盐酸在110℃下水解 24 h(AOAC方法 982.30E,2007)。在水解之前,用冰甲酸氧化过夜,然后进行蛋氨酸和半胱氨酸分析,分别以蛋氨酸砜和磺基丙氨酸/半胱氨酸形式计。硝酸-高氯酸湿灰分样品制备(AOAC 方法 968.088D,2007)后,测定日粮和回肠食糜样品的铬含量,用电感耦合等离子体原子发射光谱法检测(AOAC方法990.08,2007)。
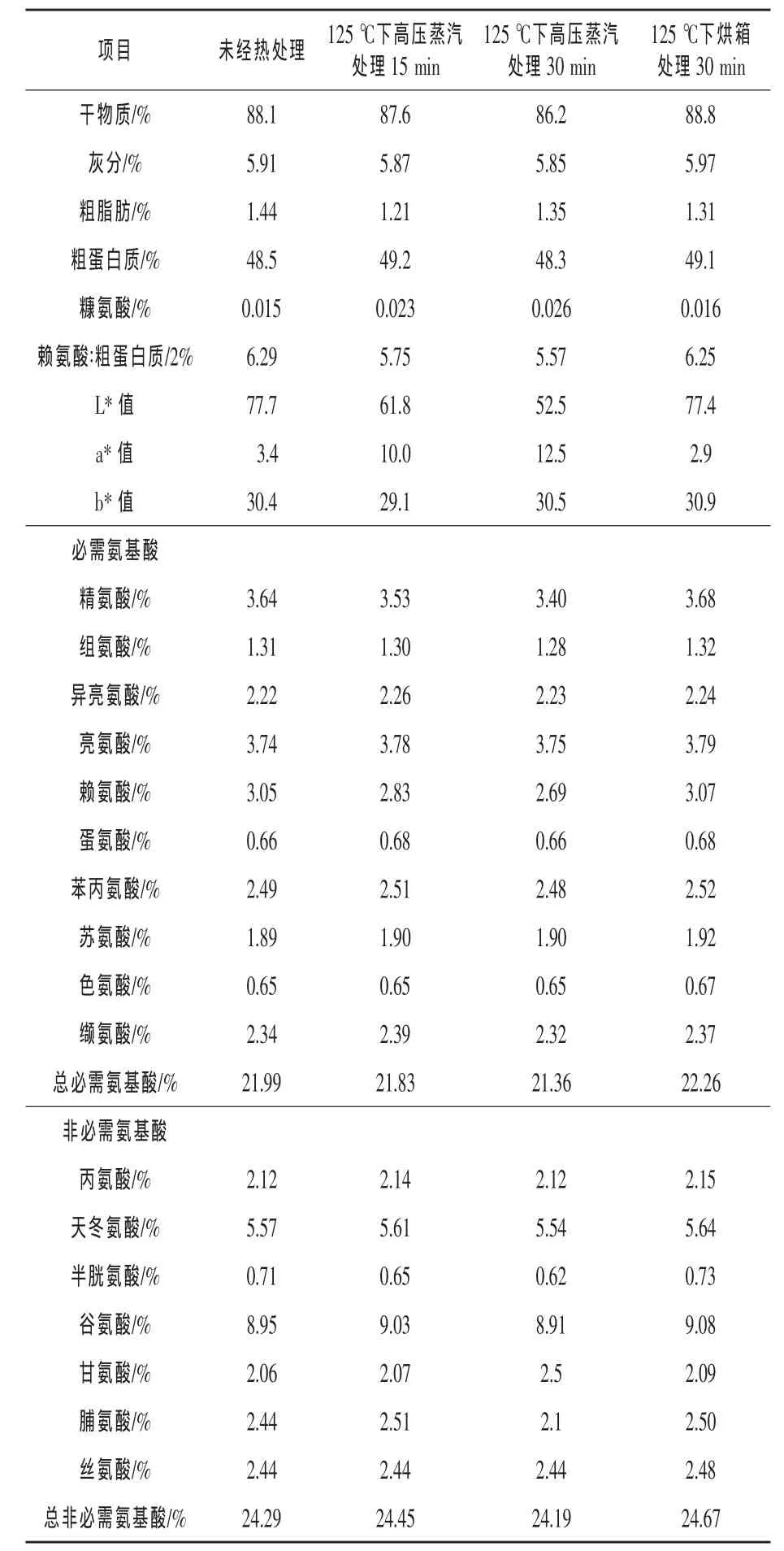
表1 热处理后豆粕的化学组成
糠氨酸含量分析,用6 mol/L盐酸水解,用反相高效液相色谱仪梯度洗脱进行分析 (0.1%三氟乙酸溶于去离子水作为流动相A;0.1%三氟乙酸溶于甲醇溶液作为流动相B)。用5个糠氨酸盐酸盐标准物作为外标法进行定量分析(Neo MPS,Neosystems实验室,斯特拉斯堡,法国)。
豆粕的颜色判定用L*值、a*值和b*值来描述(美国亨特利便携式测色仪45/0-L,美国亨特利公司,莱斯顿,维吉尼亚州),使用Holmer等(2009)所述方法用黑白色卡校准光谱色度计。
1.5 数据统计分析 计算每种豆粕的表观回肠消化率和标准回肠消化率(Stein等,2007)。用SAS进行数据统计分析。
2 结果与分析
由表1可知,所有豆粕的干物质、灰分和粗蛋白质含量相似,与豆粕的热处理方式无关。然而,未经热处理豆粕的精氨酸、赖氨酸和半胱氨酸含量分别为3.64%、3.05%和0.71%,而高压蒸汽处理15 min的豆粕的含量分别为3.53%、2.83%和0.65%,高压蒸汽处理30 min的豆粕的含量分别为3.40%、2.69%和0.62%。未经热处理的豆粕赖氨酸∶粗蛋白质比为6.29%,但是高压蒸汽处理15 min和30 min的豆粕的赖氨酸∶粗蛋白质比分别为5.75%和5.57%。未经处理的豆粕、高压蒸汽处理15 min和30 min的豆粕的L*值分别为 77.7、61.8和 52.5,a*值分别为 3.4、10.0和12.5。这些变化表明,高压蒸汽处理导致颜色更黑更红,且能通过样品感官评估观察得到。用烘箱处理的豆粕样品和未经热处理的样品的赖氨酸、半胱氨酸、糠氨酸、赖氨酸∶粗蛋白质比、L*和a*值相近。由表3可知,所有日粮配方的干物质、灰分和粗蛋白质含量相似。添加高压蒸汽处理30 min的豆粕日粮,其赖氨酸和半胱氨酸浓度分别为1.06%和0.24%,而添加其他处理豆粕的日粮赖氨酸含量为1.17%~1.19%,半胱氨酸含量为0.27%~0.28%。
豆粕的粗蛋白质表观回肠消化率和标准回肠消化率所有氨基酸含量都随着高压蒸汽处理时间的增加而呈线性下降(P<0.01)(表4和表5)。赖氨酸和天门冬氨酸含量降低的最显著。虽然烘箱烘干处理的豆粕和未经热处理的豆粕相比,其大多数氨基酸的表观回肠消化率和标准回肠消化率在数值上有降低,但在统计意义上均不显著。
3 讨论
未经热处理的豆粕营养组成和现有报道一致 (Baker 和 Stein,2009;Cervantes-Pahm 和Stein,2008)。本试验用高压蒸汽处理豆粕,其赖氨酸和半胱氨酸含量降低,这与Johannes等(2007)的研究结果一致,其研究报道,高压蒸汽处理大豆产品、玉米酒精糟可溶物(DDGS)和未经高温处理的样品,其赖氨酸和半胱氨酸含量均降低。高压蒸汽处理的豆粕样品精氨酸浓度降低,与加热处理的小麦DDGS数据一致,其精氨酸浓度也降低(Cozannet等,2010)。 然而,与 Johannes等(2007)结果一致,其他氨基酸浓度不受热处理的影响。研究表明,热处理蛋白源赖氨酸和半胱氨酸浓度会降低 (Karr-Lilienthal等,2005;Shirley 和 Parsons,2000)。 这些物质减少可能是由于美拉德反应,这与高压蒸汽处理豆粕颜色形成棕色一致。由于赖氨酸ε-氨基和还原糖的羟基发生反应,赖氨酸是受美拉德反应影响最大的氨基酸。半胱氨酸含量的降低可能是由于在美拉德反应中形成交联化合物(Gerrard,2002;VanBarneveld 等,1994a)。

表4 不同处理豆粕饲喂生长猪的粗蛋白质和氨基酸表观回肠消化率

表5 不同处理豆粕饲喂生长猪的粗蛋白质和氨基酸标准回肠消化率
未经热处理豆粕的多数氨基酸标准回肠消化率与先前的报道一致 (Goebel和Stein,2011;Kim等,2009;Cervantes-Pahm 和 Stein,2008)。 随着高压蒸汽处理时间的逐渐增加,豆粕中粗蛋白质和氨基酸的表观回肠消化率和标准回肠消化率均降低,这与 Moughan 和 Rutherfurd(1996)的报道一致,其报道指出乳糖和酪蛋白日粮经121℃高压蒸汽处理3.5 min,所有氨基酸的消化率降低。Martinez-Amezcua和Parsons(2007)研究发现,120℃高压蒸汽处理DDGS 45 min,家禽的氨基酸消化率降低。
美拉德反应后期,赖氨酸和其他氨基酸及蛋白质中的多肽链间会形成交联化合物,可能会降低蛋白水解酶的效率 (Martinez-Amezcua和Parsons,2007;Moughan 和 Rutherfurd,1996)。 美拉德反应期间,deoxyketosyl化合物继续形成褐色素或类黑素,这也可能是高压蒸汽豆粕能看出颜色变化的原因。类黑素可能由于空间位影响吸收,也可能会降低氨基酸和小肽的消化,最终导致氨基酸标准回肠消化率降低(Hurrell,1990)。
先前研究表明猪和家禽赖氨酸消化率降低是由于豆粕(Boucher等,2009a;Johannes等,2007)、玉米 DDGS (Boucher等,2009b;Pahm 等,2008)、紫花豌豆 (VanBarneveld 等,1994a、b)、 骨肉粉(Shirley 和 Parsons,2000)和鱼粉 (Boucher等,2009)等物质发生美拉德反应。100℃烘箱干燥的DDGS赖氨酸含量和消化率降低(Pahm等,2008;Martinez-Amezcua和 Parsons,2007)。 但本试验表明,125℃烘箱干燥30min对豆粕标准回肠可消化氨基酸的影响极小。烘箱干燥对DDGS和豆粕影响的差异可能是由于DDGS在生产过程中受到了热应激,DDGS中糖的含量比豆粕多(Johannes等,2007)。因此,饲料成分造成热损伤的温度读数不仅取决于加热方式和时间长短,也受原料本身的影响。的饲料原料本身决定。
高压蒸汽是结合压力、水分、高温,而烘箱干燥只有热处理一个因素。因此,高压蒸汽对表观回肠可消化氨基酸和标准回肠可消化氨基酸的影响比烘箱干燥造成的影响大,可能是由于高压蒸汽有压力和水分共同作用。高压条件下氨基酸稳定性差,湿度增加时,氨基酸的氨基团和葡萄糖之间的反应率增加 ((Qian等,1993;Schwartz和Lea,1952)。美拉德反应程度取决于水分活度、温度、pH、加热时间,以及底物的种类和可利用程度 (Jaeger等,2010;Rufián-Henaresetal等,2009)。中间水分含量,温度超过50℃,pH为4~7时是美拉德反应的最合适条件 (Guerra-Hernandez等,2001)。
棕褐色的形成是美拉德反应的指示剂 (类黑素),高压蒸汽处理的豆粕可见棕褐色。近来研究表明棕色与小麦DDGS标准回肠可消化赖氨酸的减少相关(Cozannetetal,2010)。 然而,烘箱干燥的豆粕呈淡黄色,表明没有形成美拉德反应产物(Hurrell,1990)。很有可能是烘箱中水分含量太低而不能形成美拉德反应产物。
糠氨酸是伴随着糠氨酸是葡糖胺化合物经酸水解后生成的产物。研究表明酸水解过程中,饲料组成32%的限制性赖氨酸转化为糠氨酸(Pahmetal,2008)。因此,如果可以检测饲料组成中糠氨酸含量,通过计算可能得到总限制性赖氨酸浓度(Pahm等,2008)。糠氨酸这一过程被广泛的应用在检测干燥奶产品热损伤中 (Gimenez等,2004),这个过程也被成功用于评估DDGS热损伤程度(Cozannet等,2010;Pahm 等,2008)。 研究表明,伴随着豆粕热损伤豆粕中糠氨酸浓度增加。本研究发现糠氨酸可以被用于评估豆粕热损伤。
饲料的热损伤程度也可以通过计算赖氨酸∶粗蛋白质比值来评估,因为样品受热损伤,赖氨酸浓度降低,而蛋白浓度未降低 (Stein等,2009)。随着高压蒸汽时间增加,豆粕中赖氨酸∶粗蛋白质值降低,然而,烘箱干燥豆粕的赖氨酸∶粗蛋白质与未经热处理豆粕相似。这项发现进一步表明高压蒸汽样品可造成热损伤,而烘箱干燥样品则不会造成热损伤。因此,赖氨酸∶粗蛋白质比值支持利用糠氨酸和颜色判定结果。赖氨酸∶粗蛋白质降低的研究曾被报道在受热损伤的DDGS 中(Stein 等,2009;Cozannet等,2010)。 本次研究发现豆粕受热损伤后赖氨酸∶粗蛋白质降低。因此,如果豆粕受热损伤,计算赖氨酸∶粗蛋白质是一个快速、可靠的评判方法,并且该方法也可被用于豆粕粉碎工厂和饲料厂来评价豆粕质量。
4 小结
125℃高压蒸汽处理为豆粕提供了水和压力,降低了样品中精氨酸、赖氨酸、半胱氨酸的浓度和氨基酸表观回肠消化率和标准回肠消化率。增加高压蒸汽处理时间其副作用更大。相比之下,125℃烘箱干燥30 min不会降低豆粕中氨基酸浓度和消化率。因此,应选择最佳的热处理方式来防止豆粕的氨基酸消化率降低。颜色、糠氨酸浓度、赖氨酸∶粗蛋白质等指标可以用来评估豆粕受热损伤的程度。
[1]Baker K M,Stein H H.Amino acid digestibility and concentration of digestibleand metabolizable energy in soybean meal produced from high protein or low oligosaccharide varieties of soybeans and fed to growing pigs[J].Journal of Animal Science,2009,87:2282 ~ 2290.
[2]Boucher S E,Calsamiglia S,Parsons C M,et al.Intestinal digestibility of amino acids in rumen undegradable protein estimated usinga precision-fed cecectomized rooster bioassay:I.Soybean meal and SoyPlus[J].Journal of Dairy Science,2009,92(9):4489 ~ 4498.
[3]Giménez E C,Bénet T,Spack L.The uncertainty in the calculation of the amount of blocked and reactive lysine in milk products,as determined by the furosine method[J].Accreditation&Quality Assurance,2004,9:605 ~ 614.
[4]Cervantes-Pahm S K,Stein H H.Effect of dietary soybean oil and soybean protein concentrate on the concentration of digestible amino acids in soybean products fed to growing pigs[J].Journal of Animal Science,2008,86 (8):1841~1849.
[5]Chang C J,Tanksley T D,Knabe D A,et al.Effects of different heat treatments during processing on nutrient digestibility of soybean meal in growing swine[J].Journal of Animal Science,1987,65(5):1273 ~ 1282.
[6]Cozannet P,Primot Y,Gady C,et al.Ileal digestibility of amino acids in wheat distillers dried grains with solubles for pigs[J].Animal Feed Science&Technology,2010,158(3):177 ~ 186.
[7]Johannes F,Ulrike Z,Moughan P J,et al.Effect of heat damage in anautoclave on the reactive lysine contents of soy productsand corn distillers dried grains with solubles.Use of the results to check on lysine damage in common qualities of these ingredients[J].Journal of Agricultural&Food Chemistry,2007,55(26):10737 ~ 10743.
[8]Gerrard J A.Protein-protein crosslinking in food:methods,consequences,applications[J].Trends in Food Science&Technology,2002,13 (12):389 ~397.
[9]Goebel K P,Stein H H.Ileal Digestibility of amino acids in Conventional and Low-Kunitz Soybean Products Fed to Weanling Pigs[J].Asian Australasian Journal of Animal Sciences,2011,24(1):88 ~ 95.
[10]Holmer S F,Mckeith R O,Boler D D,et al.The effect of pH on shelflife of pork during aging and simulated retail display[J].Meat Science,2009,82(1):86 ~ 93.
[11]Hurrell R F,Carpenter K J.The estimation of available lysine foodstuffs after Maillard reactions[J].Progress in Food&Nutrition Science,1981,5 (1-6):159 ~ 176.
[12]Jaeger H,Janositza,Knorr D.The Maillard reaction and its control during food processing.The potential of emerging technologies[J].Pathologie Biologie,2010,58(3):207 ~ 213.
[13]Karr-Lilienthal L K,Utterback P L,amezcua C,et al.Relative bioavailability of phosphorus and true amino acid digestibility by poultry as affected by soybean extraction time and use of low-phytate soybeans[J].Poultry Science,2005,84(1):335 ~ 335.
[14]Kim B G,Petersen G I,Hinson R B,et al.Amino acid digestibilityand energy concentration in a novel source of high-protein distillers dried grainsand their effects on growth performance of pigs[J].Journal of Animal Science,2009,87(12):4013 ~ 4021.
[15]Martinez-Amerzcua C,Parsons C M.Effect of increased heat processing and particle size on phosphorus bioavailability in corn distillers dried grains with solubles[J].Poultry Science,2007,86(2):331 ~ 337
[16]Moughan P J,Rutherfurd S M.A New Method for Determining Digestible Reactive Lysine in Foods[J].J Agric food Chem,1996,44(8):2202 ~2209.
[17]NRC.1998.Nutrient Requirements of Swine.10th rev.ed[M].Natl.Acad.Press,Washington,DC.
[18]Pahma A,Pedersen C,Stein H H.Application of the reactive lysine procedure to estimate lysine digestibility in distillers dried grains with solubles fed to growing pigs[J].Journal of Agricultural&Food Chemistry,2008,56 (20):9441~9446.
[19]Purushotham B,Radhakrishna P M,Sherigara B S.Effects of Steam Conditioning and Extrusion Temperature on Someanti-nutritional Factors of Soyabean(Glycine max)for Pet Food Applications[J].American Journal of Animal&Veterinary Sciences,2007,2(1):1 ~ 5.
[20]Qian Y,Engel M H,Macko S A,et al.Kinetics of peptide hydrolysisand amino acid decompositionat high temperature[J].Geochimic Cosmochimicacta,1993,57(14):3281 ~ 3293.
[21]Guerra-Hernandez E,Ramirez-Jimenez A,Garcia-Villanova B.Effect of toasting time on the browning of sliced bread[J].Journal of the Science of Food&Agriculture,2001,81(5):513 ~ 518.
[22]Rufián-Henares J A,Delgado-andrade C,Morales F J.“Assessing the Maillard reaction development during the toasting process of common flours employed by the cereal products industry”[J].Food Chemistry,2009,114(1):93~99.
[23]Schwartz H M,Lea C H.The reaction between proteins and reducing sugars in the dry'state.Relative reactivity of the α-and ε-amino groups of insulin[J].Biochemical Journal,1952,50(5):713 ~ 716
[24]Shirley R B,Parsons C M.Effect of pressure processing on amino acid digestibility of meat and bone meal for poultry[J].Poultry Science,2000,79(12):1775~1781.
[25]Stein H H,Connot S P,Pedersen C.Energy and nutrient digestibility in four sources of distillers dried grains with solubles produced from corn grown withina narrow geographical area and fed to growing pigs[J].Asian-Australasian Journal of Animal Sciences,2009,22(7):1016 ~ 1025.
[26]Stein H H,Sève B,Fuller M F,et al.Invited review:amino acid bioavailability and digestibility in pig feed ingredients:Terminology and Application[J].Journal of Animal Science,2007,85(1):172 ~ 180.
[27]Stein H H,Shipley C F,Easter R A.Technical note:a technique for insertinga T-cannula into the distal ileum of pregnant sows[J].Journal of Animal Science,1998,76(5):1433 ~ 1436.
[28]VanBarneveld R J,Batterham E S,Norton B W.The effect of heat on amino acids for growing pigs.1.A comparison of ileal and faecal digestibilities of amino acids in rawand heat-treated field peas(Pisum sativum cultivar Dundale)[J].British Journal of Nutrition,1994a,72(2):221 ~ 241.
[29]VanBarneveld R J,Batterham E S,Norton B W.The effect of heat on amino acids for growing pigs.3.The availability of lysine from heat-treated field peas (Pisum sativum cultivar Dundale)determined using the slope-ratio assay[J].British Journal of Nutrition,1994b,72(2):257 ~ 275.

