“气体、固体、液体和物态变化”复习指导
彭长礼


考点分析:固体、液体、气体是物质存在的重要形态,物态变化是自然界的常见变化,气体实验定律是气体遵循的重要规律.理想气体状态方程是处理气体变化问题的重要规律,也是高考考查重点.本部分内容琐碎、考查点多,复习中应从微观角度分析固体、液体、气体的性质、气体实验定律为主干,梳理出知识点,进行理解性记忆,同时对热点题型进行针对性训练,由于高考对本部分内容要求较低,复习中要抓基础,重全面,防止遗漏知识要点,
一、气体
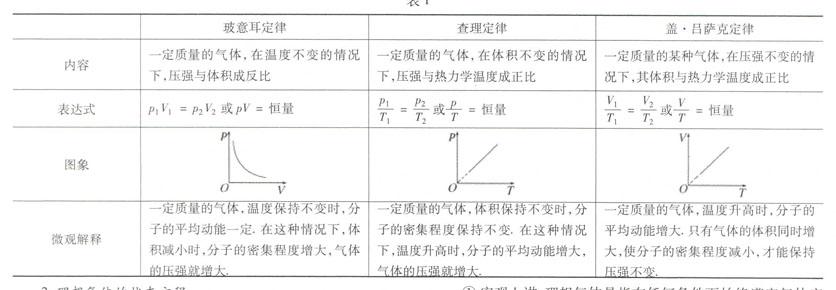
1.气体实验定律
2.理想气体的状态方程
(1)理想气体可视为理想气体.
②微观上看:分子可看作质点;除分子与分子间、分子与器壁间的碰撞外,分子间没有相互作用,因此理想气体没有分子势能,其内能仅由气体质量及温度决定,与体积无关;分子与分子、分子与器壁间的碰撞是弹性碰撞.
(2)理想气体的状态方程
①内容:一定质量的某种理想气体发生状态变化时,压强跟体积的乘积与热力学温度的比值保持不变.
(3)如何用气体实验三定律和理想气体状态方程解题
①选对象 根据题意,选出所研究的某一部分气体,这部分气体住状念变化过程中,其质量必须保持一定.
②找参量一找出作为研究对象的这部分气体发生状态变化前后的一组p、V、T数值,压强的确定往往是个关键,常需结合力学知识(如力平衡条件或牛顿运动定律)才能写出表达式,对于二多个研究对象的问题,应注意分别确定每个对象的初、未状态三参量,并且用不同脚码区分开,防止张冠李戴,
⑧认过程一过程表示两个状态之间的一种变化方式,除题中条什已区接指明外,在许多情况下,往往需要通过对研究对象跟周围环境的相互关系的分析中才能确定.
④列方程一根据研究对象状态变化的具体方式,选用气态方程或某一实验定律,代入具体数值,T必须用热力学温度,p、V的单位要统一.
⑧验结果一由方程组解答出结果后,不要急于下结论,要分析所得结果的合理性及其是否有实际的物理意义.
3.气体分子运动的特点
(1)气体分子间距较大,分子力可以忽略,因此分子间除碰撞外小受其他力的作用,故气体能充满整个空间.
(2)分子做无规则的运动,速率有大有小,且时而变化,大量分子的速率按“中间多,两头少”的规律分布.
(3)温度升高时,速率小的分子数减少,速率大的分子数增多,分子的平均速率将增大,但速率分布规律不变.
4.气体的压强
(1)产生原因.由于大量分子无规则地运动而碰撞器壁,形成对器壁各处均匀、持续的压力,作用在器壁单位面积上的压力叫做气体的压强.
(2)决定因素.宏观上:决定于气体的温度和体积,微观上:决定于分一.的平均动能和分子数密度.
5.气体的温度
温度在宏观上表示物体的冷热程度;在微观上是分子平均动能的标志,热力学温度是国际单位制中的基本量之一,符号T,单位K(开尔文):掇氏温度是导出单位,符号t,单位。C(摄氏度).关系是t= T-T0,,其中T0=273. 15 K,摄氏度不再采用过去的定义,两种温度问的关系可以表示为:T=t+273. 15 K和△T=△t,要注意两种单位制下每一度的间隔是相同的,二、固体和液体1.晶体与非晶体(见表2)
判断是否是晶体的主要依据是看其是否有熔点,判断足否是单晶体的主要依据是从其物理性质是否各向异性,特别要注意的是各向同性只能说明其不是单晶体,但不能判断其是多是多晶体还是非晶体.
2.液体
(1)液体的微观结构特点,①分子问的距离很小;在液体内部分子间的距离在10-10 m左右.②液体分子间的相互作用力很大,但比固体分子间的作用力要小,③分子的热运动特点表现为振动与移动相结合.
(2)液体的表面张力.①作用:液体的表面张力使液面具有收缩的趋势,②方向:表面张力跟液面相切,跟这部分液f自fff勺分界线垂直,③大小:液体的温度越高,表面张力越小;液体中溶有杂质时,表面张力变小;液体的密度越大,表面张力越大.
(4)饱和汽与饱和汽压,与液体处于动态平衡的蒸汽叫做饱和汽;没有达到饱和状态的蒸汽叫末饱和汽.在一定温度下,饱和汽的分子数密度是一定的,因而饱和汽的压强也是一定,这个压强叫做这种液体的饱和汽压.饱和汽压随温度升高而增大.
(5)相对湿度,空气中水蒸气的压强与同一温度时水的饱和汽压之比叫做空气的相对湿度.即:相对湿度=
友情提示:空气的湿度是表示空气潮湿程度的物理量,但影响蒸发快慢以及影响人们对干爽与潮湿感受的因素,不是空气中水蒸气的绝对数量,而是空气中水蒸气的压强与同一温度下水的饱和汽压的差距,所以与绝对湿度相比,相对湿度能更有效的描述空气的潮湿程度,
三、物态变化中的能量交换
1.熔化与凝固
熔化:物质从固态变成液态的过程.
凝固:物质从液态变成固态的过程,
提示:熔化是凝固的逆过程.
2.为什么熔化会吸热,凝固会放热
由于固体分子间的强大作用,固体分子只能在各自的平衡位置附近振动,对固体加热,在其开始熔化之前,获得的能啦主要转化为分子的动能,使物体温度升高,当温度升高到一定程度,一部分分子的能量足以克服其他分子的束缚,从而可以在其他分子间移动,固体开始熔化,相反过程,凝固会放热. 3.熔化热 某种晶体熔化过程中所需的能量与其质量之比,称做这种晶体的熔化热,一定质量的晶体,熔化时吸收的热量与凝固时放出的热量相等.不同的晶体有不同的结构,要破坏不同物质的结构,所需的能量也就不同,因此不同晶体的熔化热也不相同. 4.汽化热 汽化:物质从液态变成气态的过程. 汽化热:某种液体汽化等同温度的气体所需的能量与其质量之比.
注意:一定质量的物质,在一定的温度和压强下,汽化时吸收的热量与液化时放出的热量相等.
考点1:对气体实验定律和理想气体状态方程的考查
例1 農村常用来喷洒农药的压缩喷雾器的结构如图l所示,药筒A的容积为7.5 L,装入药液后,药液上方空气的体积为1.5 L,关闭阀门K,用打气筒B每次打进1×l05 Pa的空气250 mL,求:
(1)要使药液上方的气体压强为4 xl05 Pa,打气筒活塞应打气的次数;
(2)当A中有4×l05 Pa的气体后,打开阀门K可喷射药液,直到不能喷射时,喷雾器内剩余药液的体积,
分析:本题是以农业生产工具喷雾器的工作原理为背景,从实际的角度考查气体实验定律,这是今后高考命题的方向.
规范解答:(1)以V表示打气前药液上方的体积,p0表示打气前A容器内的气体压强,V0表示每次打入压强为,P0的空气的体积,p1表示打入n次气体后A容器内的气体压强,以A中原有空气和n次打入A容器内的全部气体为研究对象,由玻意耳定律得Po (V+nV0)=P1 V,解得n=18.
(2)打开阀门K后,直到药液不能喷射,忽略喷管中药液产生的压强,则|4容器内的气体压强应等于外界大气压强,以A容器内的气体作为研究对象,由玻意耳定律得p1V=PoV',解得

