多肽诱导的巨型脂质体出芽和泄露行为
孙建波 夏玉琼 于秋红 梁德海
(北京大学化学与分子工程学院,北京分子科学国家实验室,北京 100871)
多肽诱导的巨型脂质体出芽和泄露行为
孙建波 夏玉琼 于秋红 梁德海*
(北京大学化学与分子工程学院,北京分子科学国家实验室,北京 100871)
细胞膜与膜蛋白之间的相互作用与生命中许多过程息息相关. 以巨型脂质体(GUV)和多肽分别作为细胞膜和膜蛋白的简化模型, 我们设计了四种仅包含亮氨酸(L)和赖氨酸(K)的多肽, 即K14、(KL2KL2K)2、(KL2KL3)2和K6L8, 并对比研究了它们与中性和负电性脂质体的相互作用. 电荷密度最高的K14只是涂层在脂质体表面, 不破其囊泡结构, 但能够引起负电性脂质体发生微相分离, 属建设性相互作用. 能够形成两亲性α螺旋的(KL2KL2K)2和(KL2KL3)2则引起脂质体发生泄露和破裂, 属破坏性作用. 但二者引起泄露的速率在中性脂质体和负电性脂质体中的结果恰好相反, 说明泄露分两步进行: 表面吸附多肽达到一定浓度, 继而对膜进行干扰. 表面活性剂型多肽K6L8的氨基酸组成与(KL2KL2K)2相同, 但K6L8只是引起负电性脂质体发生泄露, 造成中性脂质体发生外出芽. 这些简单氨基酸造成的脂质体的复杂构象变化可以统一用静电和疏水相互作用在膜上的位置和强度来进行解释. 这些结论对于深入理解膜蛋白的作用机理是有帮助的.
多肽; 巨型脂质体; 出芽; 泄露
1 引 言
在生理环境中,细胞膜无时无刻不在进行着构象变化,如融合、出芽和内吞等. 这些构象变化决定着细胞的运动、分裂、神经元轴细胞的延伸、囊泡运输等生物功能.1细胞从外界环境摄取营养物质,以及排除废物也离不开构象变化. 靶向药物的开发和基因治疗的首要问题就是要解决细胞的摄取问题,这与细胞膜的内吞是密切相关的. 细胞膜的构象变化在很大程度上是由膜蛋白来控制的. 例如,发动蛋白会与肌醇头基磷脂分子发生特异性结合而形成螺旋状寡聚体,从而把膜的拓扑结构限制成管状.2内吞过程中涉及的网格蛋白、3COPI与COPII4则是通过自身聚集形成特定结构从而导致膜进行弯曲. 研究还发现,固有曲率为锥形的跨膜蛋白,如烟碱样乙酰胆碱受体的跨膜结构域5,6或具有电压依赖性的K+通道蛋白,会倾向于插入到与其相匹配的曲率膜中,通过与附着蛋白发生进一步聚集,从而改变细胞膜局部曲率.7
膜蛋白本身结构复杂,很难溶于水,其功能一般只有和膜相互作用时才体现出来,这些都阻碍了人们对膜蛋白及其与膜作用机理的深入认识. 近年来发展起来的分而治之(divide and conquer)的策略8,9很好地缓解了这一困境. 分而治之的基本思想就是把蛋白分割成不同序列的多肽,分别进行研究,然后把结果综合起来,这使得问题大幅度简化. 在此基础上人们开发并研究了抗菌肽、10跨膜肽、11穿膜肽12,13与融合肽等.14更进一步,利用组成已知的脂质体来代替细胞膜,15人们初步研究了这些多肽以及聚多肽16,17与脂质体18的相互作用.19例如,融合肽能够部分插入到脂质体膜中,外露的部分能够通过coil-coil作用20导致脂质体发生融合,成功模拟了体内snare蛋白的功能.13当多肽的α螺旋程度降低时,它对脂质体的破坏作用会显著下降.21这些研究对于揭示细胞膜与蛋白作用的机理都是有帮助的.
但是到目前为止,人们对多肽和脂质体膜的相互作用研究还处在初级阶段,对于一些机理的认识还存在争议,例如穿膜肽的作用机理还不清楚,多肽序列和膜变形的关系还没有建立起来. 尽管多肽与膜蛋白相比,缺少了三级和四级结构,但是可调因素仍然很多,包括氨基酸序列、二级结构、多肽的长度、电荷密度和分布、疏水比例等. 这些因素都会对多肽与脂质体膜的作用效果带来影响.
多肽与脂质体膜之间主要是静电相互作用和疏水相互作用,可以仅选取带电和疏水两种氨基酸组成的多肽序列来进行研究,这会使得问题更进一步简化. 在本文中,我们利用正电的赖氨酸(K)和疏水的亮氨酸(L),自主设计了四种长度为14个残基的氨基酸序列(表1),对比研究了它们与中性和负电性巨型脂质体(GUV)的相互作用,原位跟踪动力学,并初步评价多肽序列与膜变形的关系.
2 实验部分
2.1 样 品
钙黄绿素购于Sigma Aldrich公司,纯度> 99%.二棕榈酰磷脂酰-N-磺化丽丝胺罗丹明的铵盐(Rh-DPPE)、1-棕榈酰基-2-油酰基磷脂酰胆碱(POPC)、1-棕榈酰基-2-油酰基磷脂磷脂酰甘油 (POPG)、二棕榈酰磷脂酰胆碱(DPPC)和二棕榈酰磷脂酰甘油(DPPG)的有机溶液购于Avanti Polar Lipids公司,纯度> 99%. 多肽Ac-KKKKKKLLLLLLLL-amide(K6L8),Ac-KLLKLLKKLLKLLK-amide (KL2KL2K)2,Ac-KLLKLLLKLLKLLL-amide (KL2KL3)2和Ac-KKKKKKKKKKKKKK-amide (K14) 购自吉尔生化公司(上海,纯度> 98%). 实验用水为Milli-Q(Millipore)超纯水(电阻率为18.2 MΩcm).

表1 多肽序列Table 1 Peptide sequence
2.2 巨型脂质体(GUV)的制备
巨型脂质体采用电形成法,22在由两层氧化铟锡(ITO)玻璃和厚度为2 mm的聚二甲基硅氧烷(PDMS)构成的腔室内制备. 装置的细节可参见Dimitrov和Angelova23的工作. ITO玻璃依次用甲醇溶液冲洗三次,甲醇/氯仿溶液超声20 min,氯仿溶液超声20 min,甲醇超声20 min,纯净水超声20 min,最后自然晾干. 利用95%氯仿/5%乙腈的混合溶剂配置浓度为3.75 mgmL-1的磷脂溶液. 在800 rmin-1、1 min的条件下将0.8 mL磷脂溶液旋涂在尺寸为50 mm × 50 mm × 1.1 mm的ITO玻璃上.24把ITO玻璃与PDMS组装成腔室,25 °C预热10 min后,往腔室中加入预热过的0.1 molL-1蔗糖溶液进行水化,期间施加2.0 V、10 Hz的正弦交流电压. 4 h后,电压调节为3.0 V、5 Hz,并持续1 h. 采用这种方法分别制备POPC和POPC/POPG 摩尔比为4 : 1的巨型脂质体. 脂质体中掺入了0.2%罗丹明B标记的磷脂Rh-DPPE来进行标记.
2.3 巨型脂质体与多肽相互作用实验
实验中利用激光共聚焦显微镜(A1R-si,日本尼康公司)来跟踪研究巨型脂质体与多肽的相互作用过程. 在自制的直径为9 mm的圆型孔槽内加入200 μL 0.1 molL-1葡萄糖与50 μmolL-1钙黄绿素的混合溶液(pH = 7),加入适量多肽溶液,25 °C预热5 min. 之后加入10 μL巨型脂质体溶液,最终多肽与脂质分子摩尔比为1/80,并开始计时. 因为蔗糖的密度比葡萄糖大,巨型脂质体会沉到圆型孔槽底部,25便于用激光共聚焦显微镜原位跟踪观察. 如果脂质体发生泄露,环境中的钙黄绿素就会进入到脂质体内部. 跟踪脂质体内部钙黄绿素浓度的变化,可以得到泄露的动力学曲线.
3 结果与讨论
3.1 多肽的二级结构
在水溶液中只有疏水比例较高的(KL2KL3)2形成α螺旋结构,其它多肽均为无规结构. 而在疏水环境中除了K14为无规结构以外,其余多肽均以α螺旋结构(含量> 50%)为主.26图1对比了四种多肽的三维(3D)螺旋轮示意图. 其中K14也绘成了α螺旋结构以方便对比. 从图1可以清楚地看到带电氨基酸和疏水氨基酸的比例和分布.
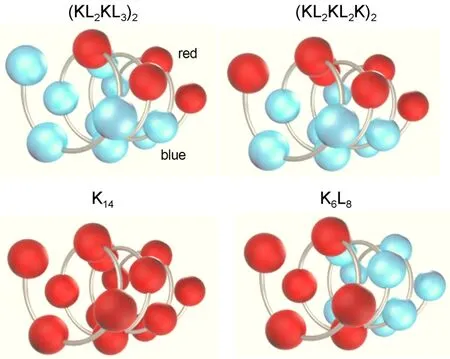
图1 四种多肽序列3D螺旋轮的对比图Fig.1 Comparison of 3D helical wheel diagram of the four peptides
3.2 K14与巨型脂质体作用
在四种多肽中,K14全部由正电氨基酸残基构成,因此电荷密度最高. 它能够和负电GUV发生静电相互作用,和中性GUV 发生电荷-偶极相互作用. 如图2所示,中性和负电性GUV在与K14作用时都保持了囊泡结构的稳定性,在所研究的时间范围内没有观察到膜出现泄露或变形行为. 与中性GUV不同的是,负电性GUV的膜表面发生了微相分离,从3D重构(图2(C))图中可以清晰地观察到荧光分布的非均匀性. 微相分离主要是因为K14与负电磷脂发生强的静电吸引时,会引起负电磷脂的聚集和重新分布,从而产生负电磷脂富集区和贫瘠区. 仅存在静电相互作用时,脂质体不会发生变形,与文献27中的报道是一致的.

图2 K14与POPC (A)和n(POPC)/n(POPG) = 4 : 1 (B)形成GUV的相互作用Fig.2 K14interacting with POPC (A) or n(POPC)/n(POPG) =4 : 1 GUV (B)
3.3 (KL2KL2K)2和(KL2KL3)2与巨型脂质体作用
(KL2KL2K)2和(KL2KL3)2在疏水环境中都能够形成两亲性α螺旋(图1). 二者的主要区别是带电氨基酸和疏水氨基酸的数目比例不同,前者为6/8,而后者为4/10.
图3对比了(KL2KL2K)2和(KL2KL3)2与中性GUV相互作用的结果. 在两种情况下,环境中的钙黄绿素都进入到GUV内部,表明发生了泄露. 在(KL2KL2K)2存在下,泄露是逐渐发生的,没有观察到诱导期的存在,且最终GUV发生破裂(图3(A)); 而在(KL2KL3)2存在下,泄露存在诱导期,速度也很慢,但整体膜并没有被破坏(图3(B)). 图3(C)对比了二者的动力学曲线,利用指数增长模型对曲线进行拟合,结果显示(KL2KL2K)2和(KL2KL3)2引起的特征泄露时间分别为145和178 s,说明疏水比例较低的多肽(KL2KL2K)2引起脂质体的泄露的能力对疏水比例较高的(KL2KL3)2要强.
而在负电性脂质体中得到的结论却恰好相反.如图4(A)和4(B)所示,(KL2KL2K)2和(KL2KL3)2都首先在GUV的表面富集,表现为界面的模糊化,其实这是所有负电GUV与正电多肽作用的普遍现象. 随时间延长,两种脂质体都引起GUV发生了泄露,并最终导致GUV发生破裂. 图4(C)对比了二者的动力学曲线,泄露发生前都存在诱导期,但(KL2KL3)2的诱导期明显比(KL2KL2K)2要长很多. 拟合结果显示,(KL2KL2K)2和(KL2KL3)2引起泄露的时间分别为131和108 s,说明二者对膜的破坏能力存在一定差异.
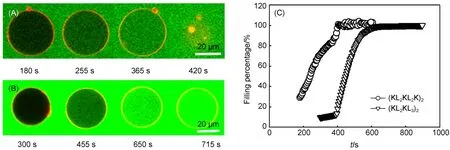
图3 中性GUV在(KL2KL2K)2(A) 和 (KL2KL3)2(B)存在下的泄露行为及其二者对钙黄绿素的动力学泄露曲线(C)的对比Fig.3 Leakage behavior of (KL2KL2K)2(A) and (KL2KL3)2(B) interacting with neutral GUV(POPC) and comparision of dynamic leakage curves of calcein for (KL2KL2K)2and (KL2KL3)2(C)
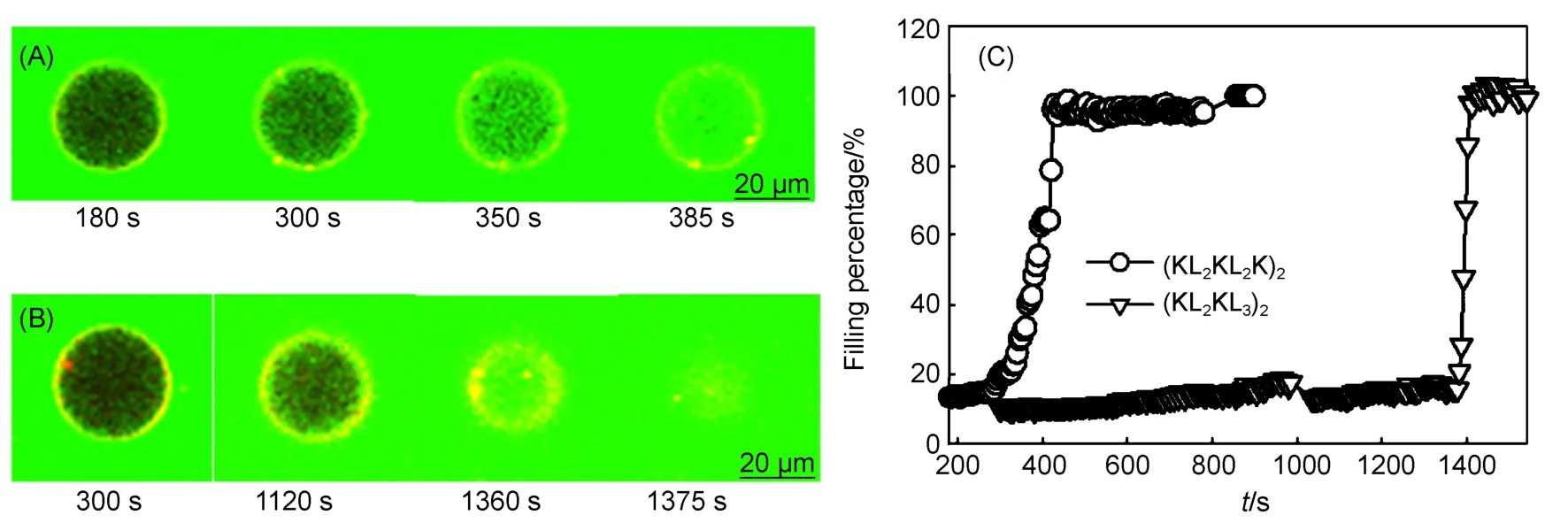
图4 负电性GUV(n(POPC)/n(POPG) = 4 : 1)在(KL2KL2K)2(A)和(KL2KL3)2(B)存在下的泄露行为及其二者的钙黄绿素动力学泄露曲线的对比(C)Fig.4 (KL2KL2K)2(A) and (KL2KL3)2(B) interacting with anionic GUV (n(POPC)/n(POPG) = 4 : 1),and comparision of dynamic leakage curves of calcein for (KL2KL2K)2and (KL2KL3)2(C)
对比图3和图4不难发现,两种多肽引起负电GUV的泄露程度都比中性GUV剧烈,说明静电吸引作用对泄露也有一定的贡献. (KL2KL3)2和 (KL2KL2K)2在中性和负电性GUV中泄露动力学的差异可以用多肽在GUV表面吸附和对膜造成破坏两个步骤来进行解释. 造成吸附的驱动力以静电相互作用为主,而对膜破坏以疏水作用为主. 只有GUV表面的多肽达到一定程度,并能够与磷脂分子的疏水尾链(即插入到膜中)发生作用时,泄露才会发生. 对于中性GUV,多肽的吸附为速控步,电荷比例较高的(KL2KL2K)2与GUV的吸附能力强,泄露速度快. 而对于负电性GUV,由于强的静电作用,吸附作用都加强. 但静电和疏水作用位点不同,前者与膜表面的亲水头基作用,而后者则与膜内部的疏水尾链作用,因此强的静电吸引在一定程度上妨碍了多肽插入到膜的内部. 这需要吸附更多的多肽分子来中和脂质体表面的电荷,表现为脂质体界面模糊(图4(A,B)),诱导期增加. 静电作用相对较弱的多肽(KL2KL3)2诱导期更长. 但一旦表面吸附的多肽达到临界浓度,泄露会很快发生. 疏水力越强,作用越剧烈.
3.4 K6L8与巨型脂质体作用
K6L8是表面活性剂型多肽,它与中性GUV发生作用时,引起了向外出芽. 如图5所示,随时间延长,首先是脂质体表面由于与K6L8之间的电荷-偶极作用发生聚集分相,GUV自身变长,然后再从中部位置变窄,形成哑铃型,哑铃的非对称性增加,形成出芽. 三维重构结果显示,外出芽基本是球形,而主体则是椭圆形(图5(B)). 利用激光共聚焦显微镜数据处理软件可以统计GUV在出芽前(图5(A)中(1))和形成哑铃型结构(图5(A)中(3))的表面积与体积比(A/V). 结果表明,A/V值从出芽前的0.25 μm-1增加到出芽后的0.30 μm-1,说明GUV的外层膜面积增加.28,29结合K6L8的疏水残基分布,推断向外出芽的机理如下: 多肽吸附到脂质体表面后增加了吸附区域的线张力,导致线张力大于弯曲能,且同时多肽中疏水的L8嵌段插入到中性GUV膜中,但由于其长度只有膜厚度的一半,因而造成巨型脂质体外层膜面积增加,发生出芽.30,31
当K6L8与负电GUV相互作用时,观察到了快速破裂的过程(图6). 这是由于K6L8与负电GUV的静电吸附能力太强,大量表面活性剂形成胶束状结构,对GUV的膜造成了溶解型破坏.
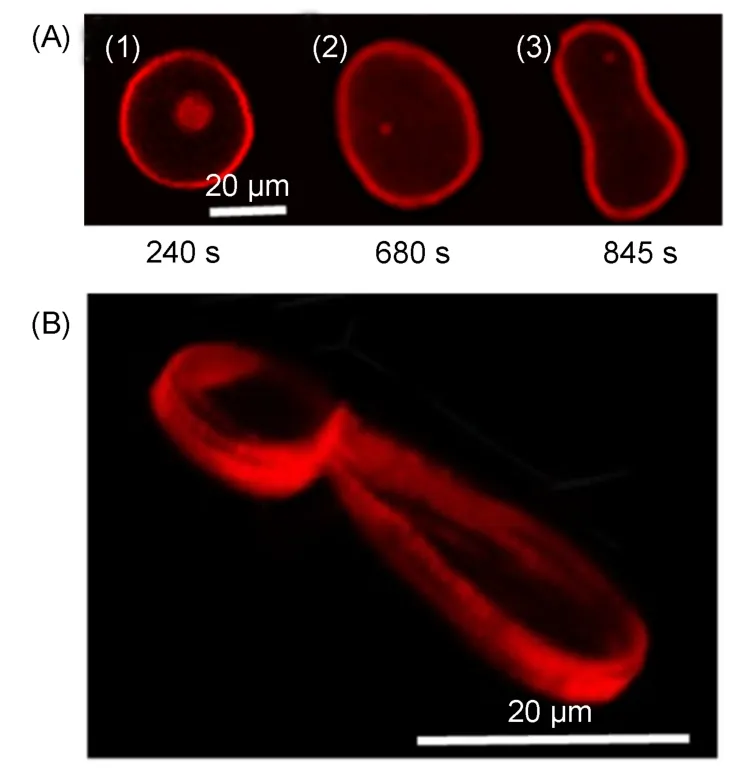
图5 K6L8引起中性GUV (POPC)的向外出芽过程(A)与三维重构图(B)Fig.5 Outward budding process (A) and 3D reconstruction (B) for neutral GUV (POPC) caused by K6L8
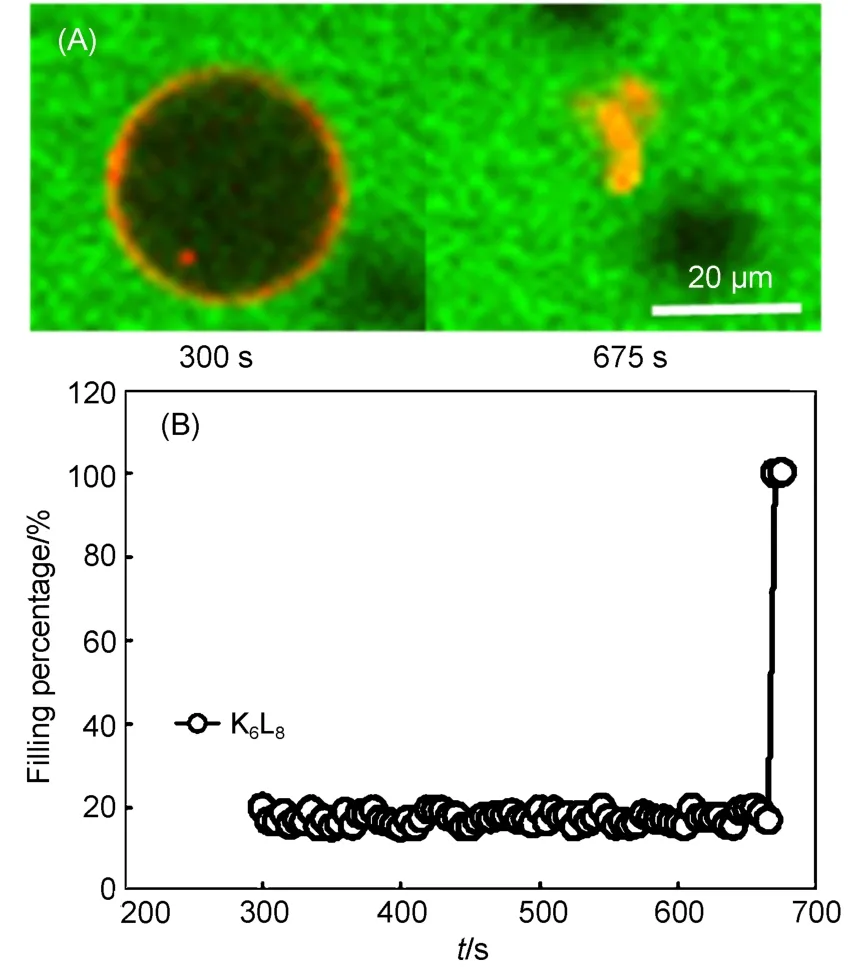
图6 K6L8体系中负电GUV (POPC/POPG)随着时间的变化(A)及负电GUV内部钙黄绿素的填充比例动力学(B)Fig.6 Kinetic process for negatively charged GUV(POPC/POPG) (A) with time and dynamic filling percentage of calcein (B) caused in K6L8system
4 结 论
仅有亮氨酸和赖氨酸构成的多肽,由于序列和电荷比的不同,能够引起脂质体发生相变、泄露和出芽等过程. 以静电相互作用为主的K14主要作用在GUV的表面,囊泡结构保存了完整性. 利用这种吸附作用可以开发物理涂层多肽来改变脂质体的性能,32因此这种作用可以认为是建设性的. 两亲性多肽(KL2KL2K)2与(KL2KL3)2能够引起脂质体发生泄露和破裂,泄露的动力学可以通过改变序列和疏水比进行调控,这种破坏性作用有助于开发高效抗菌肽.而K6L8既具有破坏性作用,也能够以吸附在表面和插入到膜内的方式诱发出芽行为. 因此,这种构象变化行为是建设性和破坏性作用竞争的结果. 我们预测调控多肽在脂质体表面的竞争作用能够引起更多的构象变化行为. 考虑到K6L8和(KL2KL2K)2具有相同的氨基酸组成,只是序列分布不同,二者与脂质体作用的差异可归结为在膜中插入的深度和作用强度不同. 这些结论对于了解膜蛋白的作用机理是很有帮助的.
(1)McMahon,H. T.; Gallop,J. L. Nature 2005,438 (7068),590. doi: 10.1038/nature04396
(2)Hinshaw,J. E.; Schmid,S. L. Nature 1995,374 (6518),190. doi: 10.1038/374190a0
(3)Artalejo,C. R.; Elhamdani,A.; Palfrey,H. C. Proceedings of the National Academy of Sciences of the United States of America 2002,99 (9),6358. doi: 10.1073/pnas.082658499
(4)Antonny,B.; Gounon,P.; Schekman,R.; Orci,L. Embo Reports2003,4 (4),419. doi: 10.1038/sj.embor.embor812
(5)Fertuck,H. C.; Salpeter,M. M. Proceedings of the National Academy of Sciences of the United States of America 1974,71(4),1376. doi: 10.1073/pnas.71.4.1376
(6)Unwin,N. Journal of Molecular Biology 2005,346 (4),967. doi: 10.1016/j.jmb.2004.12.031
(7)Eckler,S. A.; Kuehn,R.; Gautam,M. Neuroscience 2005,131(3),661. doi: 10.1016/j.neuroscience.2004.11.035
(8)Daniel,R.; Schuck,N. W.; Niv,Y. Proceedings of the National Academy of Sciences of the United States of America 2015,112(10),2929. doi: 10.1073/pnas.1500975112
(9)Bentley,J. L. Commun. ACM 1980,23 (4),214. doi: 10.1145/358841.358850
(10)Brogden,K. A. Nature Reviews Microbiology 2005,3 (3),238. doi: 10.1038/nrmicro1098
(11)Holt,A.; Killian,J. A. European Biophysics Journal with Biophysics Letters 2010,39 (4),609. doi: 10.1007/s00249-009-0567-1
(12)Frankel,A. D.; Pabo,C. O. Cell 1988,55 (6),1189. doi: 10.1016/0092-8674(88)90263-2
(13)Marsden,H. R.; Tomatsu,I.; Kros,A. Chemical Society Reviews 2011,40 (3),1572. doi: 10.1039/C0CS00115E
(14)Liang,X. Y.; Li,L.; Qiu,F.; Yang,Y. L. Physica A-Statistical Mechanics and Its Applications 2010,389 (19),39651.
(15)Yang,K.; Ma,Y. Q. Journal of Physical Chemistry B 2009,113(4),1048. doi: 10.1021/jp805551s
(16)Cai,C.; Wang,L.; Lin,J. Chemical Communications 2011,47(40),11189. doi: 10.1039/c1cc12683k
(17)Deng,Y. B.; Hu,B. W.; Zhou,P. Acta Phys. -Chim. Sin. 2009,25 (7),1427. [邓益斌,胡炳文,周 平. 物理化学学报,2009,25(7),1427.] doi: 10.3866/PKU.WHXB20090738
(18)Deng,L.; Liang,D. H. Acta Phys. -Chim. Sin. 2010,26 (4),862.[邓 林,梁德海. 物理化学学报,2010,26 (4),862.] doi: 10.3866/PKU.WHXB20100422
(19)Wu,Q. Y.; Liang,Q. Langmuir 2014,30 (4),1116. doi: 10.1021/la4039123
(20)Kashiwada,A.; Hiroaki,H.; Kohda,D.; Nango,M.; Tanaka,T. Journal of the American Chemical Society 2000,122 (2),212. doi: 10.1021/ja993190q
(21)Beevers,A. J.; Dixon,A. M. Chemical Society Reviews 2010,39(6),2146. doi: 10.1039/b912944h
(22)Shimanouchi,T.; Umakoshi,H.; Kuboi,R. Langmuir 2009,25(9),4835. doi: 10.1021/la8040488
(23)Dimitrov,D. S.; Angelova,M. I. Journal of Electroanalytical Chemistry 1988,253 (2),323. doi: 10.1016/0022-0728(88)87069-4
(24)Estes,D. J.; Mayer,M. Colloids and Surfaces B-Biointerfaces 2005,42 (2),115. doi: 10.1016/j.colsurfb.2005.01.016
(25)Wheaten,S.,A.; Lakshmanan,A.; Almeida,P.,F. Biophysical Journal 2013,105 (2),432. doi: 10.1016/j.bpj.2013.05.055
(26)Sun,J.; Xia,Y.; Li,D.; Du,Q.; Liang,D. Biochim. Biophys. Acta 2014,1838 (12),2985. doi: 10.1016/j.bbamem.2014.08.018
(27)Nizet,V. Current Issues in Molecular Biology 2006,8,11.
(28)Döbereiner,H. G.; Käs,J.; Noppl,D.; Sprenger,I.; Sackmann,E. Biophysical Journal 1993,65 (4),1396. doi: 10.1016/S0006-3495(93)81203-7
(29)Käs,J.; Sackmann,E. Biophysical Journal 1991,60 (4),8254.
(30)Hristova,K.; Dempsey,C. E.; White,S. H. Biophysical Journal 2001,80 (2),801. doi: 10.1016/S0006-3495(01)76059-6
(31)Hong,B. B.; Qiu,F.; Zhang,H. D.; Yang,Y. L. J. Phys. Chem. B 2007,111,5837
(32)Su,C.; Xia,Y.; Sun,J.; Wang,N.; Zhu,L.; Chen,T.; Huang,Y.;Liang,D. Langmuir 2014,30 (21),6219. doi: 10.1021/la501296r
Peptide-lnduced Budding and Leakage Behavior of Giant Vesicles
SUN Jian-Bo XIA Yu-Qiong YU Qiu-Hong LIANG De-Hai*
(Beijing National Laboratory for Molecular Sciences,College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P. R. China)
The interactions between membrane proteins and cell membranes are critical in many life processes. Giant unilamellar vesicles (GUVs) and peptides are simple but effective models of membranes and membrane proteins, respectively. Here, we designed four peptides composed of lysine (K) and leucine (L)amino acids, K14, (KL2KL2K)2, (KL2KL3)2, and K6L8, and examined their interactions with neutral and negatively charged GUVs. The peptide K14has the largest charge density and is able to coat the GUV surface without damaging its structure. Whereas, leakage is observed in both neutral and charged GUVs in the presence of(KL2KL2K)2and (KL2KL3)2, which can form amphiphilic α-helices in hydrophobic environments. However, the leakage rates as a function of peptide concentration are reversed for the neutral and charged GUVs. Thus, leakage occurs in two steps: absorption of peptides on the surface up to a certain level, followed by disruption of the membrane. The peptide K6L8has the same chemical composition as (KL2KL2K)2, but induces leakage only on negatively charged GUVs, while neutral GUVs undergo outward budding. Conformational changes of GUVs induced by simple peptides can be attributed to the working location (on the surface or inside the membrane), and the strength of electrostatic and hydrophobic interactions. Overall, the results provide a better understanding of membrane protein mechanisms.
Peptide; Giant vesicle; Budding; Leakage
May 4,2015; Revised: August 25,2015; Published on Web: August 26,2015.
. Email: dliang@pku.edu.cn; Tel: +86-10-62756170.
O648
10.3866/PKU.WHXB201508262
The project was supported by the National Natural Science Foundation of China (21074005,21174007).国家自然科学基金(21074005,21174007)资助项目