气体压强传感技术在中学化学实验教学中的应用
王欣磊+沈甸
摘要:传统实验操作简便,现象直观,但学生难以体会到变化的微观过程。在传统实验中引入依托传感技术的数字化信息技术是提高实验教学效果的重要手段。利用压强传感技术测定二氧化碳在水中的溶解速率,检验二氧化碳与氢氧化钠、饱和碳酸钠溶液反应所具有的特有现象,可揭示化学变化内在的某些特点,也可为中学化学实验教学提供丰富素材。
关键词:中学化学实验教学;数字化技术实验;压强传感器;二氧化碳检测
文章编号:1005–6629(2015)9–0058–04 中图分类号:G633.8 文献标识码:B
化学是一门基于实验的科学,化学实验对于理解化学理论知识裨益颇大。中学化学中常用的基于玻璃仪器和试剂的传统实验操作简单,对于有发光、发热、颜色变化等现象明显的化学反应教学效果好。但涉及到有气体产生、微弱温度变化、电子转移等用肉眼难以观察到现象的实验,学生只能凭空想象,教学效果差强人意。
早在1978年,发达国家已使用传感器来辅助教学。在美国化学教材[1]中,将依托传感器设计的新型实验取代了过去的传统实验。但反观国内中学化学教学现状,即使在上海这样较发达地区,真正将传感技术应用于课堂中的学校屈指可数。笔者认为,除了资金原因之外,缺乏紧扣教材内容、切实可行、设备简单的实验教学案例是传感技术尚未被广泛使用的主要原因。
当前,适用于中学化学教学的传感器有多种类型,如温度传感器、pH传感器等。本文将以压强传感器作为主要的实验设备,结合传统实验设备测定二氧化碳在水中的溶解速率,检验二氧化碳与氢氧化钠、碳酸钠反应的特有现象。选择压强传感技术的原因在于:(1)压强传感器的数据可靠,性能稳定,操作便捷;(2)压强是研究气体反应的一个重要参数,传统实验难以测定。引入压强传感技术能将压强数字化、直观化,扫除学生理解上的障碍;(3)压强传感器相对比较便宜,一套压强传感器装置的价格在2000元以内,能为一般中学所接受。
1 压强传感技术及装置简介
压强传感技术是DIS(数字化信息系统)实验技术的一种,由压强传感器、数据采集器、计算机和通用软件组成。压强传感器是通过压强传感器监测在恒容、密闭体系中气体微弱的压强变化,然后把测得的压强转化为电信号,数字采集器将电信号处理后传入计算机内,通过通用软件进行分析处理,并以数据图表等形式输出[2]。
本研究中所使用的实验装置如图1所示。该装置是以250mL集气瓶作为反应容器,配以符合集气瓶口径的单孔橡皮塞,橡皮塞连接塑料导管再连接至压强传感器。用集气瓶作为反应容器连接压强传感器进行实验能贴近教材上相关实验装置,装置简单操作简化,能在较短的时间内精确测出集气瓶内微弱的压强变化。
2 压强传感技术在中学化学教学中的应用
2.1 二氧化碳收集方法探究
实验室中如何收集一瓶纯度较高的二氧化碳气体?在我国的中学化学教材中,二氧化碳通常用向上排空气法收集,而用该法收集二氧化碳很难判断气体是否集满:已有实验[3]证明当二氧化碳的体积分数超过30%就能使点燃的木条熄灭。因此用此法收集到的二氧化碳往往不纯。
20℃,一个标准大气压下,1体积水中能溶解0.88体积的二氧化碳。因此二氧化碳通常被认为不能使用排水法收集。但国外的化学教材上多用排水法来收集。国内已有不少研究明确地提出了二氧化碳可以用排水法来收集[4,5],但缺乏具体的数据来说明用排水法来收集一定量的二氧化碳时二氧化碳在水中溶解的量或者说损失率。本研究将用压强传感器来监测一定时间内二氧化碳在水中的溶解速率,再从二氧化碳的消耗率的角度来定量地说明用排水法收集二氧化碳的可行性。
2.1.1 基于压强传感技术验证二氧化碳在水中的溶解速率
收集一集气瓶二氧化碳气体,加入约三分之一集气瓶的水并立即盖上附有传感器的橡皮塞,在室温(15℃)下通过压强传感器测定集气瓶中压强变化,由气体压强随时间变化曲线计算二氧化碳在水中的溶解速率,具体过程如下:
(1)开始:数据采集器连接压强传感器,打开logger lite 1.5软件,以时间为横坐标,压强为纵坐标,得到“压强-时间”曲线。
(2)数据采集:气体压强缓慢减小,曲线基本保持水平,4分钟后停止采样,得到如图2所示的“压强-时间”曲线。
选取0~120秒数据做出拟合图线方程Pres=mt+b(m代表斜率,b代表截距):P=-0.003618t+103.0。由此可得前两分钟内二氧化碳在水中的平均溶解速率ν=0.007980÷8.314÷288×60=9.06×10-5 mol/(L·min)。而常温常压下用2mol/L盐酸与大理石反应制取二氧化碳,前两分钟的平均速率在0.109 mol/(L·min)[6]左右。将这两个数据相除可以得知,若用排水法收集二氧化碳气体损失约为0.083%。
结论:通常情况下,二氧化碳气体在水中的溶解速率很慢,远远小于二氧化碳的制取速率。因此可以用排水法收集,且收集到的气体较排空气法更纯净。
2.2 二氧化碳气体与氢氧化钠溶液反应的实验探究
二氧化碳与氢氧化钠溶液的反应没有明显的实验现象,中学往往通过压强变化证明反应确实发生了。通常的做法是在一个充满二氧化碳的矿泉水瓶中加入适量的氢氧化钠溶液,迅速盖紧瓶盖。振荡溶液,发现瓶变瘪由此得出二氧化碳能与氢氧化钠反应,使瓶内压强变小,此实验成功的关键是要剧烈振荡矿泉水瓶。再现高考题中二氧化碳与氢氧化钠溶液的喷泉,也需振荡否则溶液液面上升很慢,甚至停止不动。为何二氧化碳与氢氧化钠的实验需要振荡呢?此外,经常会有学生提出疑问:矿泉水瓶变瘪会不会是由于二氧化碳溶解在水中的缘故呢?为了解释这些问题,笔者用压强传感器监测一定时间内二氧化碳与氢氧化钠在不振荡和振荡条件下的压强变化,并与二氧化碳溶于水的压强变化作比较。
2.2.1 基于压强传感技术验证二氧化碳气体与氢氧化钠溶液的反应
用排水法收集较纯净的二氧化碳气体于集气瓶中,迅速加入20mL 2 mol/L的氢氧化钠溶液立即盖上附有传感器的橡皮塞,在室温(15℃)下通过压强传感器测定集气瓶中压强变化,具体步骤与二氧化碳在水中的溶解速率实验相同。
采集前两分钟的数据,选取不同时段(0~54s、55~61s)数据分别做拟合图线方程(1、2):P1=-0.1695t+99.27;P2=-1.684t+181.1,得到如图3所示的“压强-时间”曲线。
计算与讨论:0~54秒曲线斜率基本不变,ν1=4.25×10-3 mol/(L·min);54秒后不断振荡集气瓶,压强急剧下降,55~61秒内ν2=4.22×10-2 mol/(L·min);由于二氧化碳的消耗斜率逐渐减小。无论振荡与否,二氧化碳在氢氧化钠溶液中的溶解速率均大于其在相同条件下在水中的溶解速率9.06×10-5 mol/(L·min),说明二氧化碳在氢氧化钠溶液中不仅仅是溶解,还发生了化学反应。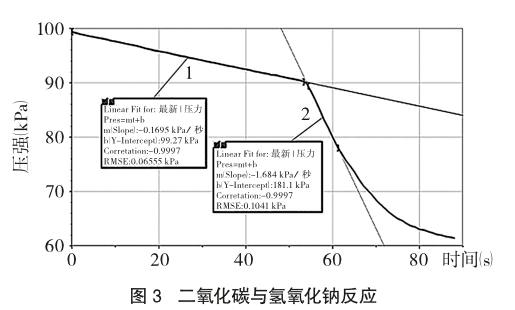
从图中也可以明显看出,在不振荡的情况下二氧化碳与氢氧化钠溶液的反应速率仍较慢,振荡后反应速率显著提高。这是由于二氧化碳是一种非极性分子,溶于水这种极性溶剂中的速率较慢,因此难以快速与氢氧化钠发生反应。而振荡可以增加二氧化碳这一气相与溶液相的接触,从而提高反应速率。
结论:二氧化碳与氢氧化钠溶液混合后压强变小不仅仅是溶于水所造成的,还发生了化学反应。在通常情况下,氢氧化钠吸收二氧化碳的速率较慢,在振荡的情况下可以快速反应。因此做好矿泉水瓶中二氧化碳气体和氢氧化钠溶液反应的实验、二氧化碳气体和氢氧化钠溶液的喷泉实验,振荡是成功的关键。
2.3 二氧化碳气体与碳酸钠溶液反应的实验探究
在二氧化碳与氢氧化钠反应后的溶液中继续通入二氧化碳仍能发生化学反应。为了证明产物碳酸钠也能与二氧化碳反应,有些教师用饱和碳酸钠溶液和二氧化碳反应,试图使碳酸氢钠晶体析出,但实验难以成功,一般解释是二氧化碳气体中有酸雾,但洗尽酸雾后也难成功。通过本研究中的两个实验可以知道通常情况下水和氢氧化钠溶液对二氧化碳的吸收速率都很慢,更不用说饱和碳酸钠溶液了,因此难以析出碳酸氢钠晶体的关键原因也是反应速率慢。二氧化碳气体大部分没参与反应便从溶液中逸出,如要有晶体析出需生成较多的碳酸氢钠并达到饱和状态,因此很难在短时间内观察到有晶体的析出[7]。用传统的实验手段也很难观察到压强的变化,而通过压强传感器就能在短时间内验证这一反应的发生。
2.3.1 基于压强传感技术验证二氧化碳气体与饱和碳酸钠溶液的反应
实验步骤与二氧化碳在水中的溶解速率实验相同,仅将水换成20mL饱和碳酸钠溶液。
采集前两分钟数据,集气瓶内压强逐渐减小,一分钟后不断振荡集气瓶,曲线斜率增大,得到如图4所示的“压强-时间”曲线。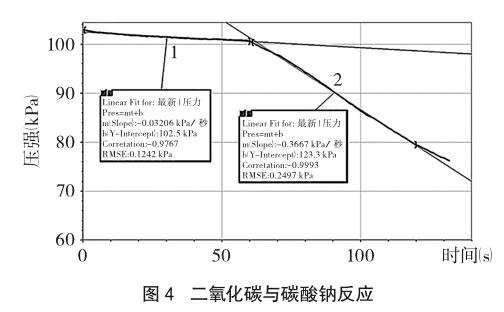
选取不同时段(0~60s、61~120s)数据分别做拟合图线方程(1、2):P1=-0.03206t+102.5;P2=-0.3667t+123.3。计算得到ν1=8.03×10-4 mol/(L·min),ν2= 9.19×10-3 mol/(L·min),均大于相同条件下二氧化碳在水中的溶解速率9.06×10-5 mol/(L·min),说明二氧化碳在碳酸钠溶液中不仅仅是溶解,还发生了化学反应,振荡可以提高反应速率。
结论:利用压强传感技术可以在较短的时间内观察到二氧化碳与饱和碳酸钠反应的压强变化,证明二氧化碳确实能与碳酸钠发生化学反应。
3 小结
数字化信息实验最大的优势在于,化学反应虽然在短时间内完成了,但是学生在观察到现象的同时得到了观察不到的实验数据。通过对这些数据的分析可以解释很多传统实验无法解释的问题,做到用数据说话,扫除学生理解上的障碍,同时也提高了对数据、图像的分析能力。借助压强传感器的数字化实验,基本能够涵盖大部分中学化学及物理学科中所涉及到的气体的实验,如催化剂对化学反应速率的影响、影响化学反应速率的因素、气体摩尔体积的测定等。遗憾的是,由于选取传感器种类单一所限,部分中学化学实验尚不能用本装置完成。如今,传感技术在国内中学教育领域尚未普及,谨以此探索其应用的可能性与优势。
参考文献:
[1] Robert F. Tinker,Joseph S. Krajcik. Portable Technologies: Science Learning in Context [M]. New York: Kluwer Academic Plenum Publishers,2001.
[2]陆惠莲. DIS数字化系统在高中化学实验创新设计中的应用[J].中国现代教育装备,2013,(16):18~21.
[3]姚子鹏主编.九年义务教育课本·化学(九年级)(第一学期)[M].上海:上海教育出版社,2007:117.
[4]郁学梅.实验室二氧化碳气体的收集及检测方法再研究[J].化学教学,2014,(7):65~66.
[5]夏梅芳.基于数字化实验的化学探究实验教学案例[J].化学教学,2013,(3):60~61.
[6]孙成林.用重量法测定大理石和盐酸反应速率的实验设计[J].化学教学,2013,(4):58~59.
[7]伍强.饱和碳酸钠溶液和二氧化碳气体反应实验的研究[J].化学教学,2014,(11):56~57.

