载体介导的RNA干扰技术抑制肝癌细胞中糖原合成酶激酶3β表达的研究
张娜,刘璐,窦玥莹,王真,宋丹青,李电东,邓洪斌
载体介导的RNA干扰技术抑制肝癌细胞中糖原合成酶激酶3β表达的研究
张娜,刘璐,窦玥莹,王真,宋丹青,李电东,邓洪斌
目的 构建和筛选能高效、特异性抑制人 GSK-3β基因表达的 siRNA表达载体,探讨其对肝癌细胞增殖和凋亡的影响。
方法 提取人 L02细胞总 RNA,RT-PCR扩增 GSK-3β基因序列,克隆至 pSEB-HUS真核表达载体,构建 pSEB-G重组质粒。将设计、合成的 3条靶向 GSK-3β基因编码区的siRNA及阴性对照分别克隆至pSEB-G,构建siRNA表达载体 pSEB-si1-G、pSEB-si2-G、pSEB-si3-G及 pSEB-siN-G。将 siRNA表达载体瞬时转染 HepG2细胞,通过绿色荧光信号、RT-PCR和 Western blot观察和检测其对 GSK-3β基因的抑制效果,MTT实验和 caspase-3活性分析检测其对 HepG2细胞增殖和凋亡的影响。
结果 经双酶切及测序证实,所构建 siRNA表达载体目的基因大小、序列与预期相符。瞬时转染 HepG2细胞后,其中的 pSEB-si1-G能使细胞中绿色荧光信号明显减少,可显著抑制 GSK-3β mRNA的表达及蛋白的合成,并使 HepG2细胞增殖明显降低,caspase-3活性显著升高。
结论 成功构建了靶向 GSK-3β基因的 siRNA表达载体,沉默 GSK-3β能显著抑制 HepG2细胞的生长并诱导其发生凋亡。
糖原合成酶激酶 3β; RNA干扰; 癌,肝细胞; siRNA表达载体
糖原合成酶激酶 3β(glycogen synthase kinase-3β,GSK-3β)是一种多功能的丝氨酸/苏氨酸激酶,在肝细胞等真核细胞中广泛存在,于 20世纪 70年代末被发现和鉴定[1-2]。GSK-3β定位于染色体 3q13.3,主要由氨基端、激酶区和羧基端 3个结构域组成,其参与胰岛素、Wnt、Hedgehog以及Notch等多种信号传导通路,在调控细胞的增殖、分化、凋亡以及肿瘤发生等方面都发挥重要作用[3]。GSK-3β活性的紊乱促进包括肿瘤在内的多种疾病的发生和发展[4-5]。
研究发现,GSK-3β在多种肿瘤中具有促进肿瘤生长的作用。如在 90%肾癌细胞核中发现存在GSK-3β的异常聚集,抑制 GSK-3β活性后可显著降低肾癌细胞的增殖与存活[6]。GSK-3β还可促进急性骨髓性白血病(AML)的发生[7]。在胰腺癌中也存在 GSK-3β的高表达,其通过激活 IKK-NF-κB通路促进胰腺癌细胞的存活[8]。因此,GSK-3β已成为众多肿瘤防治的一个新靶标[9]。
目前有关 GSK-3β在肝癌发生发展中的作用还不明确。本实验拟通过构建、设计抑制 GSK-3β基因表达的 siRNA载体,在肝癌细胞 HepG2中表达靶向 GSK-3β的 siRNA分子,观察不同siRNA分子对 GSK-3β的抑制效果及其对肝癌细胞增殖能力和凋亡的影响,初步探讨 GSK-3β在肝癌形成中的作用。
1 材料与方法
1.1 材料
1.1.1 质粒和细胞 pSEB-HUS siRNA表达载体(图 1)[10]由美国芝加哥大学 Tong-chuan He教授惠赠。大肠杆菌 DH5α、人正常肝细胞 L02、肝癌细胞株 HepG2由本实验室保存。
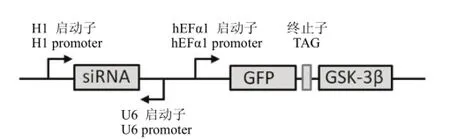
图1 siRNA表达载体构建示意图Figure 1 Schematic diagram of siRNA expression vector construction
1.1.2 主要试剂 细胞总 RNA提取试剂盒、RT-PCR试剂盒、T4 DNA连接酶、限制性内切酶、PCR产物纯化试剂盒、胶回收试剂盒等购自大连宝生物公司;DMEM高糖培养基和胎牛血清购自美国 Hyclone公司;caspase-3底物 DEVD-AFC、GSK-3β抗体、β-actin抗体和羊抗兔或小鼠二抗购自美国 Santa Cruz公司;GenEscort II转染试剂购自南京慧基生物技术有限公司;PVDF膜购自美国Millipore公司;ECL Plus超敏免疫印迹检测试剂盒购自美国 Bio-Rad公司;MTT购自美国 Sigma公司;β-半乳糖苷酶检测试剂盒购自美国 Promega公司;其他试剂均为国产分析纯。
1.1.3 仪器 Berthold LB942荧光检测仪为德国伯托公司产品;ChemiImager 5500凝胶成像系统为美国 Alpha公司产品。
1.2 方法
1.2.1 人 GSK-3β基因的扩增
1.2.1.1 细胞总 RNA的提取 收集人正常肝细胞 L02,裂解后用细胞总 RNA抽提试剂盒提取总RNA,1%琼脂糖凝胶电泳,–80℃ 保存。
1.2.1.2 RT-PCR 根据 GenBank中人 GSK-3β基因序列(NM_001146156),设计正向和反向引物,其中正向引物含 Bgl II酶切位点(5'GAAGATCTA TGTCAGGGCGG CCCAGAACCA 3')、反向引物含Xho I酶切位点(5'CCGCTCGAGTCAAGTGGAG TTGGAAGCTGATGC 3')。按照 Takara RNA PCR试剂盒说明进行 RT-PCR,逆转录条件为:37℃15 min,85℃5 s;PCR条件为:94℃ 变性 45 s,58℃ 退火 45 s,72℃ 延伸 2 min,共 30个循环。1%琼脂糖凝胶电泳观察后胶回收 1263 bp基因片段。
1.2.2 真核表达载体 pSEB-G的构建 用 Bgl II、 Xho I双酶切 PCR胶回收产物和真核表达载体pSEB-HUS,酶切产物经 1%琼脂糖凝胶电泳后胶回收,T4 DNA连接酶 18℃ 连接 3 h,转化感受态 DH5α大肠杆菌,氨苄青霉素抗性筛选,挑取阳性克隆,双酶切鉴定正确后送上海生物工程公司测序。阳性克隆载体命名为 pSEB-G。
1.2.3 siRNA真核表达质粒载体的构建
1.2.3.1 siRNA序列设计 利用 Ambion siRNA靶序列分析设计系统,分析人 GSK-3β基因的编码区(NM_001146156)序列,依据 siRNA靶序列设计原则,经 BLAST同源性分析,选择确定 3对靶序列,同时设计 1对阴性对照序列,由上海生物工程公司合成。设计的 siRNA及阴性对照序列见表1。
1.2.3.2 siRNA表达载体构建 将合成的 siRNA片段用 ddH2O配成终浓度为 1 μg/μl,100℃ 煮沸5 min后室温下慢慢冷却使之退火,再与经 Sfi I酶切的 pSEB-G质粒进行连接,进而分别将siRNA片段克隆进 pSEB-G载体中,经转化和氨苄青霉素抗性筛选后,用菌落 PCR的方法挑取阳性克隆:5'端使用H1(CCAGCTTAATTCGAACGC TGACGT)引物,3'端使用 sense siRNA引物,PCR条件为:94℃ 变性 30 s,50℃ 退火 30 s,72℃延伸 30 s,共 30个循环。菌落 PCR鉴定的阳性克隆质粒送上海生物工程公司测序,分别命名为pSEB-si1-G、pSEB-si2-G、pSEB-si3-G、pSEB-siN-G(阴性对照质粒)。
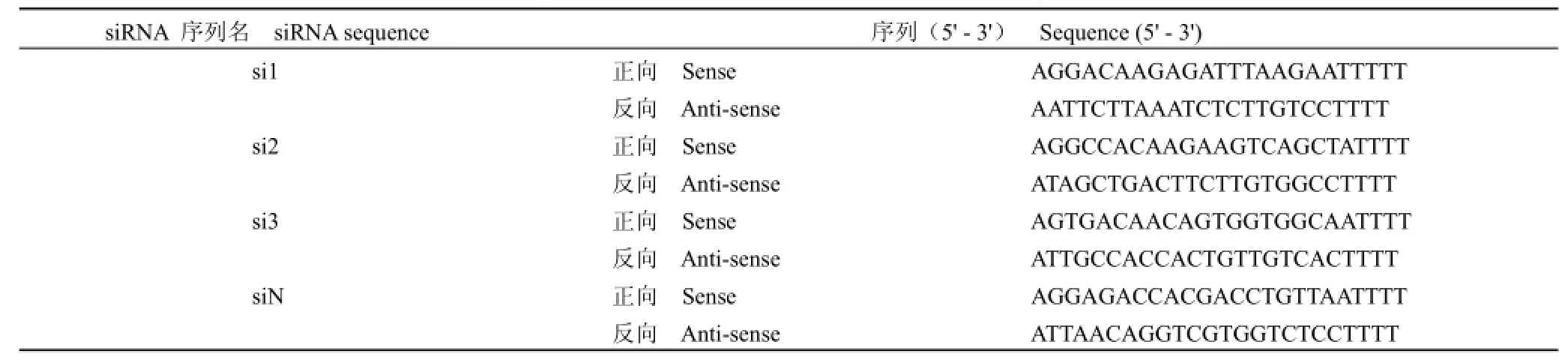
表1 3对 GSK-3β siRNA和阴性对照 siRNA序列Table 1 Sequences of three GSK-3β siRNAand one negative control
1.2.4 siRNA表达载体转染细胞 将 HepG2细胞接种于 6孔板,当细胞密度达 70%~80%时进行转染。将 6 μl GenEscort II转染试剂与 100 μl PBS混合,再将 1 μg siRNA表达载体与 100 μl PBS混合,然后将上述两种溶液轻轻混匀,室温放置 15 min后,加入到每孔含 400 μl DMEM 培养基的 6孔板中,37℃、5%CO2培养 6 h后,改用含10%FBS的新鲜DMEM培养基,连续培养48~72 h。
1.2.5 最佳 siRNA表达载体的筛选 分别将pSEB-si1-G、pSEB-si2-G、pSEB-si3-G及pSEB-siN-G质粒与 pCMV-β-galactosidase质粒用 GenEscort II共转染至对数生长期的 HepG2细胞,72 h后置荧光显微镜下观察荧光表达情况。为定量检测 GFP蛋白的荧光变化,将转染后的细胞裂解后用荧光检测仪进行测定,同时测定其 β-半乳糖苷酶活性,各孔的荧光数值与 β-半乳糖苷酶活性的比值即为GFP的荧光强度。
1.2.6 RT-PCR检测 GSK-3β mRNA水平变化 收集转染 72 h的细胞,用 Trizol试剂提取总 RNA。逆转录:取 HepG2细胞总 RNA 2 μg,oligo(dT)18引物 2 μl,DEPC水补足至 12.5 μl,70℃ 温育5 min,冰上冷却后依次加入 5×缓冲液 5 μl、2.5 μl 10 mmol/L dNTP、M-MLV逆转录酶 1 μl,42℃ 温育 60 min,进行 cDNA第一链的合成,95℃5 min终止反应。PCR:以 β-actin作为内参对照,检测GSK-3β基因表达水平变化。GSK-3β上游引物:5'ATTTCCAGGGGATAGTGGTGT 3',下游引物:5'GGTCGGAAGACCTTAGTCCAAG 3';β-actin上游引物:5'GGCTGTATTCCCCTCCATCG 3',下游引物:5'CCAGTTGGTAACAATGCCATGT 3'。
1.2.7 Western blot 将细胞用细胞刮刀刮下,1200×g离心收集细胞。加入适量裂解液(50 mmol/L Tris-HCl pH 7.5、1%Triton-100、150 mmol/L NaCl、2 mmol/L EDTA、1 mmol/L NaVO3、50 mmol/L NaF、1 mmol/L PMSF、1 mg/ml抑肽酶、1 mmol/L亮抑酶肽),冰浴 30 min后,14 000×g离心 15 min,收集上清即为蛋白提取液。用标准 Bradford方法测定样品的蛋白浓度。于 12%SDS聚丙烯酰胺凝胶电泳分离蛋白,半干法将蛋白转至 PVDF膜。转膜结束后,将其放入含 5%脱脂奶粉的 TBST (20 mmol/L Tris-HCl、150 mmol/L NaCl、0.1%吐温-20,pH 7.6)中振荡封闭 1 h,再与 GSK-3β或β-actin一抗溶液(1∶1000稀释)4℃ 孵育过夜,之后用 TBST洗膜 3次,与辣根过氧化物酶标记的二抗溶液(抗兔二抗 1∶2000稀释、抗鼠二抗1∶5000稀释)在室温孵育 1~2 h后,TBST洗膜3次,按照 ECL Plus免疫试剂盒说明书进行显色,通过 ChemiImager 5500凝胶成像系统捕获并分析图像。
1.2.8 MTT法检测 HepG2细胞增殖的变化 取对数生长期 HepG2细胞制备单细胞悬液,以 6× 103个/孔细胞密度接种于 96孔板,每组设置 6个复孔,同时设空白对照(仅加培养液)。待细胞密度达到 50%左右,转染相应的 siRNA表达质粒,分别于转染 1~5 d后,每孔加入 20 μl(5 mg/ml)MTT溶液,继续培养 4 h,每孔加入 150 μl DMSO,振荡 10 min,使紫色结晶充分溶解,酶标仪检测各孔吸光度(A570)值。
1.2.9 caspase-3活性分析检测 HepG2细胞凋亡的变化 按照本实验室发表的方法[11]检测细胞中caspase-3的活性。HepG2细胞转染相应的 siRNA表达质粒 72 h后,收集细胞。加入细胞裂解液冰浴 30 min后,14 000×g离心 15 min收集上清。分别将 50 μg上清与 10 μg DEVD-AFC底物加到 1 ml反应液(12 mmol/L HEPES、2.5 mmol/L EDTA、1 mmol/L DTT和 0.1%CHAPS)中,37℃温育 2 h后,荧光光度计读取相应数值,激发波长400 nm 和发射波长 505 nm 读数的比值代表caspase-3活性。
1.3 统计学处理
每次试验至少重复 3次,实验结果采用 t检验进行统计分析,各组数据采用± s 表示,P< 0.05为差异有统计学意义。
2 结果
2.1 GSK-3β RT-PCR扩增结果
提取 L02细胞总 RNA,进行 RT-PCR,扩增产物经 1%琼脂糖凝胶电泳后,在约 1263 bp处呈现特异性目的条带,与人 GSK-3β基因的编码区大小相符(图 2)。
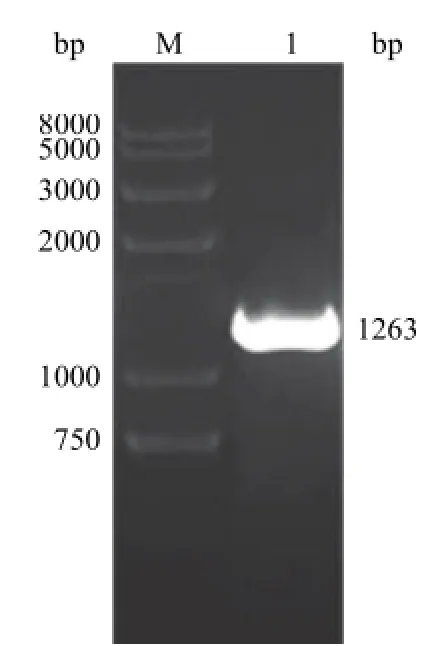
图2 人 GSK-3β基因的 RT-PCR结果Figure 2 RT-PCR result of human GSK-3β
2.2 pSEB-G重组质粒的构建及鉴定
重组 pSEB-G质粒经 Bgl II、Xho I双酶切后,得到 1条约 1263 bp的目的条带及线性空载体条带,而空载体 pSEB-HUS经双酶切后仅有一条线性条带(图 3)。此外,重组 pSEB-G质粒靶基因的测序结果与 GenBank中人 GSK-3β基因序列(NM_001146156)完全一致。以上结果表明,含人 GSK-3β基因的重组质粒 pSEB-G构建成功。
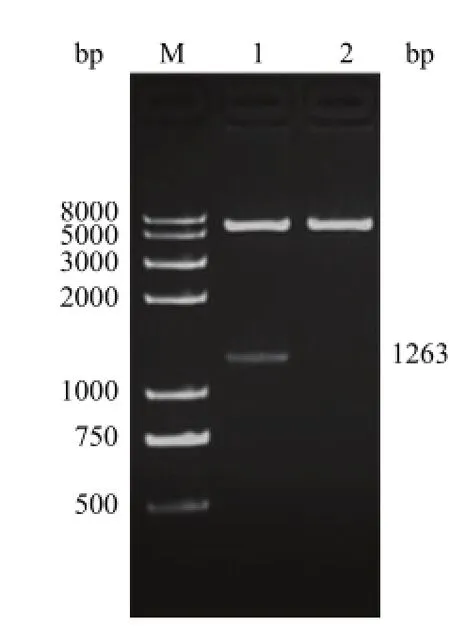
图3 pSEB-G重组质粒的 Bgl II、Xho I双酶切鉴定结果Figure 3 Bgl II and Xho I double digestion result of recombinant plasmid pSEB-G
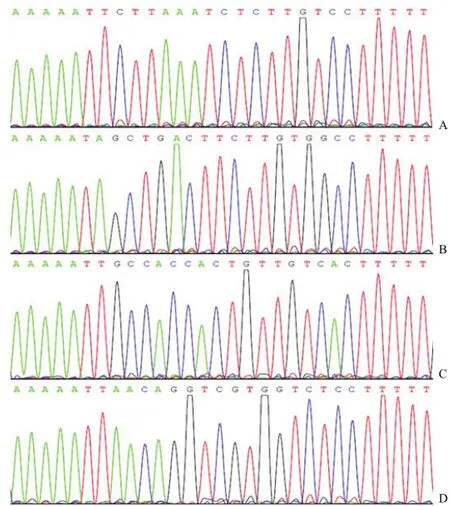
A:pSEB-si1-G;B:pSEB-si2-G;C:pSEB-si3-G;D:pSEB-siN-G
2.3 siRNA表达载体的构建
将合成好的 siRNA退火后,与 Sfi I酶切后的pSEB-G质粒进行连接,转化 DH5α,挑取克隆进行菌落 PCR,对菌落 PCR出现目的条带的克隆进行 DNA序列测定,均得到与设计一致的阳性克隆(图 4)。表明靶向 GSK-3β的 siRNA表达载体pSEB-si1-G、pSEB-si2-G、pSEB-si3-G以及阴性对照载体 pSEB-siN-G构建成功。
2.4 siRNA表达载体转染 HepG2细胞后 GFP绿色荧光蛋白的表达差异
分别将 pSEB-si1-G、pSEB-si2-G、pSEB-si3-G、pSEB-siN-G和 pSEB-G质粒用 GenEscort II瞬时转染 HepG2细胞,72 h后在荧光显微镜下观察绿色荧光蛋白表达情况,并定量检测 GFP荧光强度的变化(图 5)。结果表明,与对照组相比,pSEB-si1-G转染组的绿色荧光信号(31.6%)明显弱于其他组,pSEB-si3-G转染组的绿色荧光信号(62.7%)也有所减弱,而 pSEB-si2-G转染组的绿色荧光信号(84.2%)则变化不大,说明 pSEB-si1-G 对 GSK-3β的干扰效果最好。
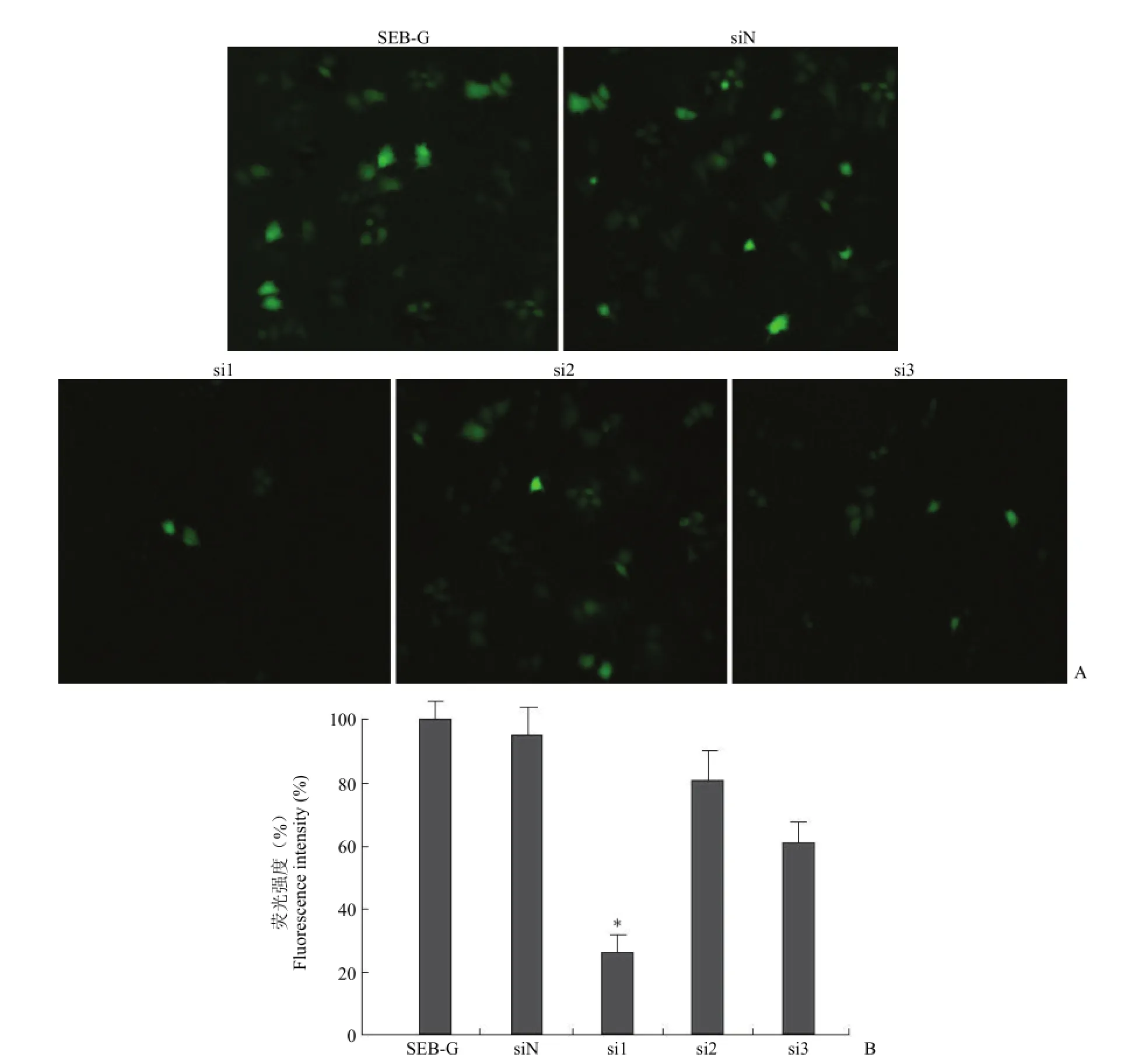
A:分别将等量的 pSEB-G、pSEB-siN-G、pSEB-si1-G、pSEB-si2-G或 pSEB-si3-G质粒转染 HepG2细胞,72 h后荧光显微镜观察 siRNA对 GFP蛋白表达的抑制情况;B:将等量的 pSEB-G、pSEB-siN-G、pSEB-si1-G、pSEB-si2-G或 pSEB-si3-G质粒与 pCMV-β-galactosidase质粒共转染HepG2细胞,72 h后裂解并收集细胞,定量测定荧光强度,各孔的转染效率用 β-半乳糖苷酶活性进行检测(*P<0.05)A:HepG2 cells were transfected with an equal amount of pSEB-G,pSEB-siN-G,pSEB-si1-G,pSEB-si2-G or pSEB-si3-G plasmids,the inhibition of GFP expression by siRNAs was recorded at 72 h under a fluorescence microscope;B:HepG2 cells were transfected with an equal amount of pSEB-G,pSEB-siN-G,pSEB-si1-G,pSEB-si2-G or pSEB-si3-G plasmids,along with pCMV-β-galactosidase.At 72 h,the transfected cells were lyzed and subjected to fluorescence measurement.Transfection efficiency was normalized with β-galactosidase activity(*P<0.05)
2.5 siRNA对 GSK-3β mRNA和蛋白的影响
RT-PCR结果表明,转染 siRNA表达载体的HepG2细胞中 GSK-3β mRNA的表达均受到不同程度抑制(图 6A)。其中 pSEB-si1-G转染组的抑制效果最强,达到几乎完全抑制的效果;pSEB-si3-G转染组也有抑制作用;pSEB-si2-G转染组的抑制效果最差。而阴性对照组和转染空载体的 HepG2细胞中都存在较高水平的 GSK-3β mRNA表达。
Western blot结果表明,转染空载体和阴性对照组的 HepG2细胞中 GSK-3β蛋白呈现高表达,GSK-3β蛋白印迹出现在 47 kD处,与人 GSK-3β相对分子质量一致;而转染 pSEB-si1-G、pSEB-si2-G 和 pSEB-si3-G的实验组细胞中,GSK-3β蛋白的表达均受到抑制(图 6B)。其中 pSEB-si1-G的抑制作用要优于其他两个,GSK-3β蛋白的表达下降90% 以上。以上结果说明 pSEB-si1-G为可高效抑制 GSK-3β mRNA和蛋白表达的 siRNA表达载体。
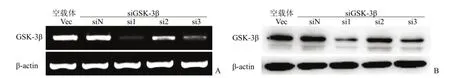
图6 不同 siRNA对 GSK-3β的干扰效果Figure 6 Knockdown efficiency of siRNAs on GSK-3β
2.6 干扰GSK-3β的表达能有效抑制 HepG2细胞的增殖
将靶向 GSK-3β的 siRNA表达质粒转染细胞后,用 MTT法检测细胞增殖情况,用酶联免疫检测仪检测各孔的吸光度,以时间作为横坐标,吸光度值作为纵坐标绘制生长曲线。结果显示:与对照组细胞相比,转染 pSEB-si1-G和 pSEB-si3-G的实验组细胞的增殖均受到抑制,其中 pSEB-si1-G组的抑制作用要优于 pSEB-si3-G组(图 7)。
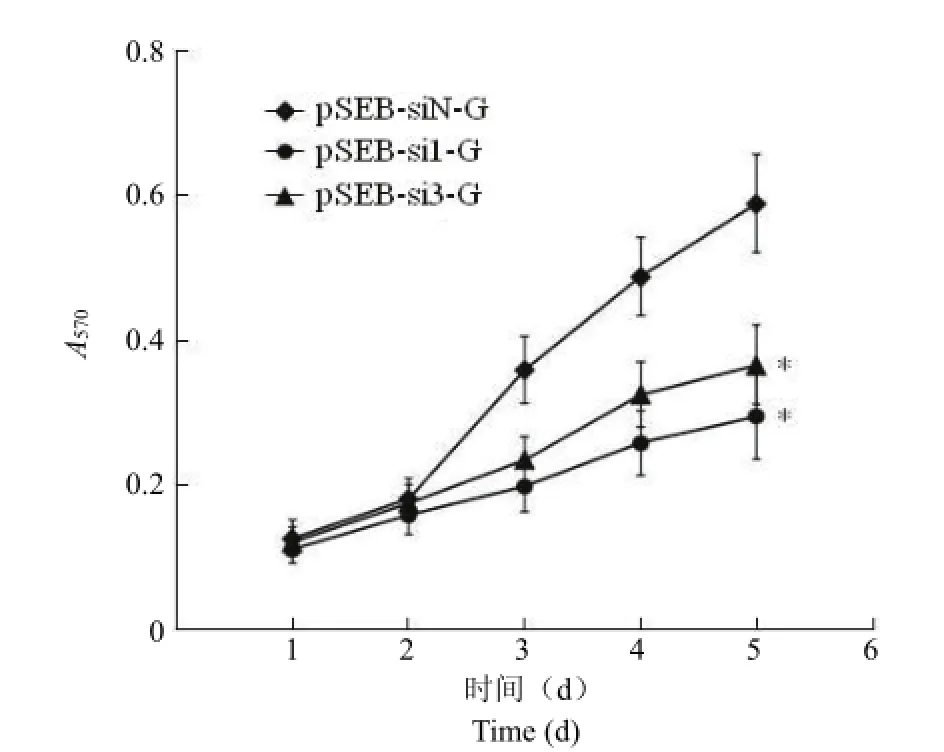
图7 GSK-3β siRNA对 HepG2细胞增殖的影响(*P<0.05)Figure 7 Effect of GSK-3β siRNAs on HepG2 cell proliferation(*P<0.05)
2.7 干扰 GSK-3β的表达可诱导 HepG2细胞凋亡的发生
caspase家族在介导细胞凋亡的过程中发挥非常重要的作用,其中 caspase-3为关键的执行分子。caspase-3正常以酶原的形式存在于胞浆中,在凋亡的早期阶段,它被激活并最终导致细胞凋亡,但在细胞凋亡的晚期和死亡细胞中,caspase-3的活性明显下降。将表达 pSEB-si1-G、pSEB-si3-G和 pSEB-siN-G的 siRNA表达质粒转染 HepG2细胞后,收集细胞检测 caspase-3活性的变化。结果显示,与对照组相比,转染 pSEB-si1-G、pSEB-si3-G 组 HepG2细胞中 caspase-3活性均上升,其中pSEB-si1-G组上升更为明显,说明 pSEB-si1-G可显著诱导 HepG2细胞发生凋亡(图 8)。
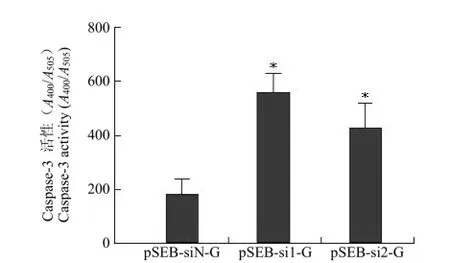
图8 GSK-3β siRNA对 HepG2细胞 caspase-3活性的影响(*P<0.05)Figure 8 Effect of GSK-3β siRNAs on the caspase-3 activity of HepG2 cell(*P<0.05)
3 讨论
RNA干扰(RNAi)是指内源性或外源性双链RNA(double-stranded RNA,dsRNA)导致细胞内同源mRNA发生特异性降解的过程[12]。RNAi作为一种新型的基因沉默工具,因其具有高效性、高特异性和低毒性等优点,已成为从基因到功能的反向遗传学研究的热门首选。小分子干扰 RNA (siRNA)的制备方法包括化学合成、体外合成、RNase III酶切 dsRNA、siRNA表达载体以及siRNA表达框架,不同方法适合不同的研究方法和目的。其中 siRNA表达载体法可以在细胞中持续抑制靶基因的表达[13],已逐渐成为进行 RNAi研究的首选。本实验中,我们选用的是芝加哥大学医学中心 Tong-chuan He教授构建的高效筛选 siRNA的质粒表达载体 pSEB-HUS。其含有 GFP与目的基因的嵌合转录子,使 siRNA对目的基因的沉默效率直接影响 GFP蛋白的表达,siRNA对目的基因的沉默效果越明显,则 GFP蛋白的表达越弱[10],实现了对 siRNA靶序列的高效筛选。
一系列的研究表明,GSK-3β在许多肿瘤细胞和人类肿瘤组织中高表达[14]。随着与GSK-3β相互作用分子的不断发现,GSK-3β在肿瘤形成中的重要作用受到越来越多的关注。目前有关 GSK-3β在肝癌发生发展中的作用还不明确。本研究利用Ambion公司的 siRNA靶序列分析设计系统,设计了 3对以人 GSK-3β为目标基因的 RNAi新序列(均未见文献报道),成功构建了 siRNA表达载体 pSEB-si1-G、pSEB-si2-G和 pSEB-si3-G和1个阴性对照表达载体 pSEB-siN-G。将质粒转染入 HepG2细胞中,通过观察绿色荧光,pSEB-si1-G转染组绿色荧光信号明显弱于其他组,表明其对GSK-3β基因的抑制率最高,并可在 mRNA水平和蛋白水平抑制 GSK-3β的表达。siRNA与靶序列的结合与 mRNA的二级结构密切相关,靶向折叠程度较高区段设计的 siRNA序列可能很难与mRNA结合,其对目的基因的抑制效果就较差。本研究中 pSEB-si1-G对 GSK-3β的抑制效果要优于其他两个,很可能是因为它的靶序列所在区域的折叠程度不高,利于其与 GSK-3β mRNA的结合。
为了研究 GSK-3β是否对肝癌细胞的生长和生存发挥重要作用,我们利用构建好的 siRNA表达载体下调了肝癌细胞 HepG2中 GSK-3β的表达,并分别检测了细胞的增殖和凋亡情况。由于我们构建的 siRNA表达载体中含有 GFP表达元件,对Annexin V和 PI的荧光信号会造成一定的干扰,因此不适合用 Annexin V/PI双染法检测细胞凋亡。鉴于 caspase-3在早期凋亡中的重要作用,我们通过分析细胞中 caspase-3活性的变化来反映细胞凋亡的改变。结果表明,pSEB-si1-G抑制GSK-3β的表达后,可明显抑制 HepG2细胞的增殖,并促进细胞凋亡的发生。因此我们认为,GSK-3β的表达与肝癌细胞 HepG2的生长和生存密切相关,提示 GSK-3β可以作为肝癌基因治疗的有效靶点,有关 GSK-3β调控肝癌细胞生长和生存的具体机制还有待进一步的研究。
[1] DobleBW,WoodgettJR.GSK-3:tricksofthetradefora multi-tasking kinase.J Cell Sci,2003,116(Pt 7):1175-1186.
[2] Kaidanovich-Beilin O,Woodgett JR.GSK-3:functional insights from cell biology and animal models.Front Mol Neurosci,2011,4:40.
[3] Jope RS,Johnson GV.The glamour and gloom of glycogen synthase kinase-3.Trends Biochem Sci,2004,29(2):95-102.
[4] Amar S,Belmaker RH,Agam G.The possible involvement of glycogen synthase kinase-3(GSK-3)in diabetes,cancer and central nervous system diseases.Curr Pharm Des,2011,17(22):2264-2277.
[5] Deng H,Zhang N,Wang Y,et al.S632A3,a new glutarimide antibiotic,suppresses lipopolysaccharide-induced pro-inflammatory responses via inhibiting the activation of glycogen synthase kinase 3β. Exp Cell Res,2012,318(20):2592-2603.
[6] Bilim V,Ougolkov A,Yuuki K,et al.Glycogen synthase kinase-3:a new therapeutic target in renal cell carcinoma.Br J Cancer,2009,101(12):2005-2014.
[7] Banerji V,Frumm SM,Ross KN,et al.The intersection of genetic and chemical genomic screens identifies GSK-3α as a target in human acute myeloid leukemia.J Clin Invest,2012,122(3):935-947.
[8] Bang D,Wilson W,Ryan M,et al.GSK-3α promotes oncogenic KRAS function in pancreatic cancer via TAK1-TAB stabilization and regulation of noncanonical NF-κB.Cancer Discov,2013,3(6):690-703.
[9] Kawazoe H,Bilim VN,Ugolkov AV,et al.GSK-3 inhibition in vitro and in vivo enhances antitumor effect of sorafenib in renal cell carcinoma(RCC).Biochem Biophys Res Commun,2012,423(3): 490-495.
[10]Luo Q,Kang Q,Song WX,et al.Selection and validation of optimal siRNA target sites for RNAi-mediated gene silencing.Gene,2007,395(1-2):160-169.
[11]Deng H,Mao G,Zhang J,et al.IKK antagonizes activation-induced cell death of CD4+T cells in aged mice via inhibition of JNK activation.Mol Immunol,2010,48(1-3):287-293.
[12]ElbashirSM,HarborthJ,LendeckelW,etal.Duplexesof 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells.Nature,2001,411(6836):494-498.
[13]Huang PI,Lo WL,Cherng JY,et al.Non-viral delivery of RNA interference targeting cancer cells in cancer gene therapy.Curr Gene Ther,2012,12(4):275-284.
[14]Chiara F,Rasola A.GSK-3 and mitochondria in cancer cells.Front Oncol,2013,3:16.
Methods The cDNA of GSK-3β was amplified by RT-PCR from the total RNA of L02 cells,and then inserted into pSEB-HUS vector to generate pSEB-G plasmid.The synthesized siRNAs targeting the coding region of human GSK-3β were cloned into pSEB-G respectively,resulting in the pSEB-si1-G,pSEB-si2-G,pSEB-si3-G and pSEB-siN-G plasmids.These plasmids were transiently transfected into HepG2 cells,and the expression levels of GSK-3β were detected by green fluorescent signal,RT-PCR,and Western blot.The effects of siRNAs on proliferation and apoptosis of HepG2 cells were determined by MTT assay and caspase-3 activity assay.
Results All plasmids were successfully constructed as confirmed by restriction enzyme digestion and DNA sequencing.The pSEB-si1-G vector had the most significant knockdown effect on GSK-3β among the constructed plasmids.GSK-3β silencing resulted in marked decrease of proliferation and increase of caspase-3 activity in HepG2 cells.
Conclusion A siRNA expression vector targeting GSK-3β is successfully constructed and validated for its knockdown effect,and silencing of GSK-3β can significantly inhibit HepG2 cell proliferation and induce its apoptosis.
Vector-mediated RNAinterference of GSK-3β expression in hepatoma cell
ZHANG Na,LIU Lu,DOU Yue-ying,WANG Zhen,SONG Dan-qing,LI Dian-dong,DENG Hong-bin
Objective To construct a vector expressing siRNA targeting human GSK-3β gene and to investigate its effects on proliferation and apoptosis of HepG2 cells.
Glycogen synthase kinase 3β;RNAinterference;Carcinoma,hepatocellular;siRNAvector
DENG Hong-bin,Email:hdeng@imb.pumc.edu.cn
10.3969/cmba.j.issn.1673-713X.2015.02.007
北京协和医学院“协和青年基金”(3332013144);国家自然科学基金面上项目(81473248、81170326)
100050北京,中国医学科学院北京协和医学院医药生物技术研究所生化室
邓洪斌,Email:hdeng@imb.pumc.edu.cn
2014-09-02
www.cmbp.net.cn 中国医药生物技术,2015,10(2):131-138
Author Affiliation:Department of Biochemistry,Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences& Peking Union Medical College,Beijing 100050,China
www.cmbp.net.cn Chin Med Biotechnol,2015,10(2):131-138
——一道江苏高考题的奥秘解读和拓展

