新痹痛灵对小鼠免疫功能的影响
刘 晏,魏 刚,朱丰林,郭云柯,平 凡,景嵘月,陆兔林,郭海英,汪 悦
(南京中医药大学,南京210029)
新痹痛灵对小鼠免疫功能的影响
刘 晏,魏 刚,朱丰林,郭云柯,平 凡,景嵘月,陆兔林,郭海英,汪 悦*
(南京中医药大学,南京210029)
目的 观察新痹痛灵对小鼠免疫功能的影响。方法 将小鼠随机分为空白组、阳性药组、新痹痛灵低剂量组、新痹痛灵高剂量组,通过计算廓清指数,观察新痹痛灵对小鼠非特异性免疫方面的影响;采用血清溶血素试验法以及二硝基氯苯诱导的迟发型超敏反应试验法,观察新痹痛灵在特异性免疫方面的作用。结果 新痹痛灵能调整小鼠的碳粒廓清吞噬指数、减少血清溶血素抗体的生成、抑制迟发型超敏反应的发生。结论 新痹痛灵能不同程度的在非特异性免疫和特异性免疫两个方面有免疫抑制作用。
新痹痛灵;免疫功能;碳粒廓清;溶血素;迟发型超敏反应
新痹痛灵是从全国名老中医汪履秋教授治疗中医“痹证”(尤其是类风湿关节炎)的经验方变化而来,由朱丹溪上中下通用痛风方化裁,在结合了前期的实验及临床研究后总结而出[1-4]。为进一步研究新痹痛灵对免疫系统的调节机制,本实验分别从非特异性免疫和特异性免疫两个方面,对新痹痛灵进行了实验研究。报道如下。
1 材料与方法
1.1 动物 SPF级BALB/C、ICR雄性小鼠(血清溶血素试验使用ICR小鼠,其余试验采用BALB/C小鼠),体质量(20±2)g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXX(京)2012-0001。豚鼠(200±20)g,由南京市江宁区青龙山动物繁殖场提供,动物许可证号:SCXX(苏)2012-0008。实验动物均饲养在SPF级动物房,室内温度(22±1)℃,湿度(55±5)% ,12 h光暗循环。实验动物饲养时间均大于1周,其饲料和水在消毒后均由动物自由摄取。
1.2 药物、试剂与制备 新痹痛灵药材购于江苏省中医院门诊部药房,制作程序由南京中医药大学药学院研制,经江苏省中医院制剂部加工。具体提取方法:本方共6味药,取桂枝、防风用10倍量水浸泡2 h,水蒸汽蒸馏6 h,提取挥发油,收集挥发油、水提液及药渣以备用。取麻黄、青风藤用16倍量50%乙醇提取3次,每次2 h,合并醇提液,过滤、收集醇提液及药渣以备用。最后将以上4味药药渣合并另2味药一同加入20倍量水中,提取2次,2 h/次,合并水煎液,与之前备用的挥发油水提液合并,加乙醇至含醇量50% ,静置48 h,上清液与醇提液合并,减压回收乙醇至无醇味的清膏,折合原药材为每1g浸膏含生药量为10.75 g。雷公藤多苷片(浙江得恩德制药有限公司,生产批号1403111B)。
试剂及配置:印度墨汁,Solarbio公司生产,批号08C021;二硝基氯苯(简称DNCB),SIGMA公司生产,批号C3762;伊文斯蓝,SIGMA提供,批号E2129;30% BrijL23 solution,SIGMA公司生产,批号SLBH6355V;都氏试剂,SIGMA公司生产,批号SLBF9046V,临用时以1 VL∶1 000 mL双蒸水稀释成都氏溶液,然后加入0.5 mL的30%BrijL23溶液备用。
绵羊红细胞(SRBC,玉环县南方试剂厂生产,批号NF-242),临用前用生理盐水洗涤,2 000 r/min条件下离心5 min,弃用上清液,如此洗涤3次,最后以体积比3∶5用生理盐水稀释备用;豚鼠血清制备:取3只豚鼠血,离心后取血清,并在-20℃中保存,使用之前用生理盐水1∶10稀释。
1.3 仪器 酶标仪,PerKin Elmer生产,批号:23000353;HWS26型电热恒温水浴锅,上海一恒科技有限公司生产;5810型台式大容量高速离心机,德国eppendortf公司生产。
2 方法
2.1 分组与给药 雄性ICR小鼠分为空白组、阳性药组、痹痛灵低剂量组、痹痛灵高剂量组,每组10只,分别予生理盐水0.2 mL/10 g,雷公藤多苷片溶液0.012 g/kg,新痹痛灵浸膏溶液3.95、15.8 g生药/kg体质量。
2.2 对非特异性免疫功能的影响——碳粒廓清实验[5]连续给药7 d,末次给药30 min后,从小鼠尾静脉以0.1 mg/10 g体质量注射印度墨汁(印度墨汁用前以生理盐水稀释10倍),分别于0.5、6 min从右眼眶后静脉丛取血0.1 mL,再用移液器取25 μL溶于2 mL0.1%NA2CO3溶液中,充分洗出吸管壁附着之血液,摇匀。实验结束前取一空白小鼠血液25 μL,溶于2 mL 0.1%NaCO3液校零,酶标仪600 nm得出OD值即吞噬速率。最后将小鼠脱臼处死,分别称取肝脾重量,计算廓清指数K和吞噬指数α。
2.3 对特异性免疫功能的影响——溶血素实验[6]连续给药7 d,给药第1天后于BALB/C小鼠腹腔注射20%SRBC 0.2 mL/只,第7天给药后1 h眼眶取血,分离血清,以NS稀释200倍后供测定。反应管内依次加入经稀释的小鼠血清1 mL、5%SRBC 0.5 mL、10%豚鼠血清1 mL,对照管内1次加入生理盐水1 mL、5%SRBC 0.5 mL、10%豚鼠血清1 mL。两管均置于37℃恒温水浴中保温10 min,然后移至冰浴中终止反应,2 000 r/min离心10 min,取上清液1 mL加入3 mL都氏试剂;另取一管,加入4 mL都氏试剂和0.25 mL 5%SRBC,各试管摇匀放置10 min,酶标仪(540 nm分别测定各管吸收度值OD)。计算公式:HC 50=样品的吸光度值/SRBC半数溶血值×稀释倍数。
2.4 对特异性免疫功能的影响——迟发型超敏反应实验[7-8]首次给药后以脱毛剂去ICR小鼠背部颈毛,第2天用移液器在给药组颈部皮肤上滴50% DNCB丙酮溶液2 μL/只致敏;空白组涂PBS溶液作为对照。连续给药12 d,于末次给药后1 h,在脱毛后的小鼠腹部皮肤上用20 μL的2.5%DNCB丙酮溶液进行攻击;24 h后(第13天),按照0.01 mL/g的计量,给每只小鼠尾静脉注射1%的伊文斯蓝,注射30 min后,颈椎脱臼处死小鼠,取下腹部蓝染皮肤剪碎,置于试管中,用5 mL的1∶1丙酮生理盐水混合液浸泡,24 h后(第14天)以3 000 r/min离心10 min,取上清液处比色,酶标仪(610 nm)测吸光度OD值。
2.5 统计学方法 所有实验数据均用SPSS 19.0软件,组间比较采用χ2分析。
3 结果
3.1 碳粒廓清实验结果 见表1。
3.2 溶血素实验结果 见表2。
表1 新痹痛灵对小鼠廓清指数的影响(±s,n=10)

表1 新痹痛灵对小鼠廓清指数的影响(±s,n=10)
注:与空白组比较 ,#P<0.05
组 别 K值 α值#空白组 0.087±0.004 7.98±0.18阳性药组 0.059±0.008# 6.71±0.35#低剂量组 0.082±0.005# 7.44±0.13#高剂量组 0.068±0.004# 7.23±0.17
表2 新痹痛灵对绵阳红细胞所致小鼠溶血素抗体形成的影响(±s,n=10)
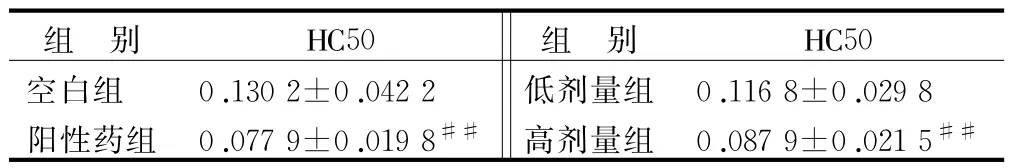
表2 新痹痛灵对绵阳红细胞所致小鼠溶血素抗体形成的影响(±s,n=10)
注:与空白组比较 ,#P<0.05,##P<0.01
组 别 HC50 组 别 HC50空白组 0.130 2±0.042 2 低剂量组 0.116 8±0.029 8##阳性药组 0.077 9±0.019 8## 高剂量组 0.087 9±0.021 5
3.3 迟发型超敏反应实验结果 见表3。
表3 新痹痛灵对DNCB所致小鼠迟发型超敏反应的影响(±s,n=10)

表3 新痹痛灵对DNCB所致小鼠迟发型超敏反应的影响(±s,n=10)
注:与空白组比较 ,#P<0.05
组 别 D(λ=610nm) 组 别 D(λ=610nm)空白组 0.1266±0.0172 低剂量组 0.0962±0.0121#阳性药组 0.0838±0.0191# 高剂量组 0.0836±0.0143#
4 讨论
血液中碳粒的消失速度可反应网状内皮系统吞噬异物的能力,从而证明其防御功能的强弱[9]。本实验选用碳粒廓清实验体现新痹痛灵对正常小鼠非特异性免疫功能的影响。印度墨汁作为异物颗粒注射入血,被单核吞噬细胞迅速吞噬清除[10]。廓清指数(K)网状内皮系统的巨噬细胞对异物的吞噬廓清能力和速度,吞噬指数(α)在排除了肝、脾重量对K值影响的情况下 ,反应了网状内皮系统的功能状态[11]。本实验结果表明,新痹痛灵低、高剂量均对正常小鼠的廓清指数有显著影响。
经绵羊红细胞免疫的小鼠,其淋巴细胞可产生特异性的抗绵羊红细胞抗体,然后释放至外周血[12]。抗体在体外与绵阳红细胞及补体一同温浴 ,可发生溶血反应 ,并释放出血红蛋白[13]。通过测定溶血过程中释放出的血红蛋白量可以计算出致敏动物血清中溶血素的含量。而红细胞的溶血程度又与抗体的含量呈正相关,故通过对上清液的光密度的测定,可间接测定抗体的数量[14]。结果表明,新痹痛灵低、高剂量均能降低血清溶血素含量,但高剂量的作用更为显著。
DNCB是一种半抗原,其稀释液可与小鼠腹部皮肤蛋白结合成完全抗原,从而刺激T淋巴细胞增殖成致敏淋巴细胞,DNCB诱导的DTH模型对研究细胞免疫有重要意义[15-16]。本实验在致敏12 d后进行抗原攻击,将DNCB涂抹在皮肤,一般24~48 h反应达到高峰 ,用比色法对皮片的吸光度进行比较[17]。实验结果表明,新痹痛灵能明显抑制小鼠迟发型超敏反应,说明新痹痛灵对T淋巴细胞介导的特异性细胞免疫有一定抑制作用。
[1]景嵘月.新痹痛灵颗粒剂治疗类风湿关节炎寒湿痹阻证的临床研究[D].南京:南京中医药大学,2012.
[2]李广清 ,汪悦,夏卫军 .痹痛灵抗炎作用处方筛选正交 t值法实验研究[J].时珍国医国药,2006,17(11):2159-2160.
[3]李爱民,汪悦.痹痛灵拆方剂量的正交 t值法实验研究[J].实用中西医结合临床,2008,8(1):86-87.
[4]李爱民.痹痛灵拆方及其最优方对Ⅱ型胶原关节炎小鼠治疗作用的研究[D].南京:南京中医药大学,2007.
[5]王梦月,卫莹芳,史焱.荨麻多糖药理作用初步研究[J].中药材,2001,24(9):666-667.
[6]冯志毅,杨梦,白义萍,等.桑白皮化学拆分组分免疫调节作用研究[J].世界科学技术:中医药现代化,2014,16(9):1968-1973.
[7]龚晓健 ,季晖,卢顺高,等.人工虫草多糖对小鼠免疫功能的影响[J].中国药科大学学报 ,2000,13(1):55-57.
[8]李丽,肖永庆,刘颖,等 .五味子酸性组分的主要物质基础与生物活性研究[J].中国实验方剂学杂志 ,2014,20(6):70.
[9]罗新舟,孙江桥.复方黄芪合剂对小鼠免疫功能影响[J].辽宁中医药大学学报,2014,16(1):21-22.
[10]杨廷彬,尹学念.实用免疫学[M].长春:长春出版社,1994.
[11]高丽松,曾凡潘,宁榴贤,等.磁处理党参药液对小白鼠碳粒廓清功能影响的研究[J].生物磁学,2004,4(4):1-4.
[12]孟达理,严士海,许芝银.麻黄多糖对绵羊红细胞所致小鼠溶血素生成的影响[J].江苏大学学报(医学版),2007,17(5):379-380,385.
[13]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:757-759.
[14]韦翠萍,刘丹丹,唐立海,等.牛大力对小鼠免疫功能的影响[J].广州中医药大学学报 ,2009,26(6):539-542.
[15]熊颖,刘启德 ,宓穗卿 .苍耳子系统溶剂法免疫抑制活性初步研究[J].中药材,2005,28(10):938-940.
[16]李覃,陈虹,白淑芳,等.青蒿琥酯对迟发型超敏反应小鼠脾脏T淋巴细胞的免疫调节作用[J].中国组织工程研究,2012,16(5):843-846.
[17]张云璧 ,瞿幸,任映,等 .犀角(水牛角)地黄汤对急性皮炎及变态反应性皮炎动物模型作用的实验研究[J].中国实验方剂学杂志 ,2008,14)3):61-62,65.
Xinbitongling on mice immune function
LIU Yan,WEI Gang,ZHU Fenglin,GUO Yunke,PING Fang,JING Rongyue,LU Tulin,GUO Haiying,WANG Yue*
(Nanjing University of Chinese Medicine,Nanjing 210029,China)
Objective To observe the effect of the New Bitongling on immune regulation in mice.Methods Mice are randomly divided into blank group,positive drug group,low dose of New Bitongling group and high dose of New Bitongling.Through calculating phagocytic index,effects of New Bitongling on non-specific immunomodulating effects on mice are observed.Hemolysin test and dinitrofluorobenzene-induced delayed type hypersensitivity test(DTH)are used to observe effects of New Bitongling on non-specific immunomodulating effects on mice.Results The New Bitongling Compound can decrease the index the number of K and α,reduce the generation of serum hemolysin antibody,and inhibit dinitrofluorobenzene-induced delayed type hypersensitivity reaction.Conclusion The New Bitongling Compound can suppress the two aspects of nonspecific immunity and specific immunity in mice in different degree.
Xinbitongling;immunologic function;carbon clearance test;hemolysin;DTH
R285.5
A
2095-6258(2015)05-0908-03
10.13463/j.cnki.cczyy.2015.05.009
2015-02-04)
国家中医药管理局中医痹病学重点学科开放基金资助项目(BBXK2013106);康缘中医药科技创新项目计划(KZ1003KY)。
刘 晏(1989-),女,硕士研究生,主要从事中医内科学风湿免疫临床研究。
*通信作者:汪 悦,男,教授,博士研究生导师,电子信箱-wangyuephd@126.com

