铂类化疗药对儿童实体瘤听觉影响的研究
王生才马晓莉周怡唐力行陈敏张杰刘海红邰隽刘原虎倪鑫
1首都医科大学附属北京儿童医院耳鼻咽喉头颈外科 儿童耳鼻咽喉头颈外科疾病北京市重点实验室(北京,100045)
2首都医科大学附属北京儿童医院血液肿瘤中心儿科学国家重点学科(北京,100045)
铂类化疗药对儿童实体瘤听觉影响的研究
王生才1马晓莉2周怡1唐力行1陈敏1张杰1刘海红1邰隽1刘原虎1倪鑫1
1首都医科大学附属北京儿童医院耳鼻咽喉头颈外科儿童耳鼻咽喉头颈外科疾病北京市重点实验室(北京,100045)
2首都医科大学附属北京儿童医院血液肿瘤中心儿科学国家重点学科(北京,100045)
目的观察铂类药物在实体瘤儿童化疗过程中对听力的影响,考察铂类化疗药导致听力损伤的相关危险因素。方法回顾性分析于2014年1月至2015年4月在北京儿童医院血液肿瘤中心进行化疗的实体瘤儿童临床资料,所有患儿化疗过程中均使用铂类化疗药,分别在第1、3、6次化疗前进行规范听力学检查,包括纯音测听、畸变产物耳声发射和听性脑干反应。结果共纳入0.2-12.5岁实体瘤患儿47名,共计94耳,进行化疗的平均次数为5.4次(3-10次)。ABR检查中以任意一耳听阈大于30dB nHL为听力损伤,第6疗程听力异常发生率为6.4%(6/94),与基线水平对比,差异有统计学意义(p<0.05)。第3、6疗程ABR阈值与基线水平相比,ABR阈值明显升高,均有显著统计学差异(p<0.001);PTA检查中第6疗程6kHz、8kHz测听结果与基线水平相比均有统计学差异(p<0.05),相应阈值明显提高;DOPAE提示第6疗程6kHz、8kHz,通过率明显下降,与基线水平比较有显著统计学差异。Logistic回归模型中年龄是铂类药物耳毒性的危险因素,(p<0.05,OR值=0.912),提示年龄越小铂类药物的耳毒性越易显现。结论铂类药物用于儿童实体肿瘤化疗可引起听力损伤,在高频部分(6-8 kHz)尤为显著。DOPAE、纯音测听及ABR可作为监测、评价铂类药物耳毒性的重要指标。儿童年龄越低则铂类药物引起听力损伤的危险越大,低龄儿童使用铂类药物时更需加强听力监测。
铂类药物;听力化疗;儿童实体瘤
铂类化疗药发展至今,主要包括顺铂、卡铂和奥沙利铂,其中顺铂和卡铂已成为儿童实体肿瘤的一线化疗药物。根据以往的研究,铂类化疗药在发挥广谱抗癌作用的同时,可导致双耳不可逆的感音性神经性听力损害。儿童处于语言、智力发育的关键时期,因此,药物对听力的损害尤其需要重视[1]。
铂类化疗药的耳毒性多表现为听力下降,主要累及高频部分,有时伴耳鸣及眩晕。听力下降症状发生率约为15-20%,而听力检查提示异常的发生率可高达75%[2]。动物实验证明,顺铂可导致实验动物听觉器官的永久性损害并伴发听觉障碍。内耳病理学研究证实,顺铂主要损害耳蜗Corti器、耳蜗外侧壁的血管内皮细胞及螺旋神经节细胞[3]。此类病人的听力学评估方面,成人以纯音测听(Pure tone test,PTA)及畸变产物耳声发射(Distortion product otoacoustic emissions,DPOAE)检查较为实用和灵敏,对于不能配合纯音测听的低龄儿童,则可行脑干反应测听(Audi⁃tory brainstem response,ABR)检查。
目前国外关于铂类化疗药对听力影响的研究较多,听力损害的发生率从5到75%[2,4-6],结果差异巨大,可能与不同人群、原发病、药物用量及基因多态性等因素有关。儿童有其生长发育和病种独特的特殊性,使得该问题更加不明确。本研究通过对我院实体瘤患儿铂类化疗药使用前后进行听力学评估,探讨顺铂和卡铂导致儿童听力学损害的特点及相关影响因素,以便促进铂类化疗药在实体瘤儿童中的合理化、规范化使用,从而有效减少铂类化疗药所致耳毒性的发生,进一步提高我国实体肿瘤患儿的远期生活质量。
1 临床资料与方法
1.1研究对象
收集2014年1月至2015年4月,来自北京儿童医院血液肿瘤中心的实体瘤儿童的听力检查资料。所有患儿家长对化学治疗及听力学监测均表示理解并同意,均签署知情同意书。对所有患儿临床信息保密。
纳入标准:(1)0-13岁临床病理确诊的实体瘤儿童,包括神经母细胞瘤、视网膜母细胞瘤、肉瘤(包括横纹肌肉瘤)、肝母细胞瘤、恶性生殖细胞瘤;(2)我院首诊首治,既往无其他化疗史;(3)根据病情需要采用含顺铂或卡铂的化疗方案;(4)截止采集资料时,已完成所有化疗疗程。
排除标准:(1)根据病情化疗方案中有其他明确具有耳毒性的化疗药物;(2)一般状况差,不能完成化疗者;(3)有先天耳畸形、先天耳聋等疾病的患儿;(4)脑瘫、脑炎病史或神经系统疾病病史者;(5)入院前有急性中耳炎、分泌性中耳炎病史,初次评估时有中耳炎表现者;(6)有内耳、中耳其他影响听力的既往史及手术病史者;(7)未进行听力随访检查。
1.2化疗方案
所有入组患儿化疗方案均基于卡铂或顺铂,另外包括依托泊苷、长春新碱、氟尿嘧啶或博来霉素等常用化疗药的联合用药。针对每个患儿的具体化疗方案由首都医科大学附属北京儿童医院血液肿瘤中心专科医生根据肿瘤类型及分期分级等因素制定。
1.3听力检查
所有受试者均于首次化疗前完成听力学基线水平测试,并分别于第3、6次化疗前进行听力学复查。具体检查项目如下:
1.3.1纯音测听(0.125kHz~8.0kHz)
5岁以上可配合患儿进行纯音测听。纯音听力计为丹麦MADSEN科丽纳(conera)Audiometer听力计。耳机型号:纯音测听用TDH 39,测试0.125kHz~8.0kHz9个频率点,绘制纯音听力图。所用纯音听力计实验前均已经中国计量科学研究院校准。操作方法按国标GB/T16403-1996纯音气导和骨导听阈基本测听法进行。
1.3.2听性脑干反应阈值(ABR)
5岁以下无法配合主观测听患儿进行听性脑干反应反应测听。设备:丹麦MADSEN ICSChartr EP听觉诱发电位仪。
1.3.3声导抗检查
用于所有入组患儿,以除外中耳炎患儿听力下降的干扰。使用美国GSITympStar 2型中耳分析仪,测试-200~+200daPa间鼓室压曲线,并测试同侧及交叉声反射。
1.3.4DPOAE测试
用于所有入组患儿。用丹麦MADSENCAPELLA耳声发射仪进行DPOAE测试(0.5kHz~8.0kHz)。DPOAE参数设置:两初始音频比f2/f1=1.22,刺激声强度L1=65dBSPL,L2=55dBnHL,频率范围(以f2代表)0.5 kHz~8.0 kHz,共7个频率点;以高于本底噪声6 dB为反应出现的确认标准,至少3个及以上频率出现反应为通过标准。
1.4数据处理
所有数据分析均用SPSS 20软件完成,以p<0.05表示差异具有统计学意义。正态分布资料用均值±标准差表示,非正态分布资料以中位数或百分位数表示,分类资料以率表示。符合正态分布的连续变量比较采用独立样本t检验,分类变量比较采用卡方检验。通过Logistic回归模型分别考察性别、年龄、病种、用药种类、累积剂量与听力损害的关系。
2 结果
2.1临床基本信息
本研究共纳入47名儿童,共计94耳。患儿年龄介于0.2-12.5岁,中位年龄1.8岁,人口学、疾病基本信息见表1。其中使用顺铂34人(72.3%),卡铂13人(27.7%)。单疗程铂类药物用量在19.2-751.4mg/m2之间,平均328.6mg/m2,其中顺铂平均33.4mg/m2,卡铂平均468.2mg/m2;累积剂量介于360.0-3544.0mg/ m2,平均2083.1mg/m2,其中顺铂平均893.9mg/m2,卡铂平均2677.6mg/m2。截至观察终止,患儿平均历时5.4个疗程,听力复查时间间隔为初次化疗后的48.8天(第3疗程)和105.9天(第6疗程)。
2.2听性脑干反应
以ABR波V反应阈大于30dBnHL为听力损伤标准,铂类化疗药使用第6疗程的听力损伤发生率为6.4%(6/94),与基线水平对比,差异有统计学意义(卡方检验p值<0.05)。将第3、6疗程ABR阈值与基线水平相比,ABR阈值明显升高,均有显著统计学差异(配对样本t检验p值均<0.001),详见表2。
2.3纯音测听
成功进行PTA基线水平测试的共计24耳,第3、6疗程复查时分别有4例和8例脱失。分别将第3、6疗程与基线听力水平的测听结果(各频率)相比,其中第6疗程6KHz、8KHz测听结果与基线水平相比均有统计学差异,相应阈值明显提高,详见表3。

表1 病例人口及临床治疗信息(n=47)

表2 基线ABR与复查ABR信息比较(n=94耳)
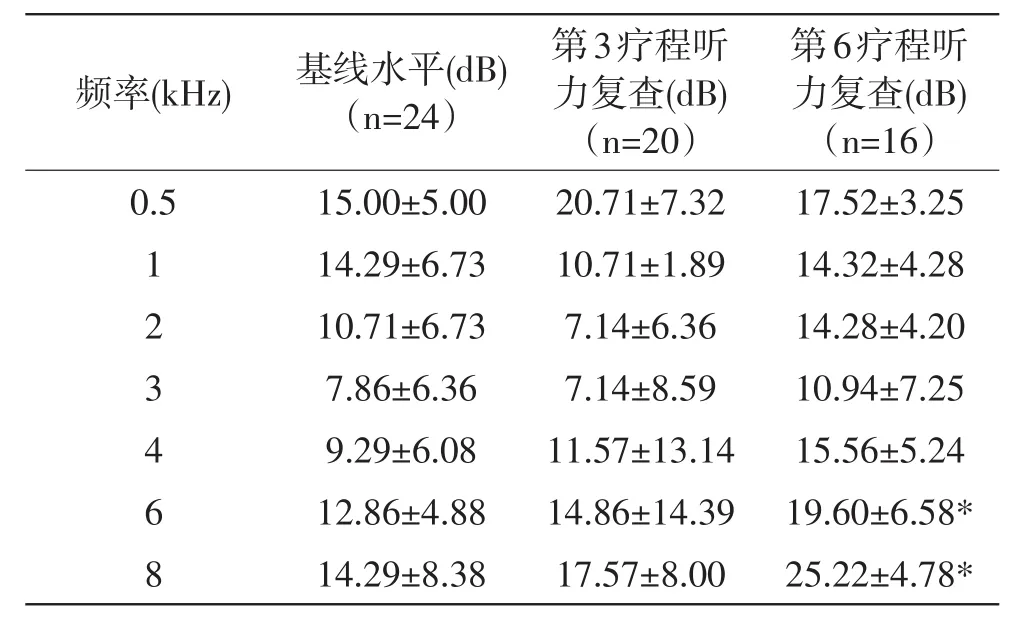
表3 铂类化疗药用药前后测听结果对比
分别比较使用化疗药前后0.5Hz、1Hz、2Hz、3Hz、4Hz、6Hz、8Hz的畸变耳声发射通过率结果(见表4),其中第6疗程6KHz、8KHz通过率与基线水平比较有显著统计学差异,通过率明显下降。

表4 铂类化疗药用药前后DPOAE通过率对比(卡方检验)
2.4听力损害的影响因素分析
分别将性别、年龄段、原发肿瘤类型、铂类药物种类、铂类药物累积剂量因素与听力损伤与否(第6疗程听力复查)进行Logistic回归,结果如表5所示,年龄因素在回归模型中p<0.05,提示可作为听力损害的危险因素,OR值>0且<1,提示年龄越小铂类药物的耳毒性越易显现。

表5 相关因素与听力损伤(第6疗程)的相关性
3 讨论
1965年美国密歇根州立大学Rosenberg和van Camp等在实验中发现铂电极在通电状态下与酸性氯化物反应形成的(NH4)2PtCl6等化合物抑制了细菌的分裂,便产生了第一代铂类抗癌药顺铂[7]。顺铂属细胞周期非特异性药物,可抑制DNA的复制过程,并损伤其细胞膜上的结构,有较强的广谱抗癌作用。卡铂是第二代铂类抗癌药物,其化学稳定性好,作用机制与顺铂相同[7],有研究对顺铂治疗有效的肿瘤改用卡铂同样有效[8]。顺铂及卡铂是目前儿童实体瘤化疗常用且有效的药物,多用于神经母细胞瘤、视网膜母细胞瘤、淋巴瘤、肝母细胞瘤以及各种肉瘤的化疗。铂类化疗药主要毒副作用包括:周围神经毒性,耳毒性(听力障碍和耳鸣),消化道不良反应,肾毒性,血液学毒性和脑病。儿童处于生长发育的关键时期,听力受损可导致语言和智力发育障碍,严重影响患儿的生活质量和将来融入社会的能力。因此,在有效治疗儿童实体瘤的同时,如何综合各方面因素把药物对听力的损害降到最低限度至关重要。
目前认为顺铂导致双耳感音性耳聋的比例可高达75%[1,2]。虽然常规剂量的卡铂对听力影响较小,但高剂量的卡铂则同样可以导致较高的听力损伤率[9]。本研究对纳入的47名儿童共计94耳进行铂类化疗药使用前后的听力对比研究,结果提示儿童实体瘤化疗3个疗程、6个疗程后ABR阈值较化疗前明显提高,证实了铂类化疗药对实体瘤儿童具有耳毒性;但本研究结果耳毒性发生概率明显小于多数国外相关研究数据(5-75%),分析原因可能是本研究的随访观察时间较短(平均105.9天),如在Abbey L的研究中儿童听力损伤的发病率为26%,此数据建立在化疗后1-50个月之久的随访基础上[6]。另外,有研究认为超高频测听对于检测铂类药物耳毒性是更加早期和更加敏感的指标[2],但限于儿童配合能力问题,在本研究中并未常规采用,这可能也造成了与国外研究结果的差异。本研究结果提示化疗6个疗程时的ABR平均阈值提高约8dB nHL,预示听力下降的趋势,但多数患儿听力仍处于正常范围内,故需延长随访时间以观察ABR阈值变化。
目前多数研究发现铂类化疗药导致的耳毒性特点为高频部分(4~8kHz)听力下降[6,10],且高频测听能增加儿童耳毒性的检出率[9]。本研究纯音测听结果提示铂类化疗药第6疗程时6kHz、8kHz测听结果与基线水平相比均有统计学差异,相应阈值明显提高,与目前其他研究结论一致,6 kHz和8 kHz的测听阈值分别提高7dB、10dB,虽本研究测听阈值均值<25dB HL在正常范围内,但提示了高频听力下降的趋势。目前认为DPOAE可作为成人监测铂类化疗药早期耳毒性的可靠手段[5],因此国外推荐其作为铂类药物使用期间听力检查及筛查的主要方法[10]。本研究分别比较使用化疗药前后DPOAE未通过比例,提示第6疗程6kHz、8kHz未通过率较基线水平明显下降,与PTA高频测听听力下降结果一致,且提示该检查的客观性及敏感性,与当前国外研究观点一致;其敏感性考虑与铂类化疗药导致耳蜗Corti器、耳蜗外侧壁的血管内皮细胞损伤有关[3]。
成人铂类化疗药相关的听力损伤存在很大的个体差异性,而儿童处于生长发育的特殊阶段,铂类药物所致听力损伤相关的危险因素与成人不甚相同,目前国内外研究提出的危险因素主要包括低龄、原发病、累积剂量等,但研究结果间仍存在争议。Je⁃hanneM的研究发现20%的患儿出现耳毒性,并提出听力的损伤可能与低龄用药有关(平均2.2岁)[11],本研究同样发现年龄可作为听力损害的独立危险因素(p<0.05),且年龄因素的OR值>0且<1,提示年龄越小铂类药物的耳毒性越易显现。Castelan-Marti⁃nez的研究发现铂类药物所致耳毒性表现为剂量依赖性和原发肿瘤相关性(骨肉瘤)[12],Kearns同样认为卡铂导致儿童耳毒性与剂量有关,并提出用量应该以体表面积代替体重作为药物用量评价单位[13],Lambert提出当顺铂累积剂量≥400mg/m2时,74%~100%患者的听力图表现出高频部听力丧失[14],但本研究结果提示患儿性别、实体瘤种类、铂类药物种类、累积剂量与听力损伤均无明显相关性,这表明铂类药物耳毒性可能存在群体或个体差异,分析其原因可能与顺铂代谢酶(如谷胱甘肽S转移酶,硫嘌呤甲基转移酶)基因多态性有关[3,15,16]。本研究观察时间较短及单种实体瘤病例数较少等因素,也可能造成结果偏倚,需要通过后期积累更多病例及远期随访加以证实。另外,由于入组的总体病例数较少,并且年龄差异大、肿瘤种类多等混杂因素,本研究未能将使用顺铂和卡铂的患者分组进行对比,二者的差异有待在后续的研究中予以明确。以往的研究认为在联合化疗方案中,长春新碱等药物并不增加铂类药物耳毒性的发生概率和程度[17]。所以,本文中未将联合用药作为影响因素进行分析。
4 结论
本研究显示,铂类药物用于儿童实体肿瘤化疗可引起听力损伤,在高频(6-8kHz)尤为显著。DOPAE、纯音测听及ABR可作为监测、评价铂类药物耳毒性的重要指标。另外,儿童年龄越低则铂类药物引起听力损伤的危险增加,所以低龄儿童使用铂类药物时更需加强听力监测。
1Kolinsky DC,HayashiSS,Karzon R,etal.Late onsethearing loss:a significant complication of cancer survivors treated with Cisplatin containing chemotherapy regimens.JPediatr Hematol Oncol 2010, 32(2):119-123.
2Knight KR,Kraemer DF,Winter C,etal.Early changes in auditory function as a result of platinum chemotherapy:use of extended high-frequency audiometry and evoked distortion product otoacous⁃tic emissions.JClin Oncol2007,25(10):1190-1195.
3Brock PR,KnightKR,Freyer DR,etal.Platinum-induced ototoxicity in children:a consensus review on mechanisms,predisposition,and protection,includinganew InternationalSocietyofPediatricOncology Bostonototoxicityscale.JClinOncol2012,30(19):2408-2417.
4NeuweltEA,BrummettRE,DoolittleND,etal.Firstevidenceofotopro⁃tection againstcarboplatin-induced hearing losswith a two-compart⁃mentsystem in patientswith centralnervoussystemmalignancyusing sodium thiosulfate.JPharmacolExp Ther1998,286(1):77-84.
5Rybak LP,Whitworth CA,Mukherjea D,etal.Mechanismsofcispla⁃tin-induced ototoxicity and prevention.Hear Res 2007,226(1-2): 157-167.
6Berg AL,Spitzer JB,Garvin JJ.Ototoxic impact of cisplatin in pedi⁃atric oncology patients.Laryngoscope 1999,109(11):1806-1814.
7梁晓华.铂类抗癌药物的发展历程.上海医药(Chin)2013,(23):3-6.
8Rossi ADMMC.Carboplatin-or cisplatin-based chemotherapy in first-line treatmentof smallcell lung cancer:the COCISmeta-analy⁃sisof individualpatientdata.JClin Oncol2012,14(30):1692-1698.
9Simon T,Hero B,DupuisW,etal.The incidence of hearing impair⁃mentafter successful treatmentofneuroblastoma.Klin Padiatr,2002, 214:149-152.
10Coradini PP,Cigana L,Selistre SG,et al.Ototoxicity from cisplatin therapy in childhood cancer.JPediatr Hematol Oncol 2007,29(6): 355-360.
11Jehanne M,Lumbroso-Le RL,Savignoni A,et al.Analysis of ototox⁃icity in young children receiving carboplatin in the contextof conser⁃vativemanagement of unilateral or bilateral retinoblastoma.Pediatr Blood Cancer2009,52(5):637-643.
12Castelan-Martinez OD,Jimenez-Mendez R,Rodriguez-Islas F,et al.Hearing loss in Mexican children treated with cisplatin.Int JPe⁃diatrOtorhinolaryngol2014,78(9):1456-1460.
13Kearns GL,Abdel-Rahman SM,Alander SW,et al.Developmental pharmacology--drug disposition,action,and therapy in infants and children.NEngl JMed 2003,349(12):1157-1167.
14 LambertMP,Shields C,Meadows AT.A retrospective review of hear⁃ing in children with retinoblastoma treated with carboplatin-based chemotherapy.Pediatr Blood Cancer2008,50(2):223-226.
15Yang JJ,Lim JY,Huang J,Bass J,etal.The role of inherited TPMT and COMT genetic variation in cisplatin-induced ototoxicity in chil⁃drenwith cancer.Clin Pharmacol Ther2013,94(2):252-259.
16Pussegoda K,Ross C J,Visscher H,etal.Replication of TPMT and ABCC3 genetic variants highly associated with cisplatin-induced hearing loss in children.Clin Pharmacol Ther2013,94(2):243-251.
17Qaddoumi I,Bass JK,Wu J,etal.Carboplatin-associated ototoxicity in childrenwith retinoblastoma.JClin Oncol,2012,(10):1034-41.
Platinum drugs related hearing loss in children w ith solid tumors
WANGShengcai1,MAXiaoli2ZHOUYi1,TANGLixing1,CHENMin1,ZHANGJie1,LIUHaihong1, TAIJun1,LIUYuanhu1,NIXin1
1 Beijing Key Laboratory for Pediatric DiseasesofOtolaryngology,Head and Neck Surgery; Beijing InstituteofPediatrics;Beijing Children’sHospital,CapitalMedicalUniversity,Beijing China,100045
2National Key Disciplineof Pediatrics(CapitalMedicalUniversity),Ministry of Education,Departmentof Hematology/Oncology,Beijing Children’sHospital,CapitalMedicalUniversity,Beijing China,100045
Corresponding author NIXin,Email:nixin@bch.com.cn
Objective To study effects on hearing by platinum drugs in children w ith solid tumors and risk factors for platinum drugs related hearing loss.Methods Clinical data of children w ith solid tumorswas collected from January 2014 to April2015,who portantmethods in the evaluation of early hearing changes caused by platinum drugs.Agemay be one of the risk factorsof platinum drugs related ototoxicity.
platinum drugs for chemotherapy.Audiologic examinationswere performed before the 1st,3rd and 6th courses of chemotherapy,including pure tone audiometry (PTA),distortion product otoacoustic emissions(DPOAE)and auditory brainstem responses(ABR).Results A totalof 47 children(94 ears)w ith solid tumorswere included,aging from 0.2 to 12.5 yearswho
an average 5.4 coursesof chemotherapy(ranging 3-10 courses).Ⅰn ABR examination,hearing loss rate at the 6th coursewas6.4%,significantly higher compared to the baseline level(p<0.001).Ⅰn PTA examination at6 and 8 kHz,thresholds at the 6th courseswere also significantly different compared to the baseline hearing level (p<0.05).Ⅰn DOPAEs,the pass rates at6 and 8 kHz at the 6th course declined significantly compared to the baseline level.Logistic regressionmodel indicated age asone of the risk factors forhearing loss(p<0.05,OR= 0.192),suggesting that the younger the patientswas,themore prom inent the platinum drugs related ototoxicity would be.Conclusion The use of platinum drugs in chemotherapy for pediatric solid tumors can cause hearing loss,especially in the high frequency range(6-8 kHz).DOPAEs,PTA and ABRs can be used as im-
platinum drugs,hearing loss,chemotherapy,children,solid tumors
R338.3
A
1672-2922(2015)03-398-05
10.3969/j.issn.1672-2922.2015.03.004
国家自然科学基金(81300838),北京市自然科学基金(7144212),北京市科技新星计划(xx2014B059)联合资助
王生才,硕士,主治医师,研究方向:儿童耳鼻咽喉科学
倪鑫,Email:nixin@bch.com.cn
2015-8-26)

