生物制品用内包材微生物限度检测方法的验证
牛晓霞 崔艳文 吴美英
北京三元基因工程有限公司,北京102600
生物制品用内包材微生物限度检测方法的验证
牛晓霞 崔艳文 吴美英▲
北京三元基因工程有限公司,北京102600
目的 建立生物制品用内包材(中性硼硅玻璃管制注射剂瓶﹑药用卤化丁基橡胶塞和抗生素瓶用铝塑组合盖)微生物限度检查方法,并进行验证。 方法 采用薄膜过滤法检查上述3种内包材的微生物限度,并按照验证试验方法,在供试品中加入5种标准菌,测定其回收率。 结果 金黄色葡萄球菌﹑铜绿假单胞菌﹑枯草芽孢杆菌﹑白色念珠菌和黑曲霉5种标准菌在上述3种内包材供试品溶液中的平均回收率均为70%~110%,符合公示的2015年版药典中要求的50%~200%的标准。 结论 薄膜过滤法适用于上述3种内包材的微生物限度检验。
内包材;微生物限度;验证
生物制品用内包材包括中性硼硅玻璃管制注射剂瓶(下称西林瓶)﹑药用卤化丁基橡胶塞(下称胶塞)和抗生素瓶用铝塑组合盖(下称铝塑盖),已广泛应用到无菌制剂生产领域[1-3],它们的质量直接关系到药品的安全[4]。其微生物负载量是药品生产环节环境微生物污染的主要来源之一,也成为近年来药品生产污染控制的主要关注点。微生物限度检查法是检查非无菌制剂和物料微生物负载的方法[5]。
微生物检查结果易受各种试验条件的影响,包括抑制微生物生长的成分﹑微生物回收率等。因此,任何样品在建立微生物限度检查法时均需验证,确保试验结果的准确性[6-8]。
2015年版《中国药典》对非无菌产品微生物限度检查:微生物计数法进行了较大幅度的修订,修订后的中国药典微生物限度检测系统与国外完全一致[9]。本文按照2015年版《中国药典》的要求,采用薄膜过滤法对生物制品用内包材进行微生物限度检查,建立了适用于该物料的微生物限度检查法并进行了方法学验证。
1 材料与方法
1.1 仪器
Labonce-250BI生化培养箱(北京兰贝石恒温技术有限公司),HFsafe-1200LC生物安全柜(力新仪器上海有限公司),SQ810C立式压力蒸汽灭菌器(YAMATO),KYC-100C恒温培养摇床(苏州江东精密仪器有限公司)。
1.2 标准菌株
金黄色葡萄球菌[CMCC(B)26003]﹑铜绿假单孢菌[CMCC(B)10104]﹑枯草芽孢杆菌[CMCC(B)63501]﹑白色念珠菌[CMCC(F)98001]和黑曲霉[CMCC(F)98003]均来自中国医学微生物菌株保藏管理中心。
1.3 培养基
胰酪大豆胨琼脂培养基(TSA)﹑胰酪大豆胨液体培养基(TSB)﹑沙氏葡萄糖琼脂培养基(SDA)﹑沙氏葡萄糖液体培养基(SDB)和蛋白胨水培养基等均购自北京三药科技开发公司。
1.4 供试液的制备
用无菌方法操作,取西林瓶或铝塑盖100个浸泡于2000mL 0.9%无菌氯化钠溶液中30min,充分震荡后倒出溶液即为供试液。
用无菌方法操作,取胶塞100个浸泡于500mL 0.9%无菌氯化钠溶液中30min,充分震荡后倒出溶液即为供试液。
1.5 菌液的制备
将金黄色葡萄球菌﹑铜绿假单胞菌和枯草芽孢杆菌的新鲜培养物接种至TSB培养基中,30~35℃培养18~24h,用0.9%无菌氯化钠溶液稀释成50~100CFU/mL的菌液。
将白色念珠菌的新鲜培养物接种至SDB培养基中,20~25℃培养2~3d,用0.9%无菌氯化钠溶液稀释成50~100CFU/mL的菌液。
将黑曲霉的新鲜培养物接种至SDA斜面培养基上,20~25℃培养5~7d,直至获得丰富孢子。加入3~5mL无菌氯化钠溶液将孢子洗脱,过滤掉菌丝后,用0.9%无菌氯化钠溶液将其稀释成50~100CFU/mL的孢子悬液。
1.6 微生物限度检查
取西林瓶或铝塑盖的供试液,采用薄膜过滤法[9],需氧菌总数计数用滤膜每张过滤100mL供试液,霉菌酵母菌总数计数用滤膜每张过滤500mL供试液(每次100mL,过滤5次),每种计数做两个平行。将前两张滤膜转移至TSA培养基上,30~35℃培养3d;后两张滤膜转移至SDA培养基上,20~25℃培养5d,观察结果。
取胶塞的供试液,采用薄膜过滤法,每张滤膜过滤100mL供试液,滤膜转移﹑培养及观察与上述西林瓶和铝塑盖相同。
1.7 方法学验证
进行3次独立的平行试验,分别计算各标准菌株的回收率。
1.7.1 试验组 取上述1.6规定条件的供试液过滤,并在最后一次过滤时加入1mL菌液,在规定条件下培养,计数。
1.7.2 菌液组 取1mL菌液,加入到100mL无菌氯化钠溶液中,采用薄膜过滤法,测定所加试验菌菌数。
1.7.3 供试品对照组 按照1.6规定的方法,测定供试液中菌数。
1.7.4 回收率计算 回收率(%)=(试验组的菌数-供试品对照组菌数)/菌液组菌数×100%。判定标准:3次平行的试验中,5种标准菌的回收率均为50%~200%,判定为合格。
2 结果
用薄膜过滤法3次检测3种内包材的微生物限度,标准菌株的回收率均为70%~110%,结果判定为合格,表1~5。
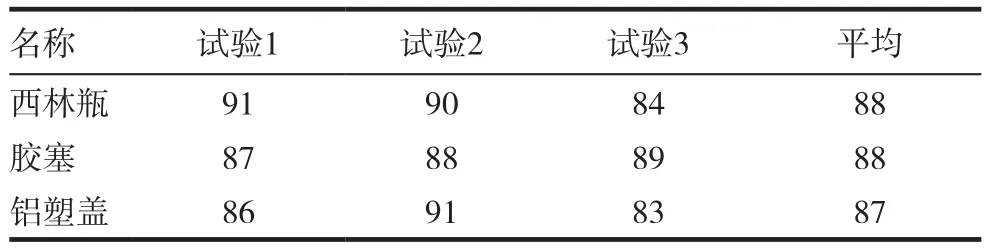
表1 金黄色葡萄球菌的回收率(%)

表2 铜绿假单胞菌的回收率(%)
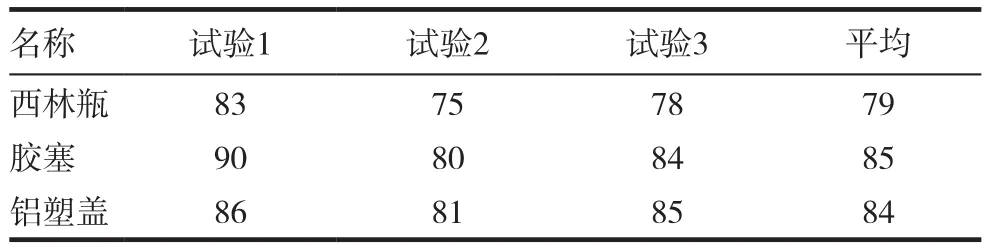
表3 枯草芽孢杆菌的回收率(%)
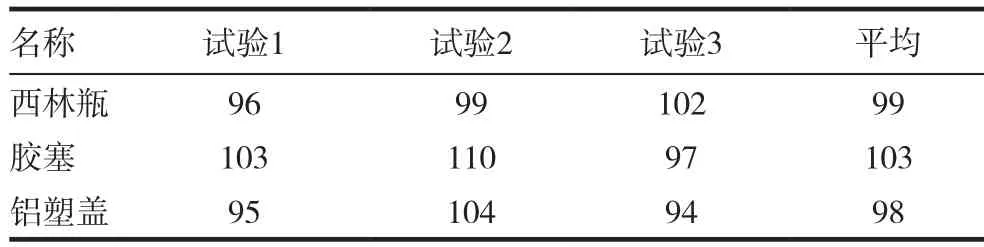
表4 白色念珠菌的回收率(%)

表5 黑曲霉的回收率(%)
3 讨论
近年来,药品内包材微生物负载量越来越受到关注[7-8]。在生物制品生产过程中,使用的物料均需要进行微生物限度检查,确保符合使用要求。并且能更科学和合理的制定物料处理工艺,如内包材清洗灭菌程序等[10]。
本实验用薄膜过滤法分别建立了西林瓶,胶塞和铝塑盖3种内包材的微生物限度检查方法,并进行验证。在3次独立的试验中,金黄色葡萄球菌﹑铜绿假单胞菌﹑枯草芽孢杆菌﹑白色念珠菌和黑曲霉5种标准菌株的回收率均为70%~110%,符合2015年版《中国药典》50%~200%的要求,同时也符合USP﹑EP和JP的要求。
微生物限度检查不同于其他理化检验项目,其检验周期长,影响因素多,在实际操作中,经常出现各种误差[11]。在建立新的方法时,除了需要系统的验证,还需要摸索和细化各个试验条件[12]。检验人员的经验﹑过程的控制﹑物料的选择﹑标准菌株的管理和培养基等都对试验结果有不同程度的影响。
[1] 黄立新,朱莲,陈卓,等.中性硼硅西林瓶在甲型肝炎疫苗生产中的应用[J].国际流行病学传染病杂志,2013,40(2):139-140.
[2] 赵霞,胡昌琴,金少鸿.药用胶塞及其应用现状[J].中国药事,2006,20(7):433-436.
[3] 辛继国.铝塑复合盖臭氧消毒应用分析[J].南北桥,2009,3:126.
[4] 郭丽.关于药品内包材质量对于药品质量影响的探讨[J].中国科技纵横,2007,7:207.
[5] 国家药典委员会.中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2010:附录98-108.
[6] 陈波,徐程林,刘桂芳,等.生物制品用原辅料微生物限度检测方法的验证[J].中国生物制品学杂志,2009,22(5):498-500.
[7] 黄依玲.明胶空心胶囊微生物限度检查法的建立和验证[J].广西医科大学学报,2013,30(4):641-643.
[8] 罗书香,周显飞,刘辉,等.口服液体药用聚酯瓶微生物限度检查方法的探讨[J].中国药师,2014,17(1):176-177.
[9] 国家药典委员会.1105非无菌产品微生物限度检查:微生物计数法征求意见稿[R].
[10] 王萍.对新版GMP下铝塑复合盖灭菌处理方式及设备的探讨[J].机电信息,2010,17:19-22.
[11] 刘金凤.分析药品微生物限度检验误差影响因素[J].食品与药品检验,2014,24(2):188-189.
[12] 朱亚虹,黄凯,曾环想.药品微生物检测的质量保证[J].中国医药指南,2010,8(33):176.
Verification of method for microbial limit test on inner packing material of biologics
NIU Xiaoxia CUI Yanwen WU Meiying
Beijing Triprime Genetic Engineering Co.,Ltd, Beijing 102600, China
Objective To develop and verify a method for microbial limit test on inner packing material of biologics. Methods The microbial limits of 3 kinds of inner packing material of biologics, i.e. vial, rubber closures and aluminum-plastic combination cover, were tested by membrane filtration method, and the developed method was verified by adding standard microorganisms with known counts into the test samples and determining their recovery rates. Results All the recovery rates of standard Staphylococcus aureus, Pseudomonas aeruginosa, Bacillus subtilis, Candida albicans and Aspergillus niger in the test samples of 3 kinds of inner packing material were 70%~110%, which met the requirements(50%~200%) in Chinese Pharmacopoeia(Draft of the 2015 edition). Conclusion The developed membrane filtration method was suitable for above-mentioned 3 kinds of inner packing material.
Inner packing material; Microbial limit; Verification
Q939.9
B
2095-0616(2015)16-201-03
2015-03-12)
▲通讯作者

