UPLC-MS- MS法测定八 宝粥罐头中乙二胺四乙酸二钠残留量
杨长志,韩广源,姜 冰,魏冬旭,程 阳
(黑龙江出入境检验检疫局,黑龙江 哈尔滨 15000 1)
UPLC-MS- MS法测定八 宝粥罐头中乙二胺四乙酸二钠残留量
杨长志,韩广源,姜 冰,魏冬旭,程 阳
(黑龙江出入境检验检疫局,黑龙江 哈尔滨 15000 1)
建立超高效液相色谱-串联质谱法测定八宝粥罐头中乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium,EDTA-2Na)残留量的检测和确证方法。试样中残留的EDTA-2Na用水高速匀浆提取,提取液经三氯化铁衍生化、三氯甲烷和MAX阴离子交换柱净化后,用超高效液相色谱-串联质谱仪检测和确证,外标法定量。EDTA-2Na质量浓度在1.0~50.0 μg/mL范围内时,线性关系良好,EDTA-2Na的相关系数(R2)为0.992 2。在20~400 mg/kg添加范围内,样品平均加标回收率在79.4%~105.3%之间,相对标准偏差为7.93%~9.94%。EDTA-2Na的最低检出限为20 mg/kg。该方法具有灵敏、准确、稳定等优点,可用于八宝粥罐头中EDTA-2Na残留量测定。
乙二胺四乙酸二钠;超高效液相色谱-串联质谱;八宝粥罐头
乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium,EDTA-2Na)是GB 2760—2011《食品添加剂使用标准》允许使用的一种食品添加剂[1],可与铁、铜、钙、镁等多价离子螯合成稳定的水溶性络合物,利用其络合作用来防止由金属引起的变色、变质、变浊及VC的氧化损失,起到护色、抗氧化作用[2]。由于其良好的添加效果,常被作为抗氧化剂、防腐剂、稳定剂和凝固剂而广泛的应用于加工食品中[3],但过多的EDTA-2Na被人食入后,会对人身造成伤害,其每日允许摄入量值为0~205 mg/kg。国外对EDTA在食品中的残留量有严格的限量规定。日本规定罐头食品中EDTA的残留(以乙二胺四乙酸二钠钙计)不得超过250 mg/kg,饮料中不得超过35 mg/kg[4]。我国在八宝粥等罐头食品中规定不得超过250 mg/kg[1]。
目前,有关于食品中EDTA-2Na残留量国内报道很多[5-8],但针对八宝粥等罐头食品中EDTA-2Na残留检测无文献报道,大多采用液相色谱法进行检测,样品经水提取,经CuCl2或三氯化铁衍生后,采用离子对试剂和C18柱进行液相色谱分析检测,检出限达50~100 mg/kg。国外有关食品中EDTA-2Na的含量检测的文献报道不多,Hamano等[9]采用分光光度法测定食品中EDTA-2Na的含量,利用三氯化铁衍生后进行分析检测,线性范围在0.5~40.0 ☒g/mL;Brilliantes等[10]采用液相色谱法测定罐装海产品中EDTA-2Na的含量,用弱乙酸提取,经CuCl2衍生后,采用C8柱进行液相色谱分析检测,线性范围为25.1~301.7 mg/kg;Cagnasso等[11]采用液相色谱法测定非酒精饮料中EDTA-2Na的含量,定量限为2.0 mg/L;Fingerhut等[12]在新生儿筛查中采用液相色谱-串联质谱法测定干血浆样品中EDTA-2Na的含量,样品经四丁醇酯化后,采用液相色谱-串联质谱法进行测定,方法的定量限为84 μmol/L;Xie等[13]采用反相离子对液相色谱法测定生活废水中EDTA-2Na的含量,定量限为0.005 mg/L;Quintana等[14]采用反相离子对液相色谱-串联质谱法测定水中EDTA-2Na的含量,定量限为0.001 mg/kg。本研究的关键是采用三氯化铁衍生化、三氯甲烷和MAX阴离子交换柱净化,用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS-MS)法检测和确证,外标法定量,取得了满意的结果。该方法具有快速、灵敏、准确等特点,能满足国内外检测限量要求。
1 材料与方法
1.1 材料与试剂
甲醇、三氯甲烷、三正丁胺(均为色谱纯) 美国Fisher公司;甲酸(纯度88%,分析纯) 国药集团化学试剂有限公司;冰乙酸(分析纯) 天津市光复科技发展有限公司;盐酸(优级纯) 天津市耀华化学试剂有限责任公司;三氯化铁(分析纯) 天津市科密欧化学试剂有限公司;EDTA-2Na标准品(CAS:6381-92-6,纯度≥99%) 美国Sigma-Aldrich公司;实验用水均为去离子水;MAX阴离子交换柱(150 mg,6 mL)美国Waters公司;水相滤膜(0.22 ☒m) 天津奥特赛恩斯仪器有限公司。
1.2 仪器与设备
Quattro Premier UPLC-MS-MS仪(配电喷雾电离(electrospray ionization,ESI)源) 美国Waters公司;电子天平(感量0.01 mg、0.01 g) 梅特勒-托利多国际贸易(上海)有限公司;组织捣碎机 上海精科实业有限公司;离心机 湘仪离心机仪器有限公司;旋涡混合器、均质器 德国IKA公司;超声波清洗机 昆山市超声仪器有限公司;氮吹仪 美国Organomation公司;螺旋盖聚丙烯离心管(50 mL);玻璃具塞离心管(25、50 mL);MAX阴离子交换柱,使用前依次用5 mL甲醇、5 mL水活化。
1.3 方法
1.3.1 溶液配制
三氯化铁溶液0.02 mol/L:称取0.540 6 g三氯化铁,溶于90 mL水中,转移到100 mL容量瓶中,加入0.03 mL盐酸,用水定容至刻度,混匀;10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5):移取100 mL甲醇,溶于880 mL水中,加入1.17 mL三正丁胺,用冰乙酸调节pH 3.5,转移到1 000 mL容量瓶中,用水定容至刻度,混匀;95%甲醇溶液(含5 mmol/L三正丁胺pH 3.5):移取950 mL甲醇,溶于30 mL水中,加入1.17 mL三正丁胺,用冰乙酸调节pH 3.5,转移到1 000 mL容量瓶中,用水定容至刻度,混匀;10%甲酸-甲醇溶液:移取10 mL甲酸,溶于40 mL水中,转移到100 mL容量瓶中,用甲醇定容至刻度,混匀。
标准储备溶液:分别准确称取适量的EDTA-2Na标准品,用水溶解并定容至100 mL棕色容量瓶中,分别得质量浓度为10 mg/mL的标准储备溶液,此溶液转移至储液瓶中4 ℃贮存1 个月。
标准中间溶液:准确吸取EDTA-2Na储备溶液10 mL于50 mL棕色容量瓶中,用水稀释成质量浓度为2 mg/mL的标准中间溶液,此溶液转移至储液瓶中4 ℃贮存1 个月。
标准工作溶液:根据需要使用前用空白样品基质配制适当混合标准工作溶液。
1.3.2 色谱条件
色谱柱:Phenyl柱(50 mm×2.1 mm,1.7 μm);流动相梯度洗脱程序见表1;流速0.25 mL/min;柱温25 ℃;进样量5 ☒L。
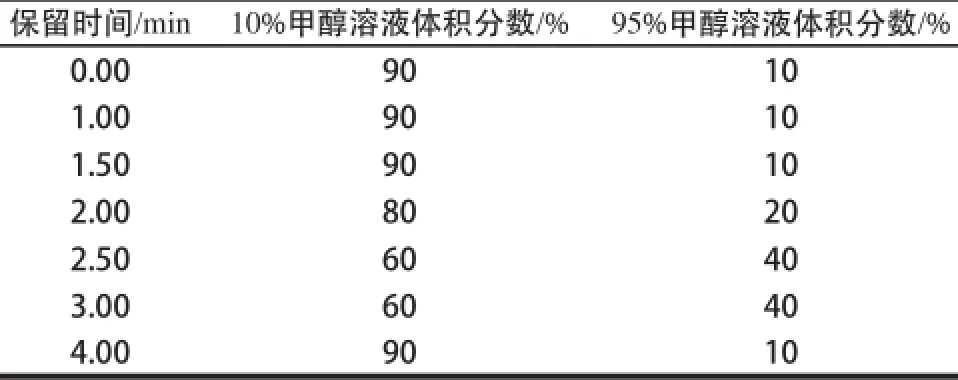
表1 梯度洗脱程序表Table 1 Gradient elution program of mobile phaseTable1 Gradient elution program of mobile phase
1.3.3 质谱条件
离子源:ESI负模式;扫描方式:多反应监测;离子源温度:110 ℃;去溶剂气(氮气)流量:550 L/h;去溶剂温度:350 ℃;锥孔气(氮气)流量:50 L/h;碰撞气(氩气,纯度≥99.999%)压力:3.30×10-4kPa;毛细管电压:3.0 kV;其他质谱参数见表2。

表2 EDTA-2Na衍生物的定性离子对、定量离子对、锥孔电压和碰撞气能量Table2 RM transtions of precursor/prouuct ion foor qualitative and quantitative analysis, cone voltage, collision energy of EDTA-2Na derivative
1.3.4 样品前处理
1.3.4.1 提取
称取八宝粥罐头试样约5 g(精确到0.01 g)于50 mL螺旋盖聚丙烯离心管中,加入15 mL水,再加入20 mL三氯甲烷,用均质器以10 000 r/min均质2 min,4 500 r/min离心5 min。将上清液转移至50 mL玻璃具塞离心管中。再用15 mL水重复提取两次,合并提取液于同一个50 mL玻璃具塞离心管中,待衍生化和净化。
1.3.4.2 衍生化[2]
样品溶液的衍生化:向上述提取溶液中加入1.0 mL 0.02 mol/L三氯化铁溶液,混合,于超声波中超声20 min,冷却至室温后,转移至50 mL容量瓶中,用水定容至刻度。
标准溶液的衍生化:准确吸取适当质量浓度的标准工作液于50 mL玻璃具塞离心管中,加入40 mL水和1.0 mL 0.02 mol/L三氯化铁溶液,以下操作同样品溶液衍生化。
1.3.4.3 净化
准确移取5 mL上述衍生化样品溶液转移到MAX阴离子交换柱中,控制流速在1~2 mL/min,弃去流出液。用5 mL水、5 mL甲醇和3 mL 10%甲酸-甲醇溶液淋洗,弃去流出液。最后用6 mL 10%甲酸-甲醇溶液洗脱,收集洗脱液。洗脱液经80 ℃氮吹仪吹干后,用5 mL水溶解并定容,过0.22 ☒m滤膜,供UPLC-MS-MS测定。
2 结果与分析
2.1 测定方法的选择
乙二胺四乙酸常用H4Y表示,由于其在水及酸中的溶解度很小,常用的为其二钠盐:Na2H2Y2H2O ,也简写为EDTA。当溶液的酸度很高时,两个羧基可再接受H+,形成H6Y2+,相当于一个六元酸,有六级离解常数:Ka1=10—0.9、Ka2=10—1.6、Ka3=10—2.1、Ka4=10—2.8、Ka5=10—6.2、Ka6=10—10.3;7 种形式:H6Y2+、H5Y+、H4Y、H3Y—、H2Y2—、HY3—、Y4—;当pH<1时,主要以 H6Y2+形式存在;当pH>11 时,主要以Y4—形式存在配位离子[15]。可以看出,EDTA是极性很强化合物,如果不进行金属离子络合和采用离子对试剂,很难采用液相色谱法(紫外检测器)测定其含量,国内外的文献报道大都基于此;Quintana等[14]采用反相离子对液相色谱-串联质谱法测定水中EDTA-2Na的含量,主要利用EDTA-2Na与三氯化铁络合反应,使测定EDTA-2Na成为可能。所以本方法最后选用UPLC-MS-MS进行研究,探讨一种针对食品中EDTA-2Na含量检测的确证方法,经实验本方法的检出限为20 mg/kg,完全能满足食品中EDTA-2Na检出限为25 mg/kg的要求。
2.2 衍生化试剂的确定
由于EDTA是极性很强化合物,极容易与金属离子络合,形成稳定的螯合物。EDTA为六齿螯合剂,可以一个分子和二价及三价金属以1∶1比例形成螯合物。在溶液中存在多种金属离子时,EDTA螯合优先与稳定常数大的金属离子进行反应。螯合物稳定常数表示EDTA金属螯合物的稳定状态,lgK(稳定常数)越大,表示该螯合物越稳定,越有利优先发生螯合反应。EDTA螯合金属离子稳定性排序为Mo6+>Bi3+> Fe3+>Cu2+>Zn2+>Fe2+>Mn2+>K+>Ca2+>Mg2+。虽然Mo6+和Bi3+稳定常数大,但在食品中含量是极微量的,所以用Fe3+与EDTA-2Na螯合进行含量测定要比有些文献方法采用CuCl2作为衍生化试剂要稳定得多,其螯合物见图1。所以本方法中选择FeCl3作为衍生化试剂进行方法检测是可靠、可行的。
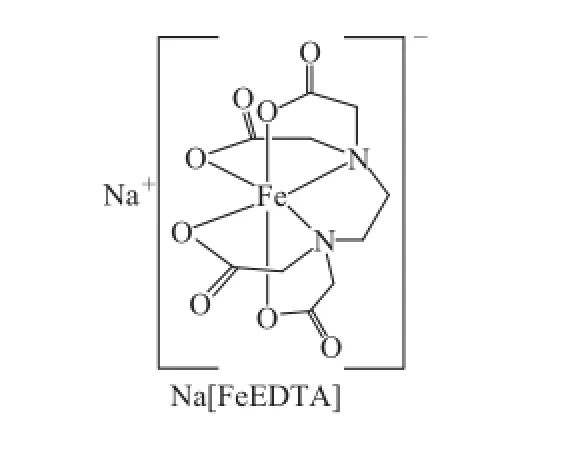
图1 EDTA-2Na螯合物Fig.1 Chelate of EDTA-2Na
2.3 净化方法的选择和优化
八宝粥罐头等样品基质,虽然进行了三氯甲烷初步的净化,但仍然达不理想的净化效果,色谱峰分叉比较明显,无法进行UPLC-MS-MS测定,见图2。为此,选择固相萃取柱的净化实验。分别选择HLB、C18、WAX、NH2、MAX柱进行了固相萃取柱的净化实验,结果表明:HLB、C18、WAX、NH2柱的保留效果不好,起不到净化的目的;MAX柱保留效果和净化效果都比较理想,但洗脱起来非常困难。如果酸度不够,很难将EDTA-2Na的衍生物从MAX柱洗脱下来。为此,进行了洗脱溶剂的选择。首先,选取0.2 mol/L三氯乙酸和甲醇,配制成5%三氯乙酸-甲醇溶液、10%三氯乙酸-甲醇溶液、20%三氯乙酸-甲醇溶液、30%三氯乙酸-甲醇溶液进行MAX柱的洗脱实验,结果表明:20%三氯乙酸-甲醇溶液只用10 mL就能完全将EDTA-2Na的衍生物洗脱下来。但如果不吹干直接上液相色谱-质谱测定是不行的,因为三氯乙酸的酸度太大,质谱的峰形很差,无法进行定量分析。即使进行吹干处理,处理后样品中仍然有酸性存在,所以不采用这种洗脱方式。其次,选取甲酸、水和甲醇,主要考虑甲酸是挥发性有机酸,容易吹干,配制成2%甲酸-甲醇-水溶液(2∶50∶48,V/V)、5%甲酸-水-甲醇溶液(5∶50∶45,V/V)、10%甲酸-水-甲醇溶液(10∶50∶40,V/V)、15%甲酸-水-甲醇溶液(15∶50∶35,V/V)进行了MAX柱的洗脱实验,结果表明:2%甲酸-甲醇-水溶液和5%甲酸-水-甲醇溶液所用的洗脱体积大约在15 mL以上,15%甲酸-水-甲醇溶液洗脱又太快,仅需要1 mL,而10%甲酸-水-甲醇溶液所用洗脱体积在6 mL以内,吹干后进行质谱检测,峰形很好,所以本净化方法选择了10%甲酸-水-甲醇溶液作为洗脱溶剂,具体的洗脱曲线见图3。
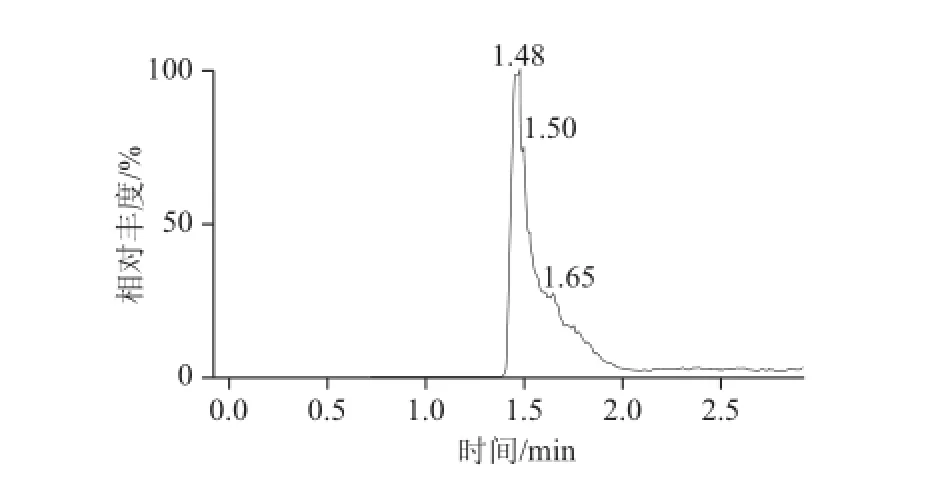
图2 未经MAX柱阴离子交换柱净化的EDTA-2Na色谱图Fig.2 MRM chromatogram of EDTA-2Na without MAX anion exchange column purification
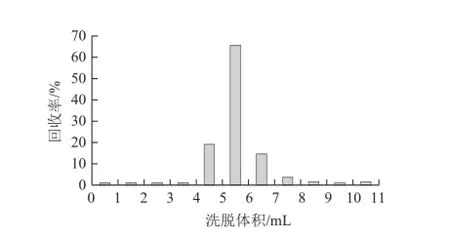
图3 MAX柱阴离子交换固相萃取柱洗脱曲线Fig.3 Elution curve from MAX anion exchange solid-phase extraction column
2.4 色谱柱和流动相的选择
据文献[4,6-7]报道,利用液相色谱分析EDTA螯合物常用的色谱柱为C18色谱柱,流动相通常采用四丁基氢氧化铵溶液等离子对试剂进行分析。如果对EDTA螯合物采用UPLC-MS-MS进行分析测定,其色谱柱要有一定保留,且离子对试剂要具有很强的挥发性,通常的离子对试剂是不能使用。为此,本实验选择了C18(50 mm×2.1 mm,1.7 μm)、Phenyl(50 mm×2.1 mm,1.7 μm)液相色谱柱和含有一定量三正丁胺的甲醇溶液作为流动相进行实验。结果表明:C18液相色谱柱的色谱峰不尖,而且分叉;而Phenyl液相色谱柱没有出现这种情况,而且分离度和灵敏度都能满足要求,所以本实验的定量分析选择Phenyl液相色谱柱作为本实验方法的色谱柱。对于流动相的选择,选择4 种不同溶剂配比:10%甲醇溶液(含5 mmol/L 三正丁胺,pH 3.5)-100%甲醇、10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-80%甲醇溶液、10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-90%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)、10%甲醇溶液(含5 mmol三正丁胺,pH 3.5)-95%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)。结果表明:10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-90%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)和10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-95%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)这两种流动相,EDTA螯合物的出峰时间和峰形都比较理想,但10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-95%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)的灵敏度要优于10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-90%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)。所以本实验方法的流动相选择为10%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)-95%甲醇溶液(含5 mmol/L三正丁胺,pH 3.5)。
2.5 线性范围的确定
在方法所确定的实验条件下,取一系列不同质量浓度的EDTA-2Na标准溶液,进行衍生化,然后以仪器响应峰面积对EDTA-2Na质量浓度进行线性回归,结果表明:当EDTA-2Na质量浓度在1.0~50.0 μg/mL范围内时,线性关系良好,其相关系数(R2)为0.992 2,回归方程为y=1 368.57x+470.384。当样品中的EDTA-2Na质量浓度超过上述两个线性范围时,可适当加大样品的稀释倍数。
2.6 方法的检出限、回收率和精密度
2.6.1 检出限
根据有关国家在八宝粥罐头等食品中对EDTA-2Na限量要求,而采用添加法进行实测的情况确定。EDTA-2Na的检出限为20 mg/kg,其基质的标准品谱图、检出限谱图和基质的空白谱图参见(图4~6),可满足国外限量要求。

图4 EDTA-2Na标准品多反应监测色谱图(20 mg/kgg)Fig.4 MRM chromatogram of EDTA-2Na standard derivative (20 mg/kg)
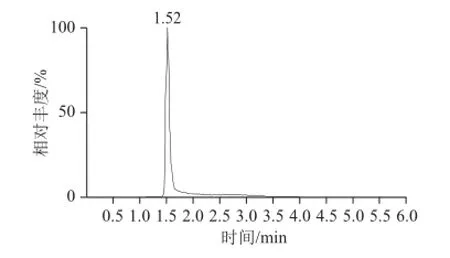
图5 八宝粥罐头样品添加(20 mg/kg)色谱图Fig.5 Chromatogram of spiked standard reference (20 mg/kg) in canned eight-ingredient porridge
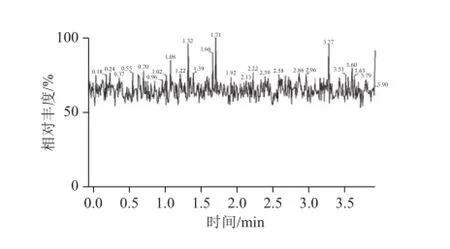
图6 八宝粥罐头样品空白色谱图Fig.6 Chromatogram of blank sample of canned eight ingredient porridge
2.6.2 方法的回收率实验和精密度实验
本方法以八宝粥罐头为研究对象,采用添加法进行了3 个水平的回收率实验,其回收率、精密度的结果见表3。由表3可以看出,EDTA-2Na添加20、100、400 mg/kg时,样品平均加标回收率在79.4%~105.3%之间,相对标准偏差为7.93%~9.94%,符合残留分析的要求。
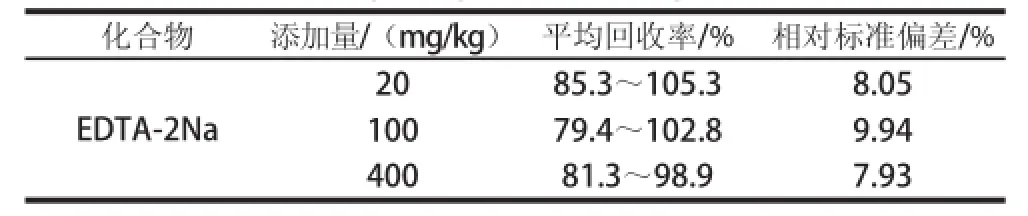
表3 八宝粥罐头中EDTA-2Na的回收率、精密度(n==66)Tablee 3 Recoveries and relative standaar deviations of EDTA-2Na in canned eight-ingredient porridgee (n = 6)
2.7 实际食品样品的测定
选取实际八宝粥罐头样品,平行测定2 次,取平均值,所测实际样品中EDTA-2Na的含量结果见表4。

表4 实际食品样品测定结果(n=2)=2 Table 4 Results obtained by the method for EDTA-2Na inreal food samples (s (n n = 2) 2)
3 结 论
本实验采用固相萃取技术和UPLC-MS-MS技术相结合的分析方法,解决了八宝粥罐头等样品基质干扰严重的难题,为食品中EDTA-2Na检测和确证,探索了一套新颖的样品前处理方法和色谱分析方法。该方法应用于实际样品检测,效果理想。
[1] 国家标准化管理委员会. GB 2760—2011 食品添加剂使用标准[S].北京: 中国标准出版社, 2011.
[2] 魏冬旭, 胡珅, 孙莹, 等. 高效液相色谱法测定食品中乙二胺四乙酸二钠[J]. 检验检疫学刊, 2013, 23(6): 50-53.
[3] 郑睿行, 张旭, 方芳, 等. 高效液相色谱法测定酱腌菜制品中EDTA残留量[J]. 中国食品添加剂, 2011(2): 156-159.
[4] 罗袆, 赵永彪, 李淑娟, 等. 反相高效液相色谱法测定食品中EDTA的含量[J]. 中国食品添加剂, 2006(4): 212-219.
[5] 王琼, 方艳红, 徐金瑞. 罐头食品中EDTA残留量的薄层色谱测定[J].华侨大学学报, 2002, 23(1): 37-39.
[6] 施旭霞, 陈笑梅. 反相高效液相色谱法测定罐头食品中乙二胺四乙酸的残留量[J]. 色谱, 2000, 18(5): 445-447.
[7] 李琛, 李迎丽, 唐开红. 离子色谱法测定罐头、酱菜等食品中的EDTA-2Na含量[J]. 中国卫生检验杂志, 2005, 15(10): 1233-1234. [8] 吕晓华, 文红, 许红琴. 高效液相色谱法测定板栗罐头中乙二胺四乙酸二钠的含量[J]. 中国卫生检验杂志, 2009, 19(3): 517-518.
[9] H A M A N O T, M I T S U H A S H I Y, K O J I M A N, e t a l. Sensitive spectrophotometric method for the determination of ethylenediaminetetraacetic acid in foods[J]. Analyst, 1993, 118: 909-912.
[10] BRILLIANTES S, PAKNOI S. Method modification of EDTA analysis in canned seafood by HPLC[J]. Thai Fisheries Gazettev, 1998, 51(2): 117-124.
[11] CAGNASSO C E, LOPEZ L B, VIVIANA G, et al. Development and validation of a method for the determination of EDTA in non-alcoholic drinks by HPLC[J]. Food Compositionand Analysis, 2007, 20: 248-251.
[12] FINGERHUT R, DAME T, OLGEMOLLER B. Determination of EDTA in dried blood samplesby tandem mass spectrometry avoids serious errors in newborn screening[J]. European Journal of Pediatric Surgery, 2009, 168(5): 553-558.
[13] XIE C Z, HEALY T, ROBINSON P, et al. Determination of EDTA in dairy wastewater and adjacent surface water[J]. World Academy of Science, Engineering and Technology, 2008, 44: 50-54.
[14] QUINTANA J B, REEMTSMA T. Rapid and sensitive determination of ethylenediaminetetraacetic acid and diethylenetriaminepentaacetic acid in water samples by ion-pair reversed-phase liquid chromatography-electrospray tandem mass spectrometry[J]. Chromatography A, 2007, 1145(1/2): 110-117.
[15] 程艳, 高静, 徐红纳, 等. 螯合剂EDTA简介[J]. 化学教育, 2009(5): 4-6.
Determination of Ethylenediaminetetraacetic Acid Disodium Residues in Canned Eight-Ingredient Porridge by UPLC-MS-MS
YANG Changzhi, HAN Guangyuan, JIANG Bing, WEI Dongxu, CHENG Yang
(Heilongjiang Entry and Exit Inspection and Quarantine Bureau, Harbin 150001, China)
An ultra performance liquid chromatography-tandem mass spectr ometry (UPLC-MS-MS) method was developed for the determination and confirmation of ethylenediaminetetraacetic acid disodium (EDTA-2Na) residues in canned eight-ingredient porridge. The EDTA-2Na residues in the test samples were extracted with water by means of high-speed homogenization. The extract was derivatized with FeCl3reagent, cleaned up by chloroform and MAX anion exchange column. The residues were determined and confirmed by UPLC-MS-MS using an external standard method. The linear range was 1.0–50.0 ☒g/mL for EDTA-2Na with a correlation coefficient (R2) of 0.992 2. The average recoveries of EDTA-2Na in spiked samples ranged from 79.4%–105.3%, with relative standard deviations between 7.93% and 9.94% at spiked levels of 20–400 mg/kg. The limit of detection was 20 mg/kg for EDTA-2Na. The method is sensitive, accurate, repeatable and suitable for the determination of EDTA-2Na residues in canned eight-ingredient porridge.
ethylenediaminetetraacetic acid disodium (EDTA-2Na); ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS-MS); canned eight-ingredient porridge
O657.6
A
1002-6630(2015)04-0208-05
10.7506/spkx1002-6630-201504041
2014-03-18
国家认证认可管理委员会资助项目(2009B548)
杨长志(1962—),男,研究员,硕士,主要从事食品安全和检测研究。E-mail:yangcz621126@163.com

