枫香叶 分离物抗氧化活性及对枇杷的贮藏保鲜效果
纪雨薇,刘亚敏,刘玉民,*,阎 聪,刘宏丁
(1.西南大学资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.黑龙江省农业科学院浆果研究所,黑龙江 绥化 152204)
枫香叶 分离物抗氧化活性及对枇杷的贮藏保鲜效果
纪雨薇1,刘亚敏1,刘玉民1,*,阎 聪2,刘宏丁1
(1.西南大学资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.黑龙江省农业科学院浆果研究所,黑龙江 绥化 152204)
以枫香叶分离物(枫香叶依次经乙醇提取、乙酸乙酯萃取、大孔树脂层析、50%乙醇洗脱后所得产物)为实验材料,分别研究其还原力及对1,1-二苯基-2-三硝基苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·、·OH的清除能力和对枇杷的贮藏保鲜效果。用10、30、50 mg/100 mL的枫香叶分离物溶液对枇杷果实进行浸泡处理,6 ℃贮藏,每5 d测定一次枇杷果实的腐烂指数、硬度、可溶性固形物含量、可滴定酸含量、相对电导率、过氧化物酶(POD)活性、苯丙氨酸解氨酶(PAL)活性、木质素含量等果实的品质和生理指标。结果表明:枫香叶分离物具有较高的还原力和DPPH自由基、·、·OH清除率;且枫香叶分离物处理可以有效控制枇杷果实腐烂指数、硬度、细胞膜渗透性及PAL活性和POD活性的升高,延缓可溶性固形物、可滴定酸含量的下降和木质素的积累,对于长期贮藏的枇杷果实具有较好的保鲜作用,其中以10 mg/100 mL枫香叶分离物的实用性较好。
枫香叶分离物;抗氧化活性;枇杷;贮藏保鲜
枇杷(Eriobotrya japonica Lindl.)为蔷薇科枇杷属植物,其果实是我国南方特有的珍稀水果,营养丰富,味道鲜美,具有清热、润肺、止渴、和胃等作用,深受消费者的喜爱[1-2]。但由于枇杷成熟期集中在初夏高温、多湿季节,采后生理活动旺盛,营养成分消耗快,容易腐烂变质、木质化、品质劣变及褐变,在一般条件下难以贮藏和长途运输[3]。目前,枇杷采后贮藏保鲜的方法主要为冷藏结合化学试剂处理,然而化学试剂带来的污染和残留问题至今还未得到很好的解决[4-5],因此,研究适合枇杷的无公害高效防腐保鲜剂以取代化学试剂,对枇杷的贮藏保鲜具有重要意义。从中药和香辛料中提取天然防腐保鲜剂[6-8],被认为是开发新型无公害高效果蔬防腐保鲜剂的重要途径。
金缕梅科枫香树属的枫香(Liquidambar formosana Hance)全株均有药用价值,具有温经活络、祛风湿、行气、解毒等功能[9-10]。其叶片中含有丰富的次生代谢物质,如α-莽草酸、芦丁、β-谷甾醇、驱蛔脑、异槲皮苷、金丝桃苷、黄芪苷、三叶豆苷、逆没食子酸、紫云英苷、木麻黄鞣宁[11-12]等,这些物质大多具有抗氧化和抑菌作用。有研究[13-15]认为,枫香叶提取物及挥发性成分不仅对金黄色葡萄球菌、福氏志贺氏菌、白色葡萄球菌、铜绿假单胞菌、伤寒沙门氏菌、大肠杆菌、枯草杆菌、黄曲霉和青霉具有较强的抑制作用,还具有较好的抗氧化活性[15-16]。果蔬采后的腐烂变质主要是由于膜脂过氧化、自由基的产生和病原微生物的作用,本课题组前期研 究发现枫香叶乙醇提取物和乙酸乙酯萃取物均具有较强的抗氧化和抑菌能力,并对枇杷果实具有较好的保鲜功效,为进一步追踪枫香叶次生代谢物中具果品保鲜作用的活性物质,本实验选择枫香叶依次通过乙醇提取、乙酸乙酯萃取、大孔树脂层析、50%乙醇洗脱后所 得产物即枫香叶分离物(extract from Liquidambar formosana Hance leaves,LE)为材料,通过测定LE的抗氧化能力和贮藏期间枇杷果实品质和生理指标的变化,研究其抗氧化活性和对枇杷果实的防腐保鲜作用及机理,为枫香资源在果品保 鲜方面的综合开发利用探索新的途径,为寻找适合枇杷的无公害高效保鲜剂提供理论依据。
1 材料与方法
1.1 材料与试剂
枫香叶于2011年9月采自重庆市北碚茅庵林场3~4 a生幼树,经西南大学林学教研室鉴定为金缕梅科枫香树属的枫香叶。鲜叶杀青粉碎后过40 目筛备用。供试枇杷为九分熟的“大五星”枇杷果实,于2013年5月13日采收,3 h内运回实验室进行实验。
无水乙醇、乙酸乙酯、D-101大孔吸附树脂、铁氰化钾、三氯化铁、邻二氮菲、VC、重铬酸钾、酚酞、L-苯丙氨酸 成都科龙化工试剂厂;亚硝酸钠、硫酸亚铁 南京化学试剂有 限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT) 北京中生瑞泰科技有限公司;三氯乙酸、硫代巴比妥酸国药集团化学试剂有限公司;愈创木酚 中国佘山化工厂。所用试剂均为分析纯。
1.2 仪器与设备
SCQ-2211B数控超声波清洗机 上海生彦超声波仪器有限公司;DHG-9075A电热恒温鼓风干燥箱 北京恒泰丰科试验设备有限公司;GY-1硬度计 乐清市宝特思仪器有限公司;VBR90A手持折光仪 杭州汇尔仪器设备有限公司;DDS-307A电导率仪、WFH-204B紫外分析仪 上海精密仪器有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;TGL-16G恰菲尔高速离心机 上海恰菲尔分析仪器有限公司;FA2004A电子天平 上海精天电子仪器有限公司;DKS-16电热恒温水浴锅 上海飞越实验仪器有限公司;SHB-3循环水多用真空泵 郑州杜甫仪器厂;RE-52旋转蒸发器 上海亚荣生化仪器厂;玻璃层析柱(50 mm×600 mm) 南宁市精密仪器仪表有限公司。1.3 方法
1.3.1 LE溶液的制备
称取枫香叶粉末1 kg,按照料液比1∶10(g/mL)以体积分数为50%的乙醇在70 ℃条件下超声波提取50 min,提取3 次后合并滤液,于45 ℃减压浓缩蒸干溶剂,得到170.5 g枫香叶醇提取物。称150 g枫香叶醇提取物溶于1 000 mL蒸馏水中,用等体积乙酸乙酯萃取3 次,萃取液减压浓缩蒸干溶剂所得乙酸乙酯相浸膏,用大孔吸附树脂层析法进行分离,依次用水和10%、30%、50%乙醇洗脱,取50%的乙醇洗脱液,减压浓缩蒸干溶剂,得到红棕色黏稠状物即为LE,得率1.90%。实验中,配制不同质量浓度LE溶液备用。
1.3.2 LE抗氧化活性的测定
总还原力的测定采用铁氰化钾法[17],LE溶液质量浓度为0.1 mg/mL;DPPH自由基清除率测定采用DPPH法[18];O·清除率测定采用NBT光还原法[19];·OH清除率测定采用邻二氮菲氧化法[20-21]。以上4 个抗 氧化活性指标均以相同质量浓度的VC和BHT作为对照。
1.3.3 果实预处理
将采回的枇杷去除未成熟、病虫害和有机械损伤的果实,挑选大小和颜色基本一致的进行实验。用体积分数1%的果蔬专用洗洁剂溶液浸果5~10 min,用自来水洗净后,再用去离子水漂洗3 次,沥干水分后分别浸泡在质量浓度为0(对照,CK)、10(处理1,T1)、30(处理2,T2)、50(处理3,T3)mg/100 mL的LE溶液中5 min,自然晾干,再分装入聚氯乙烯袋(厚度0.06 mm)中,置于6 ℃条件下贮藏30 d,每5 d对贮藏枇杷的各项品质和生理指标进行测定,每个处理每次测定取样40个枇杷果实,重复3 次。枇杷贮藏期间的腐烂指数参照以上处理方法,置于相同条件下贮藏30 d,单独测定。
1.3.4 枇杷品质和生理指标的测定
腐烂指数测定参照郑永华等[22]的方法;枇杷果实硬 度测定采用硬度计法:将枇杷果实剥皮后,测定6个果实的果肉硬度,取其平均值,单位为kg/cm2;可溶性固形物(total soluble solid,TSS)含量测定采用折光仪法[23];可滴定酸(titratable acid,TA)含量测定采用酸碱滴定法[24];细胞膜渗透性的测定采用电导率仪法[24];木质素含量测定参照鞠志国等[25]的方法;过氧化物酶(peroxydase,POD)和苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)活性测定参照高俊凤[24]的方法,POD活性以材料鲜质量反应液每分钟A470nm变化0.01为1 个酶活性单位,以U/g表示;PAL活性以材料鲜质量反应液每小时A290nm增加0.01为1个酶活性单位,以U/g表示。
1.4 数据处理
各指标每次测定均进行3 次重复,结果取平均值,数据采用SPSS 17.0软件进行统计和方差分析,多重比较采用最小显著差法,作图采用Microsoft Office Excel 2003。
2 结果与分析
2.1 LE的抗氧化活性
2.1.1 LE对O2-·的清除活性
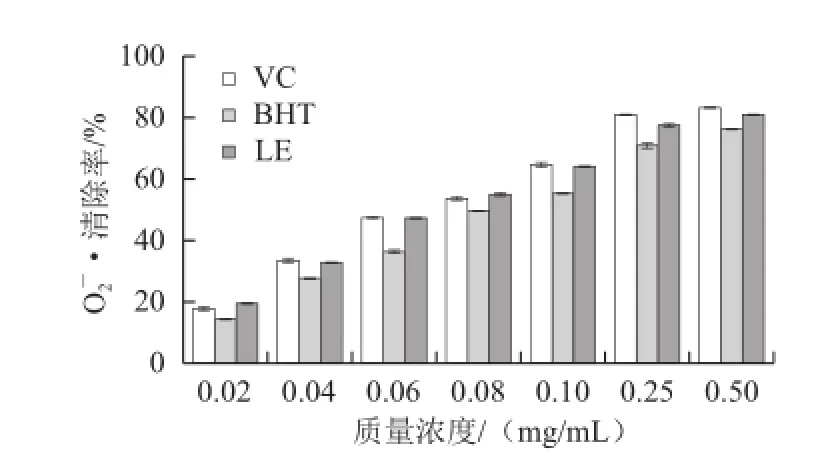
图1 EO2-•的清除活性Fig.1 O• radical scavenging rate of LE
LE对O2—·具有较好的清除活性,当质量浓度在0.02~0.25 mg/mL时,量效关系明显,当质量浓度大于0.25 mg/mL时,随质量浓度的增加,对O2—·的清除率变化不显著(图1)。质量浓度在0.02~0.5 mg/mL时,LE溶液的清除活性与VC差异不显著,但极显著高于BHT,说明LE具有较高的O2—·清除活性。
2.1.2 LE对DPPH自由基的清除活性
DPPH自由基是一种稳定的、以氮为中心的质子自由基,其乙醇溶液中呈紫色,在517 nm波长处有最大吸光度,抗氧化剂通过提供电子与DPPH自由基的孤对电子配对,使其溶液褪色[26-28]。LE对DPPH自由基具有较好的清除活性,质量浓度在0.01~0.3 mg/mL时,量效关系明显,此后随着质量浓度的增加,DPPH自由基的清除活性趋于稳定(图2)。在实验质量浓度范围内,LE的清除活性始终显著高于BHT;质量浓度小于0.3 mg/mL时,显著小于VC,质量浓度大于0.3 mg/mL时,与VC差异不显著,说明LE具有较高的DPPH自由基清除活性。
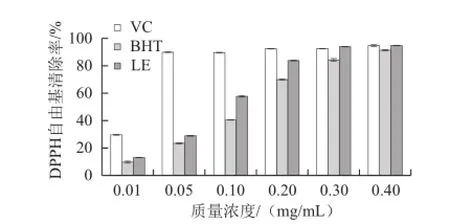
图2 LE对DPPH自由基的清除活性Fig.2 DPPH racial scavenging rate of LE
2.1.3 LE对·OH的清除活性
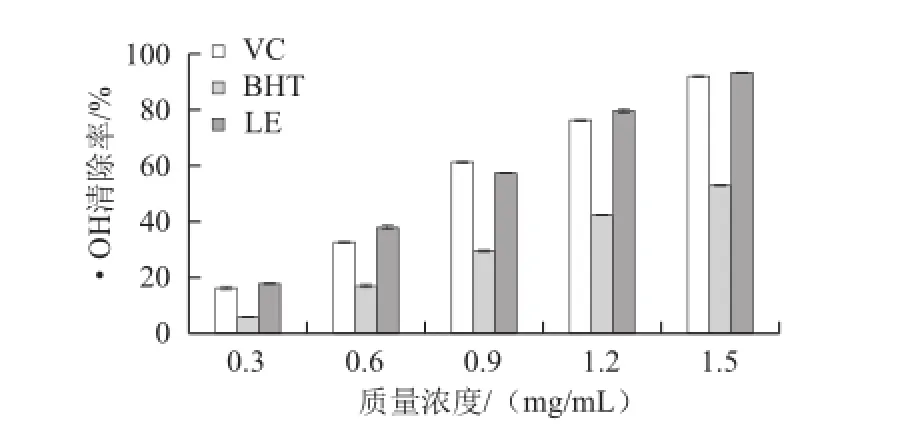
图3 LE对・OH的清除活性Fig.3 ・OH radical scavenging rate of LE
·OH是最活泼、毒性最大的自由基,它可以损伤蛋白质、脂质、核酸等多种生物大分子,引发组织细胞病变,导致各种疾病发生和加速机体衰老[29]。LE溶液质量浓度与·OH的清除活性呈现明显的量效关系(图3)。LE的清除活性与VC差异不显著,但显著高于BHT,说明LE具有较高的·OH清除活性。
2.1.4 LE总还原力

图4 LE的总还原力Fig.4 Total reducing power of LE
还原力是表示抗氧化物质是否为良好的电子供体的重要指标,还原力越强,可提供的电子越多,其供应的电子除了可使Fe3+还原为Fe2+外,也能使自由基变成稳定的分子,从而达到清除自由基的目的,因此可以通过测定还原力来说明物质的抗氧化能力[30-32]。如图4所示,质量浓度为0.1 mg/mL时,LE溶液的吸光度与VC差异不显著,但极显著高于BHT,表明LE具有很强的还原性。
2.2 LE对枇杷果实低温贮藏效果
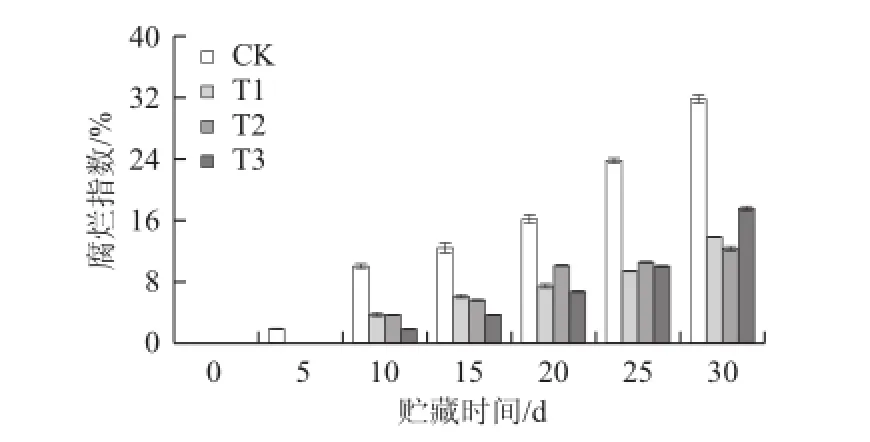
图5 不同处理对枇杷果实腐烂指数的影响Fig.5 Effects of treatment with LE at different concentrations on decay index of loquat fruits
2.2.1 LE对枇杷果实贮藏期间腐烂指数的影响贮藏期间枇杷果实腐烂指数呈上升趋势(图5)。对照组枇杷果实贮藏5 d时已腐烂1.88%,且随着贮藏时间的延长,果实的腐烂指数迅速升高,至贮藏30 d时,对照组果实的腐烂指数达到31.88%,而3个处理组的腐烂指数仅为对照组的43.13%(T1)、39.21%(T2)、54.89%(T3)。经方差分析,贮藏期间3个处理组与对照组差异极显著(P<0.01),由此可见,LE处理能够显著减少枇杷果实的腐烂。
2.2.2 LE对枇杷果实贮藏期间硬度的影响

图6 不同处理对枇杷果实硬度的影响Fig.6 Effects of treatment with LE at different concentrations on hardness of loquat fruits
枇杷果实在贮藏期间硬度呈递增的变化趋势(图6),在整个贮藏期间,3 个处理组枇杷果实硬度均小于对照组。贮藏至30 d时,3 个处理组枇杷果实硬度分别为2.16(T1)、2.22(T2)、2.02(T3)kg/cm2,对照组硬度为2.72 kg/cm2。经方差分析,整个贮藏期间,3 个处理组均与对照组差异显著(P<0.05),其中T3与对照组差异极显著(P<0.01),由此可见,LE处理能显著减缓枇杷果实硬度的上升,3 个处理组中T3效果最好。
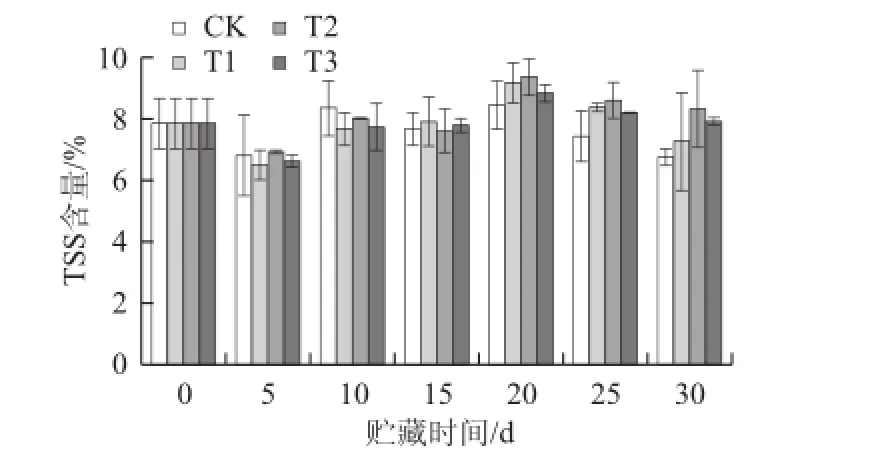
图7 不同处理对枇杷果实TSS含量的影响Fig.7 Effects of treatment with LE at different concentrations on TSS content in loquat fruits
2.2.3 LE对枇杷果实贮藏期间TSS含量的影响TSS是构成枇杷果实风味的重要物质,它主要包括可溶性糖类、可溶性蛋白质等[33],其含量越高,枇杷果实的品质越好。如图7所示,贮藏前5 d对照组和3 个处理组的TSS含量均有不同程度下降,此后则出现了先上升后下降的趋势。贮藏至30 d时,3 个处理组的TSS含量分别比对照组高7.39%(T1)、21.10%(T2)、13.65%(T3)。
2.2.4 LE对枇杷果实贮藏期间TA含量的影响

图8 不同处理对枇杷果实TA含量的影响Fig.8 Effects of treatment with LE at different concentrations on TA content in loquat fruits
枇杷在贮藏期间,部分TA转化成糖,用于呼吸消耗,被氧化成CO2和H2O;部分被Ca2+、K+所中和,因而使果实的酸味消减,风味降低[33]。如图8所示,随着贮藏时间的延长,枇杷果实中的含酸量逐渐下降,与贮藏时间呈线性负相关关系。贮藏至30 d,3 个处理组枇杷果实含酸量均显著高于对照组。经方差分析,贮藏期间对照组与3 个处理组差异极显著(P<0.01),3 个处理组间差异极显著(P<0.01)。由此可见,LE处理可显著减少枇杷果实TA的消耗,3 个处理组中T3效果最好。
2.2.5 LE对枇杷果实贮藏期间PAL活性的影响
PAL是木质素合成代谢的关键酶。枇杷果实贮藏过程中PAL活性呈上升的趋势,对照组PAL活性始终高于3 个处理组(图9)。整个贮藏期间,对照组枇杷果实中PAL活性增长较快,而3 个处理组PAL活性的增长则较为缓慢。经方差分析,在整个贮藏期间3 个处理组与对照组差异极显著(P<0.01),3 个处理间差异极显著(P<0.01)。由此可见,LE处理能显著抑制枇杷果实的PAL活性的上升,在3 个处理组中T3效果最好。
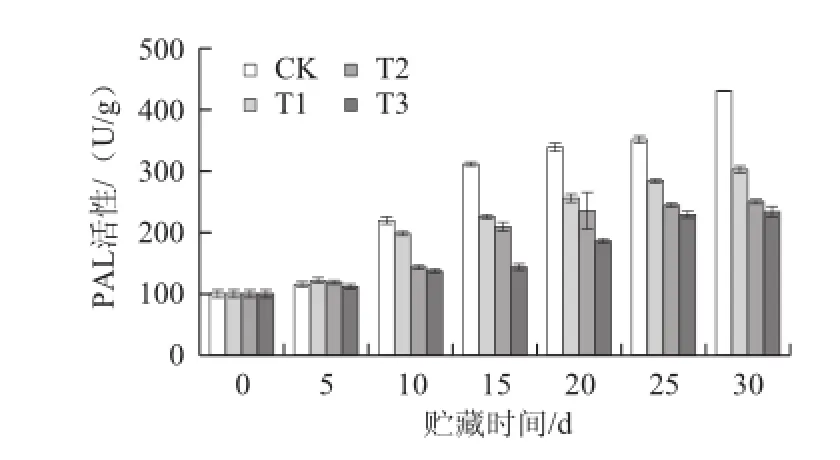
图9 不同处理对枇杷果实PAL活性的影响Fig.9 Effects of treatment with LE at different concentrations on PAL activity in loquat fruits
2.2.6 LE对枇杷果实贮藏期间POD活性的影响

图 10 不同处理对枇杷果实POD活性的影响Fig.10 Effects of treatment with LE at different concentrations on POD activit y in loquat fruits
POD活性是果实衰老的一种重要指标。一般认为果实衰老时POD活性上升,参与同衰老有关的氧化反应,抑制POD活性可延缓果实衰老[34]。如图10所示,贮藏前25 d,对照组和3 个处理组POD活性呈逐渐上升的趋势,在25 d时POD活性达到最大值,此后POD活性呈下降趋势。3 个处理组枇杷果实POD活性的最大值分别为284.27(T1)、270.64(T2)、241.43(T3) U/g,显著低于对照组POD活性的最大值(358.26 U/g)。经方差分析,整个贮藏期间对照组与3 个处理组差异极显著(P<0.01)。由此可见,LE处理能显著抑制枇杷果实POD活性的升高。
2.2.7 LE对枇杷果实贮藏期间细胞膜渗透性的影响
细胞膜渗透性在枇杷果实贮藏期间总体呈上升趋势(图11)。贮藏前15 d,对照组和3 个处理组相对电导率呈上升的趋势,上升幅度较小且有小幅度的上下波动;15~20 d时,相对电导率则快速上升;20~30 d时,相对电导率出现先下降后上升的趋势。经方差分析,对照组与T1、T2差异极显著(P<0.01)。由此可见,LE处理能显著减缓枇杷果实的细胞膜渗透性的升高。
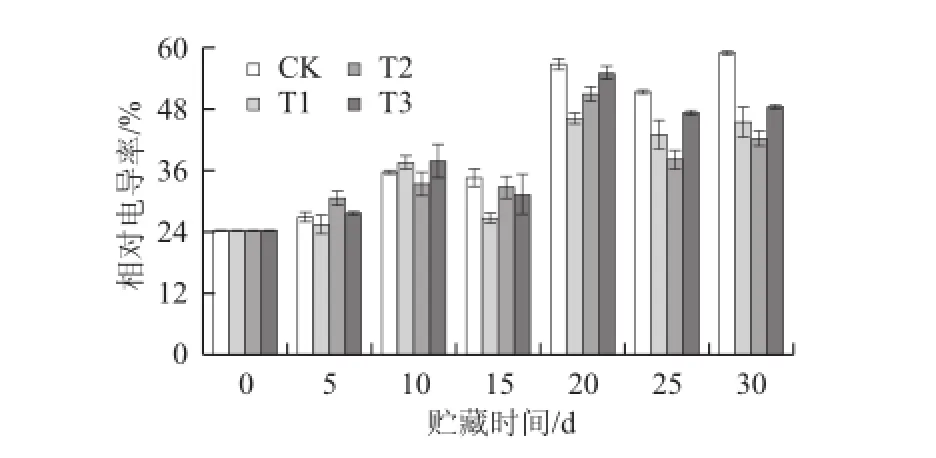
图 11 不同处理对枇杷果实细胞膜透性的影响Fig.11 Effects of treatment with LE at different conc entrations on membrane permeability in loquat fruits
2.2.8 LE对枇杷果实贮藏期间木质素含量的影响
枇杷果实贮藏过程中木质素含量有升有降,但总体呈先上升后下降趋势(图12),这可能与PAL活性的变化有关。贮藏前20 d,对照组和3 个处理组的木质素含量均呈缓慢上升趋势,但20 d后,对照组的木质素继续积累并在25 d达最大值(1.02%),而3 个处理的木质素含量的最大值则出现在20 d,此后呈下降趋势。经方差分析,对照组与3 个处理组差异极显著(P<0.01),3 个处理组间差异极显著(P<0.01)。由此可见,LE处理可以减缓枇杷果实的木质素含量的积累,在3 个处理组中T3效果最好。
3 讨论和结论
自由基是游离存在的含有不配对电子的基团,其在机体内有很强的氧化反应能力,易对蛋白质、脂质和核酸等产生伤害,从而引起机体损伤[35]。LE对DPPH自由基、O·和·OH均表现出良好的清除效果,其清除率分别达到94.76%、93.35%、80.75%,与相同质量浓度VC清除效果相当,显著高于BHT。此外,0.1 mg/mL LE溶液的还原力与相同质量浓度VC的还原力差异不显著,显著高于BHT。
枇杷采后果实内部的新陈代谢仍在进行,加之枇杷成熟期多处于高温、潮湿的季节,易滋生侵染性病原体,随着贮藏时间的延长,枇杷果实中的水溶性营养物质会逐渐流失,品质也会逐渐下降。阎聪等[36]的研究表明,8 mg/100 mL的LE处理可以显著减缓李果实TA、TSS含量的下降,抑制腐烂指数的升高,有效地保持李果实的品质。用LE处理均能够显著减少枇杷的腐烂、减缓果实硬度的上升、减缓TA的消耗,并在一定程度上减缓TSS的消耗,从而较好地保留了枇杷的营养和口感,与阎聪等[36]的研究结果相一致。
枇杷属非跃变型果实[37],采摘前已完成生理后熟,贮藏的过程亦是其衰老的过程,有研究[38]认为衰老过程是活性氧代谢失调与累积的过程,当机体衰老时,体内活性氧自由基大量积累,自由基就会首先攻击细胞的膜系统,造成细胞膜系统的伤害,膜透性增大,细胞内含物外渗增加,造成果实组织衰老或 死亡。POD是一种与衰老有关的酶,其在衰老后期被启动,参与与衰老有关的氧化反应,表现为伤害效应,常被作为植物衰老的指标[38-40]。用LE处理均可以显著延缓枇杷果实细胞膜渗透性的升高;并能显著抑制POD活性的上升,从而减缓枇杷果实的衰老进程,这可能与LE对O2-·、·OH等自由基具有较强的清除活性有关(图1、3)。木质素是构成植物细胞壁的重要成分,木质素在细胞壁中的大量积累是引起果实硬度增加的一个重要原因[4]。吴锦程等[1]研究表明,在4℃条件下枇杷木质素含量随着时间的推移而上升,果肉硬度 与木质素含量密切相关。PAL是苯丙烷代谢途径中的一个重要的酶,它能够催化L-Phe解氨生成反式肉桂酸,进入苯丙烷代谢途径,形成CoA酯,进一步转化为类黄酮、木质素等次生代谢产物,因此PAL也被认为是木质素合成代谢的关键酶[38-39]。郑永华等[41]的研究表明1℃条件下枇杷果实PAL活性上升,木质素大量合成,使果实变得僵硬,口感粗糙。本实验中,用LE处理均能够显著抑制枇杷果实PAL活性的上升,从而显著减缓枇杷果实木质素的积累和硬度的上升。
综上可知,LE具有较好的还原力和清除·OH、DPPH自由基、O2-·的能力,在枇杷果实低温贮藏期间能够显著抑制细胞膜渗透性的上升,抑制POD和PAL活性的升高,减缓TA的消耗和木质素的积累,延缓硬度的上升,在一定程度上减缓TSS的消耗,从而显著减少枇杷果实的腐烂,使枇杷果实在贮藏一定时间后还保留较高的营养价值和较好的口感。从实验所测贮藏保鲜指标的结果可以看出,3个处理均能显著延缓枇杷果实的衰老,其中以50 mg/100 mL(T3)LE处理的枇杷果实贮藏保鲜效果最好,但综合比较成本与保鲜效果,用10 mg/100 mL(T1)的LE来对枇杷进行保鲜处理最为合适。
[1] 吴锦程, 梁杰, 陈建琴, 等. 采收成熟度与冷藏枇杷果实木质化关系研究[J]. 食品科学, 2010, 31(2): 255-259.
[2] 林素英, 陈宇, 吴锦程, 等. 羧甲基壳聚糖对枇杷果实保鲜效果的影响[J]. 食品科学, 2013, 34(18): 312-316.
[3] 陈发河, 张美姿, 吴光斌. NO处理延缓采后枇杷果实木质化劣变及其与能量代谢的关系[J]. 中国农业科学, 2014, 47(12): 2425-2434.
[4] 秦文, 张正周, 付婷婷, 等. 臭氧对“大五星”枇杷贮藏保鲜效果的影响[J]. 食品科学, 2011, 32(20): 282-285.
[5] 关文强, 李淑芬. 天然植物提取物在果蔬保鲜中应用研究进展[J].农业工程学报, 2006, 22(7): 200-204.
[6] 刘光发. 八角茴香等植物提取物对果蔬保鲜效果的研究[D]. 天津:天津科技大学, 2010.
[7] 袁仲玉, 周会玲, 田蓉, 等. 芦荟粗提物对苹果采后灰霉病的防治效果与机理[J]. 农业工程学报, 2014, 30(4): 255-263.
[8] 廖珏. 39 种植物提取物对番茄、苹果的保鲜活性筛选[D]. 杨凌: 西北农林科技大学, 2013.
[9] 郑德勇, 安鑫南. 植物抗氧化剂研究展望[J]. 福建林学院学报, 2004, 24(1): 88-91.
[10] 中国医学科学院陕西分院中医研究所. 陕西中药志: 第一卷[M]. 西安: 陕西人民出版社, 1962: 513-514.
[11] HATANO T, KIRA R, YOSHIZAKI M, et al. Seasonal changes in the tannins of Liquidambar formosana reflecting their biogenesis[J]. Phytochemistry, 1986, 25(12): 2787-2789.
[12] OKUDA T, HATANO T, KANEDA T, et al. Liquidambin, an ellagitannin from Liquidambar formosana[J]. Phytochemistry, 1987, 26(7): 2053-2055.
[13] 钟有添, 王小丽, 马廉兰. 枫香树叶抗菌活性研究[J]. 时珍国医国药, 2007, 18(7): 1693-1694.
[14] 钟有添, 黄真, 张瑞其, 等. 枫香树叶对金黄色葡萄球菌和绿脓杆菌抑菌作用的观察[J]. 赣南医学院学报, 2007, 27(2): 169-170.
[15] 刘玉民, 刘亚敏, 李鹏霞. 枫香叶精油抑菌活性及抗氧化活性研究[J].食品科学, 2009, 30(11): 134-137.
[16] 李美霞. 植物提取物对水果采后致腐真菌的抑制作用研究[D]. 北京: 中国农业大学, 2004.
[17] 刘金串, 孟江飞, 房玉林, 等. 膨大处理对红地球葡萄酚类物质及抗氧化活性的影响[J]. 食品科学, 2012, 33(5): 7-12.
[18] 江岩, 郑力, 克热木江·吐尔逊江. 药桑椹花青素的体外抗氧化作用[J]. 食品科学, 2011, 32(13): 45-48.
[19] LIU F, OOI V E C, CHANG S T. Free radical scavenging activities of mushroom polysaccharide extracts[J]. Life Sciences, 1997, 60(10): 763-771.
[20] 周冉, 李淑芬, 张大成. 鹿茸提取物体外抗氧化活性分析[J]. 食品科学, 2009, 30(9): 33-36.
[21] 赵艳红, 李建科, 赵维, 等. 常见药食植物提取物体外抗氧化活性的评价[J]. 食品科学, 2009, 30(3): 104-108.
[22] 郑永华, 苏新国, 易云波, 等. SO2对枇杷冷藏效果的影响[J]. 南京农业大学学报, 2000, 23(2): 89-92.
[23] 丁波, 毕阳, 陈松江, 等. 两种间歇升温方式对李果实冷害抑制的效果比较[J]. 食品工业科技, 2012, 33(1): 352-358.
[24] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 217-220.
[25] 鞠志国, 刘成连, 原永兵, 等. 莱阳茌梨酚类物质合成的调节及其对果实品质的影响[J]. 中国农业科学, 1993, 26(4): 44-48.
[26] 谢小焕, 赵樱, 罗薇, 等. 不同甘薯品种苗期茎尖醇溶提取物清除DPPH·的行为特征差异[J]. 中国农业科学, 2013, 46(2): 270-281.
[27] MANZOCCO L, ANESE M, NICOLI M C. Antioxidant properties of tea extracts as affected by processing[J]. LWT-Food Science and Technology, 1998, 31(7/8): 694-698.
[28] GULCIN I, SAT I G, BEYDEMIR S, et al. Comparison of antioxidant activity of clove (Eugenia caryophylata Thunb) buds and lavender (Lavandula stoechas L.)[J]. Food Chemistry, 2004, 87(3): 393-400.
[29] HUANG D J, OU B X, PRIOR R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1841-1856.
[30] 曹炜, 卢珂, 陈卫军, 等. 不同种类蜂蜜抗氧化活性的研究[J]. 食品科学, 2005, 26(8): 352-356.
[31] 万利秀, 肖更生, 徐玉娟, 等. 柑橘皮黄酮纯化前后抗氧化性比较研究[J]. 食品科学, 2011, 32(5): 87-90.
[32] 展锐, 库尔班, 苟萍, 等. 火绒草提取物抗氧化活性的研究[J]. 食品科学, 2010, 31(3): 153-159.
[33] 陈迪新, 邓元平, 孙爱东, 等. 茶叶水提取物对草莓保鲜效果的影响[J].食品科学, 2014, 35(2): 310-315.
[34] 左进华, 陈安均, 李小静, 等. 番茄果实成熟衰老相关因子研究进展[J].中国农业科学, 2010, 43(13): 2724-2734.
[35] 董银萍, 李拖平. 山楂果胶的抗氧化活性[J]. 食品科学, 2014, 35(3): 29-32.
[36] 阎聪, 刘玉民, 刘亚敏, 等. 枫香叶次生代谢物对李采后品质及生理特性的影响[J]. 食品科学, 2013, 34(24): 268-272.
[37] 尚艳双, 刘玉民, 刘亚敏, 等. 枫香叶精油对枇杷低温贮藏的防腐保鲜效果[J]. 食品科学, 2014, 35(2): 266-270.
[38] 姚昕. “大五星”枇杷采后生理特性及贮藏保鲜技术的研究[D]. 雅安: 四川农业大学, 2005.
[39] 苏新国. 菜用大豆采后生理及其保鲜技术研究[D]. 南京: 南京农业大学, 2002.
[40] 张洁. 不同处理对杨梅果实保鲜效果的研究[D]. 杭州: 浙江农林大学, 2012.
[41] 郑永华, 李三玉, 席玙芳. 枇杷冷藏过程中果肉木质化与细胞壁物质变化的关系[J]. 植物生理学报, 2000, 26(4): 306-310.
Antioxidant Activity of Extrac t from Liquidambar formosana Hance Leaves and Its Effect on Preserving the Quality of Loquat Fruits during Refrigerated Storage
JI Yuwei1, LIU Yamin1, LIU Yumin1,*, YAN Cong2, LIU Hongding1
(1. Key Laboratory of the Three Gorges Reservoir Region’s Eco-environments, Ministry of Education, College of Resources and Environment, Southwest University, Chongqing 400715, China; 2. Berry Institute of Heilongjiang Academy of Agricultural Sciences, Suihua 152204, China)
In this study, the antioxidant activity of extract from Liquidambar formosana Hance leaves (LE) obtained by sequential steps including ethanol extraction, ethyl acetate extraction, macroporous resin chromatography with aqueous ethanol elution was evaluated by reducing power, and 1,1-diphenyl-2-picrylhydrazyl (DPPH), superoxide anion and hydroxyl radical scavenging assays. Meanwhile, the effect of the extract on preserving the quality of loquat fruits was investigated by storing the fruits at 6 ℃ after steeping in 10, 30 or 50 mg/100 mL LE solution. Decay index, hardness, total soluble solid (TSS) content, titratable acid (TA) content, membrane permeability, peroxydase (POD) activity, phenylalanine ammonia lyase (PAL) activity and lignin content were determined every 5 days to evaluate the quality and physiological characteristics of loquat fruits during storage. The results showed that LE had strong radical scavenging activity against 1,1-diphenyl-2-picrylhydrazyl (DPPH), superoxide anion, hydroxyl free radicals and significant reducing power, and could inhibit the increases in decay index, hardness, membrane permeability, PAL activities and POD activities, and slow down the decreases in TSS and TA contents and the accumulation of lignin. In conclusion, LE has bright prospects in quality preservation of loquat fruits and treatment 1 (10 mg/100 mL) has better practicability.
extract fr om Liquidambar formosana Hance leaves; antioxidant activity; loquat; storage
TS205.7
A
1002-6630(2015)04-0226-06
10.7506/spkx1002-6630-201504045
2014-08-04
国家自然科学基金面上项目(31170546)
纪雨薇(1991—),女,硕士研究生,研究方向为林产资源开发利用。E-mail:rain2008game@126.com
*通信作者:刘玉民(1974—),男,副教授,博士,研究方向为林产资源开发利用。E-mail:yuminliu@163.com

