Trichothecium roseum 蛋白激发子诱导杏果抗黑斑病的作用机理
余晓燕,毕 阳,李永才*,燕 璐,沈科萍,胡林刚,唐亚梅
(甘肃农业大学食品科学与工程学院,甘 肃 兰州 730070)
Trichothecium roseum 蛋白激发子诱导杏果抗黑斑病的作用机理
余晓燕,毕 阳,李永才*,燕 璐,沈科萍,胡林刚,唐亚梅
(甘肃农业大学食品科学与工程学院,甘 肃 兰州 730070)
研究非亲和菌株粉红单端孢(Trichothecium roseum)菌体蛋白激发子对杏果实抗黑斑病的诱导效果及其作用机理。以‘兰州大接杏’为试材,通过处理后不同时间损伤接种杏果黑斑病菌(Alternaria alternata),研究T. roseum蛋白激发子对杏果实黑斑病抗病性的 诱导及其时效性,同时进一步研究最佳处理质量浓度对杏果实组织活性氧及抗性相关酶的影响。结果表明,T. roseum蛋白激发子处理可显著抑制损伤接种杏果病斑的扩展(P<0.05),其中14.4 μg/mL蛋白激发子的控制效果最好,且诱导处理72 h时杏果产生最大抗性。T. roseum蛋白激发子处理后杏果组织O2—·的生成速率和H2O2含量分别在48 h和72 h出现明显的峰值,同时处理的果实组织超氧化物歧化酶、过氧化物酶、多酚氧化酶、β-1,3-葡聚糖酶和几丁质酶活性均有所增强。T. roseum菌体蛋白激发子处理能显著增强杏果组织的抗性,其可能是通过激发活性氧爆发和提高杏果实抗病性相关酶的活性来实现的。可见T. roseum蛋白激发子可以作为一种有潜力的诱抗剂应用于采后病害的控制。
粉红单端孢菌;蛋白激发子;杏果实;活性氧;诱导抗病性;黑斑病
杏(Prunus armeniaca L.)原产我国,甘肃省为全国杏的主要产区,其中‘兰州大接杏’以个大、色艳、气香、味美、质优而久负盛名[1-2]。由于杏的成熟期集中,货架期较短,常温条件下的采后寿命只有3~4 d,低温条件下也不足3周。此外,杏的采后 腐烂也颇为严重,其中由互隔交链孢(Alternaria alternata)引起的黑斑病是低温条件下杏的主要采后病害,该病原菌具有潜伏侵染的特性,对杏在低温冷链物流期间的腐烂率影响很大,常常导致严重的经济损失[3-5]。采用化学杀菌剂可有效控制杏的黑斑病,但由于存在药物残留、环境污染、以 及病原物产生抗药性等问题而逐渐受到限制[6]。因此,开发新型安全可持续的采后病害防腐技术便显得十分必要。生物农药在绿色食品生产发展和环境保护中发挥着积极作用,其中微生物源激发子的开发与应用显现出巨大的应用潜力[7]。该类激发子按化学性质分为蛋白类、寡糖类、肽类、糖蛋白类以及脂类等,其中蛋白类激发子又分为过敏蛋白、隐地蛋白、激活蛋白及其他蛋白,这些激发子均具有广谱提高植物抗性、有效控制病害 的作用[8]。例如,用从极细链格孢菌(A. tenuissima)中获得的蛋白激发子(Hrip1)处理烟草,能够激活水杨酸途径的蛋白激酶并且提高相关防卫基因的表达[9];将Hrip1基因转入拟南芥,植株对灰霉病的抗性显著增强[10];将稻瘟病菌(Magnaporthe grisea)的蛋白激发子PemG1基因转入水稻可提高植株对稻瘟病的抗性[11];将梨火疫病菌(Erwinia amylovora)产生的过敏蛋白Harpin基因导入马铃薯可提高对晚疫病的抗性[8],用Harpin处理苹果和甜瓜可有效提高果实的抗病性[12-13]。虽然蛋白类激发子在控制植物病害中的作用已有一些研究,但 多集中于田间病害,尚未见T. roseum源蛋白类激发子在果实上的应用报道。本实验拟以‘兰州大接杏’为试材,研究T. roseum菌体蛋白激发子处理对Alternaria alternata挑战接种杏果黑斑病的控制效果;探索处理后果实O2—·产生速率和H2O2含量的积累,以及主要抗氧化酶活性的变化;分析处理对果实病程相关蛋白的影响,以期为真菌源激发子在果蔬采后病害控制中的进一步应用提供理论依据。
1 材料与方法
1.1 材料与仪器
供试‘兰州大接杏’(Armeniaca vulgaris cv. Lam.)2013年7月采自甘肃省临洮县商业化杏园,采收后剔除伤、病果,选择大小、果色均匀、八成熟的杏果实,5 h运抵甘肃农业大学食品科学与工程学院采后生物学与技术实验室,0 ℃条件下贮藏待用。粉红单端孢(T. roseum)由本实验室提供;互隔交链孢(A. alternata)分离于自然发病的杏果实,经纯化鉴定后马铃薯葡萄糖琼脂培养基上保存待用。
SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;DHP-9272B型恒温培养箱 上海一恒科技有限公司。
1.2 方法
1.2.1 T. roseum菌体粗蛋白激发子的制备
参照Zhao Mingzhi等[14]方法稍有改动,从低温保存的种管挑取少量菌丝体,转接到固体马铃薯葡萄糖琼脂培养基上,培养3~5 d后制备孢子悬浮液,按照1.5%(V/V)接种量接种到液体培养基,150 r/min、28℃振荡培养,7 d后真空抽滤用蒸馏水洗涤多次的菌体并获得抽干菌体,—80 ℃保存备用。取菌丝体10 g置于液氮研磨成粉末,迅速加入40 mL蛋白提取液(20 mmo1/L Tris-HCl缓冲液pH 7.0,2 mmo1/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA))振荡混匀并提取1 h,沸水浴30 min后迅速冷却,于4 ℃、12 000 r/min离心30 min,取上清液用0.45 μm滤膜过滤,即为粗蛋白激发子。
1.2.2 孢子悬浮液配制
参照周德庆[15]方法。取28 ℃条件下培养7 d的A. alternata,加入含0.05% Tween 20的无菌水20 mL,用涂布棒刮下平板上的病原菌孢子,然后转入50 mL三角瓶中,在WYX-A微型旋涡混合器上振荡15 s,再用双层无菌纱布过滤,滤液用血球计数板计数算出孢子悬浮液的浓度后,最后稀释至所需浓度(1×106孢子/mL)。
1.2.3 果实的处理
将果实分两组,第1组分别用蒸馏水(CK)、144、14.4、1.44 μg/mL的粗蛋白激发子(以蛋白质量浓度计)喷洒处理,并晾干表面水分别装箱于常温,处理后12、24、36、48、60、72 h的杏果用灭菌打孔器(直径3 mm)在果实阴阳面的赤道部位均匀刺孔2个(深约3 mm),待孔中果实汁液晾干后,分别接入20 μL A. alternata孢子悬浮液(1.0×106孢子/mL),晾干后将相同处理每3个装入一个带孔保鲜袋(厚0.01 mm),常温(25±2) ℃贮藏,第3天观察病斑并采用十字交叉法测量病斑直径。每个处理15 个杏果,重复3 次。
第2组分别用蒸馏水和最佳处理质量浓度的粗蛋白激发子喷洒,晾干后装箱置于2 ℃冷库中。贮藏期间每隔12、24、48、72、96、120 h取3~5 mm果皮组织3 g(取样前回温1 h),用锡箔纸包好后立即用液氮进行冷冻,然后保存于—80 ℃待用。
1.2.4 O2—·产生速率和H2O2含量的测定
O2—·产生速率的测定参考王云飞等[16]方法略修改。称取3 g果皮组织,加5 mL、pH 7.8、100 mmol/L磷酸缓冲液,在冰浴条件下研磨成浆,4 ℃、12 000 r/min离心15 min。取1 mL上清液,加入1 mL磷酸缓冲液和0.5 mL 10 mmol/L的盐酸羟胺溶液,在25 ℃反应1 h。然后加入1 mL 17 mmol/L对氨基苯磺酸和1 mL 7 mmol/L α-萘胺,于25 ℃保温30 min。然后530 nm波长处测定OD值。以nmol/(min·g)表示O2—·产生速率,平行3次。
H2O2含量的测定参照高雄杰[17]方法略修改。称取3 g果皮组织,加入3 mL经4 ℃预冷的丙酮,冰浴条件下研磨成浆,4 ℃、12 000 r/min离心15 min。取1 mL上清液,加入100 μL 20%的四氯化钛溶液和200 μL浓氨水,混匀反应5 min后离心10 min。沉淀部分用经4 ℃预冷的丙酮洗涤8 次,最后将沉淀溶于3 mL 1 mol/L H2SO4溶液中,于410 nm波长处测定OD值。以标准H2O2溶液制作标准曲线,H2O2含量以μmol/g表示,平行3 次。
1.2.5 超氧化物歧化酶(su peroxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)活性的测定
SOD活性的测定参考曹建康等[18]方法略有修改。称取3 g果皮组织,加入5 mL经4℃预冷的100 mmol/L磷酸缓冲液,在冰浴中充分研磨,4 ℃、12 000 r/min离心20 min,上清液立即用于酶活性测定。于指形管中加入1.5 mL 50 mmol/L磷酸缓冲液,300 ☒L 130 mmol/L甲硫氨酸,300 ☒L 750 ☒mol/L氮蓝四唑,300 ☒L 100 ☒mol/L EDTA-Na2,100 ☒L粗酶液,最后加入300 ☒L 20 ☒mol/L核黄素,2支对照管以缓冲液代替酶液,混匀后将1支对照管置于暗处,其他各管于4 000 lx日光灯下反应15 min。以不照光管做空白参比,于560 nm波长处分别测定各管的OD值。活性以含每分钟每克果实组织的反应体系抑制氮蓝四唑光化还原的50%为一个活力单位(U)计算见公式(1):
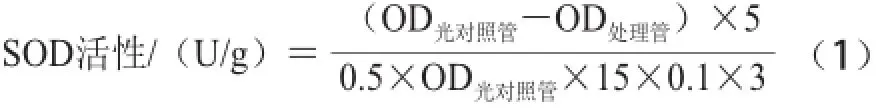
POD活性测定参照Bi Yang等[13]方法略修改。取3 g果皮组织,加入5 mL 50 mmol/L pH 5.9的磷酸缓冲液,在冰浴中充分研磨,4 ℃、12 000 r/min离心20 min,上清液用于POD活性测定。酶促反应体系为:1.8 mL 0.05 mol/L愈创木酚、100 μL粗酶液和100 μL 2% H2O2,以蒸馏水作对照,2 min内在470 nm波长处测定OD值的变化,以每克果蔬样品每分钟光密度值增加1时为1个POD活性单位,其表示为ΔOD470nm/(min·g)。
PPO活性的测定参照任亚琳等[19]方法略修改。称3 g果皮组织,加入5 mL 50 mmol/L pH 5.5的磷酸缓冲液,在冰浴中充分研磨,4 ℃、12 000 r/min离心20 min,上清液用于PPO活性测定。酶促反应体系为:4 mL磷酸缓冲液、1 mL 50 mmoL邻苯二酚、100 μL的酶提取液,以蒸馏水作参比,2 min内在420 nm波长处测定OD值的变化,以每克果蔬样品每分钟光密度值增加1为1个PPO酶活性单位,其表示为ΔOD420nm/(min·g)。
1.2.6 β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)和几丁质酶(chitinas,CHT)活性的测定
CHT活性的测定参考曹建康等[18]方法并修改,称3 g果皮组织,加5 mL的29 mg EDTA、35 μL β-巯基乙醇、pH 5.2、50 mmol/L乙酸-乙酸钠缓冲液,在冰浴中充分研磨,4℃、12 000 r/min离心30 min,取上清液,与5 倍体积的预冷丙酮混合,置于—20 ℃沉淀蛋白质,离心收集沉淀,最后用氮气吹干,将其溶解于提取缓冲液中,同样条件下离心收集上清,反应酶体系为:0.5 mL 50 mmol/L乙酸-乙酸钠缓冲液、0.5 mL 10 g/L胶状几丁质悬浮液、0.5 mL的酶提取液,以灭活的酶液作对照。反应管置于37 ℃反应1 h,后加入0.2 mL 0.6 mol/L四硼酸钾溶液,沸水浴中煮沸3 min,迅速冷却,在585 nm波长处进行操作,重复3 次。以每秒每克样品中酶分解胶状几丁质产生1× 10—6N-乙酰葡萄糖胺为一个CHT活性单位,单位是10—6mol/(s·g),计算见公式(2):
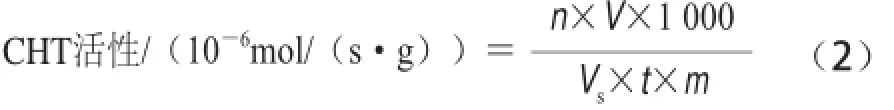
式中:n为从标准曲线查得的N-乙酰葡萄糖胺的量/μmol;V为样品提取液总体积/mL;Vs为测定时所取样品提取液体积/mL;t为酶促反应时间/s;m为样品质量/g。GLU活性的测定参考曹建康等[18]方法并修改,称3 g果皮组织,加入预冷5 mL的29 mg EDTA、0.1 g/L抗坏血酸、35 μL β-巯基乙醇、pH 5.2、0.1 mol/L的乙酸-乙酸钠缓冲液,在冰浴中充分研磨,4 ℃、12 000×g离心30 min,上清液用于活性测定。200 μL 4 g/L昆布多糖为底物,以每秒每克样品中酶分解昆 布多糖产生1×10—3葡萄糖为一个GLU活单位,单位是10—3mol /(s·g),计算见公式(3):
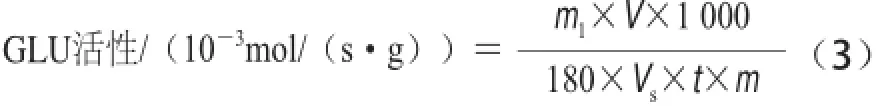
式中:m1为从标准曲线查得的葡萄糖的质量/mg;V为样品提取液总体积/mL;Vs为测定时所取样品提取液体积/mL;t为酶促反应时间/s;m为样品质量/g;180为葡萄糖相对分子质量。
1.2.7 蛋白含量测定
参照Brad ford[20]方法,以牛血清蛋白为标准蛋白作标准曲线,计算蛋白含量。
1.3 数据分析
用SPSS 17.0软件对实验数据进行多重差异显著分析和Excel 2007软件对实验数据进行分析并绘制图表。
2 结果与分析
2.1 激发子处理对杏果抗黑斑病的影响
激发子处理均可明显降低杏果损伤接种A. alternata的病斑直径(P<0.05)(图1),但不同质量浓度激发子处理之间无显著性差异(P>0.05),其中以14.4 μg/mL的处理效果较好。处理与损伤接种的间隔时间对病斑直径的影响较大(P<0.01),当间隔48、60、72 h后病斑直径仅分别为同期对照的53.3%、49.1%和35.5%,说明不同处理时间而效果不同,诱导72 h时的抗病效果为处理组中最好。
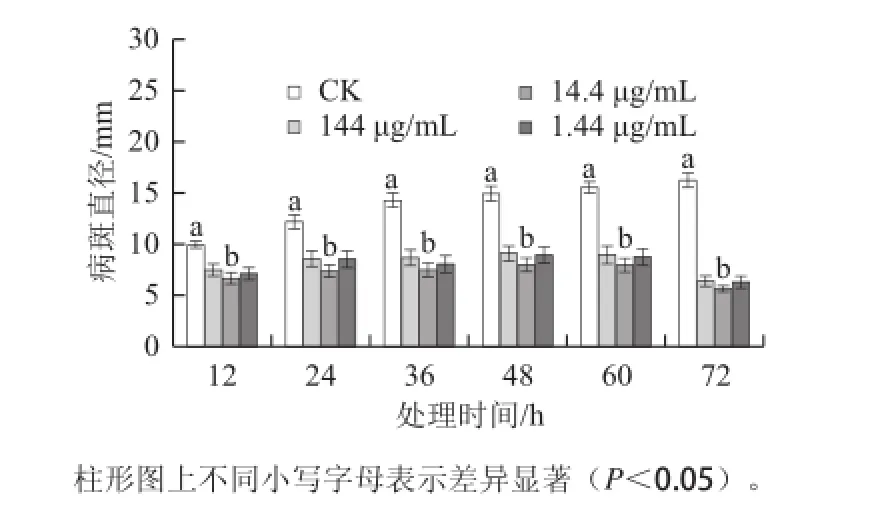
图1 T. roseum seum蛋白激发子处理对杏果抗黑斑病的影响Fig.1 Effect of treatment with protein elicitor from T. roseum on resistance in apricot fruits against Alternaria rot图2 T.rosseeuumm蛋白激发子处理对杏果生成速率(aa)和H2O2含量(bb)的影响Fig.2 Effect of treatment with protein elicitor from T. roseum on· generation rate and H2O2content in apricot fruit tissue
2.2 激发子处理对杏果组织O2—·生成速率和H2O2含量的影响
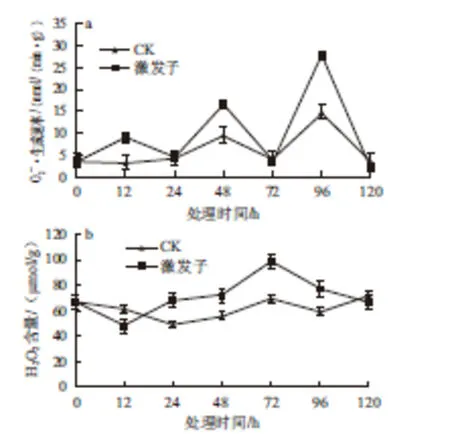
图1 T. roseum seum蛋白激发子处理对杏果抗黑斑病的影响Fig.1 Effect of treatment with protein elicitor from T. roseum on resistance in apricot fruits against Alternaria rot图2 T.rosseeuumm蛋白激发子处理对杏果生成速率(aa)和H2O2含量(bb)的影响Fig.2 Effect of treatment with protein elicitor from T. roseum on· generation rate and H2O2content in apricot fruit tissue
2.3 激发子处理后对杏果组织SOD、POD、PPO活性的影响
激发子处理能显著提高杏果组织SOD、POD和PPO的活性(图3)。在处理后12 h内,处理组和对照组果实SOD活性无明显变化,之后处理组活性逐渐上升,48 h达到最大值,后期逐渐下降,而对照组在24 h之后呈先下降后上升趋势,且在48 h处理组SOD活性比对照组高出2.25 倍(图3a);对照组或处理组果实的POD活性均呈现先增加后降低趋势,但在12 h后处理组POD活性显著高于对照,在72 h达到最大值,其活性为对照的1.5 倍(图3b);处理组果实的PPO活性也呈现先上升后下降的趋势,尤其在处理48 h后,其活性显著高于对照,且为对照的3.86 倍,而对照组随时间的变化不大(图3c)。
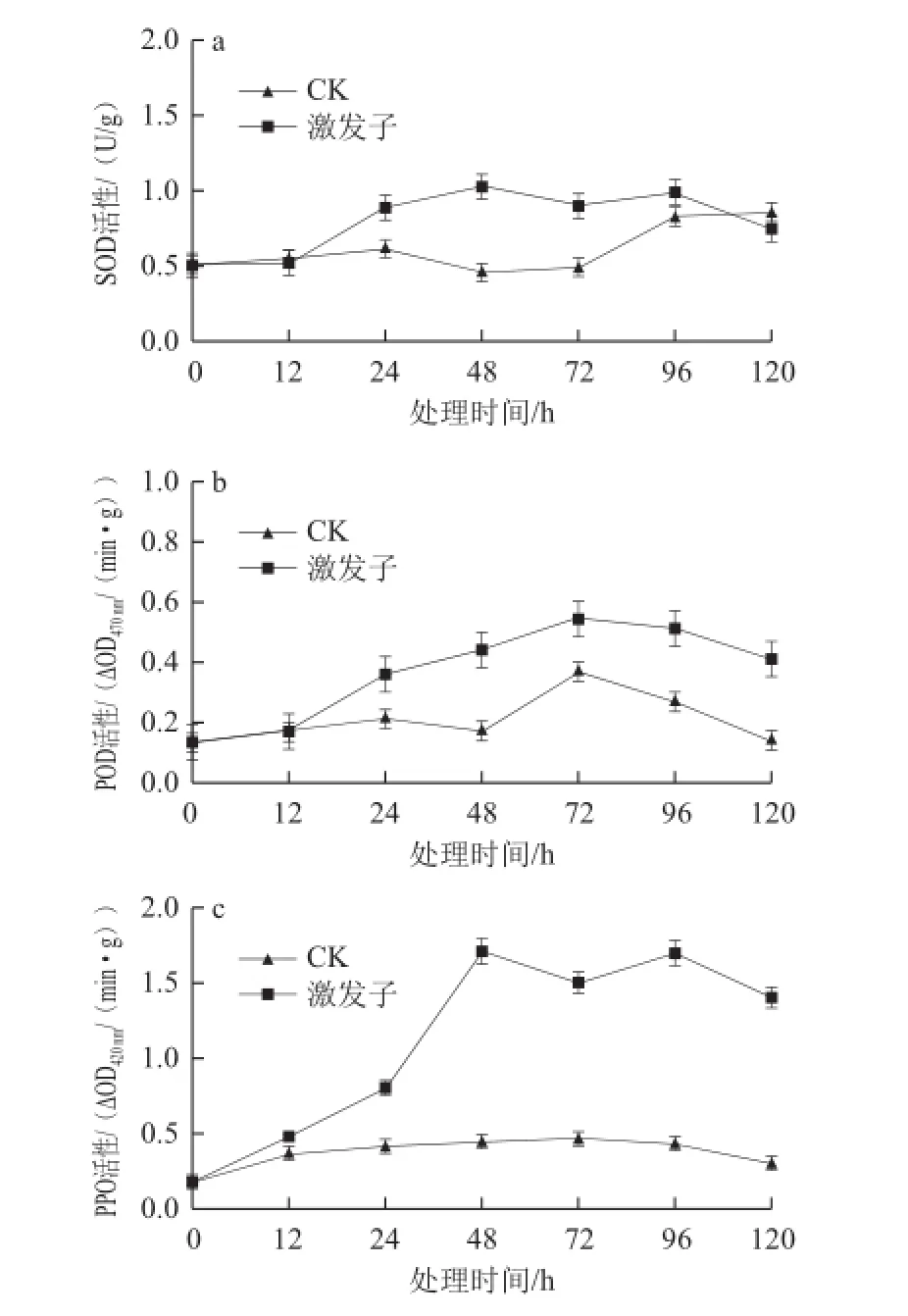
图 3 T. rseum蛋白激发子处理对杏果组织SOD(a)、PODD(bb)、PPO(c)活性的影Fig.3 The activities of SOD (a), POD (b) and PPO (c) in apricot fruit tissue treated with protein elicitor from T. roseum
2.4 激发子处理后对杏果组织GLU和CHT活性的影响
激发子处理均能有效提高杏果组织GLU、CHT的活性(图4)。杏的GLU活性呈现先上升后下降趋势,在12 h后处理组GLU活性高于对照组,72 h达到最大值,其活性是对照的1.3 倍(图4a);在120 h内处理组果实CHT活性明显高于对照,且活性呈上升趋势,在120 h处理组果实的CHT活性最大,为对照的2 倍(图4b)。
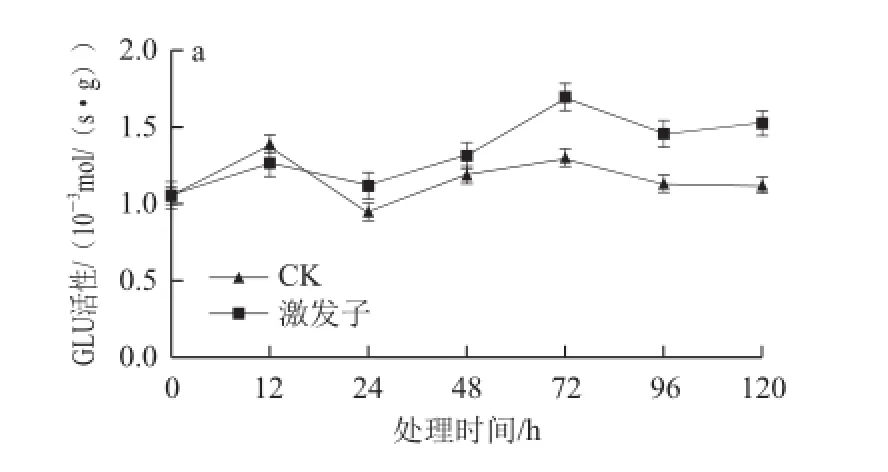

图4 4 T. roseum seum蛋白激发子处理对杏果组织GLU(a)和CHT(b)HTb活性的影响Fig.4 The activities of GLU (a) and CHT (b) in apricot fruit tissue treated with protein elicitor from T. roseum
3 讨论与结论
本研究结果表明,T. roseum菌体粗蛋白激发子可显著抑制‘兰州大接杏’损伤接种A. alternate病斑直径的扩展,促进活性氧(reactive oxygen species,ROS)爆发,增强SOD、POD和PPO的活性以及病程相关(pathogenesis related,PR)蛋白的积累,从而诱导了果实的抗病性。不同质量浓度激发子对果实抗病性的诱导效果存在差异,其中14.4 μg/mL的诱导效果较好。处理与损伤接种间隔时间对诱导效果影响较大,以间隔72 h时效果最好。该结果与前人在使用Harpin处理甜瓜[13]和甜橙[21]的结果类似,此外,真菌源蛋白激发子采前处理还可诱导葡萄对采后病害的抗性[22]。由此表明,微生物源蛋白激发子具有诱导果蔬抗病性的潜力,一定程度上可抑制采后病害的发生和发展。
ROS可使寄主产生多种抗性反应,如细胞壁加厚、过敏性细胞死亡、抗性基因的激活以及抗性物质的累积[23]。氧爆发是植物细胞对病原菌侵染和激发子处理后产生的一种重要早期事件[24]。本研究结果显示,T. roseum菌体粗蛋白激发子导致了杏果实O2—·产生速率和H2O2含量短暂而快速的升高,O2—·在处理后48 h达到最大 值,SOD活性也在48 h迅速增加,同时72 h时H2O2含量达到最大值,这可能是激发子处理后杏产生的O2—·在SOD作用下可迅速转化成H2O2,而在96 h处O2—·大量生成可能与其衰老有关。类似的研究[9,25]报道表明,真菌源蛋白激发子处理可短暂而快速的生成大量H2O2、NO,且激发烟草、水稻等抗病性增强。可见氧爆在介导微生物源激发子诱导植物抗病性中具有重要作用,近年来研究者发现ROS尤其是H2O2在植物SAR中可能是作为信号传导分子而发挥作用[26],其中位于原生质膜上的NADPH氧化酶利用NADPH作为电子供体,通过还原O2能够催化O2—·的产生,是植物氧爆过程中产生ROS的主要来源[27]。这些结果表明,蛋白激发子诱导可产生大量的ROS,其可能在激发子诱导的杏采后抗病反应中起到了重要作用,但是NOX与前期ROS产生的关系有待进一步研究。
尽管ROS在增强植物的抗病性中有着重要的作用,然而植物体内积累的ROS含量过高时就会对植物组织造成毒害作用,导致脂质过氧化、损伤 膜脂和膜蛋白、加速植物衰老等[28],为了避免ROS的伤害,植物形成了自己的抗氧化系统使ROS不能过量积累。本结果显示T. roseum激发子能诱导杏果SOD、POD及PPO的活性增加,在蛋白激发子处理番茄叶片[29]和棉花叶片[30]时也观察到这一现象。可见SOD作为调控ROS的关键酶,可通过催化组织内O2—·快速转变为H2O2。而POD可通过氧化酚类物质分解H2O2,与对照相比激发子处理的杏果其POD在72 h显著增加,由此表明在H2O2大量生成的时候,其PO D的活性也随之增强达到保护杏的抗氧化能力。同时POD和PPO活性增加可促进果实木质素合成,木质化不仅形成抵御病原菌侵入的物理屏障物,而且PPO可利用O2将酚类物质氧化形成的醌类物质对病原菌也有很强的毒害作用[31]。PPO的活性随着处理时间而增强,在处理期间48 h时其活性最强。类似报道表明,Harpin处理可诱导甜瓜POD活性增强[13];真菌源激发子处理诱导水稻、番茄的PPO和POD活性增强从而提高抗性[25,32]。这可能是通过调节蛋白激发子处理植物和果实组织后其体内ROS水平和一系列抗性相关酶SOD、POD、PPO活性之间的平衡关系来维持自身的抗病性,同时也可能因为PPO利用ROS使细胞壁加厚有关,抵御病原物侵入。
激发子被识别后,信号传导网络被激活、胞内相关基因重编码,与此同时具有PR功能蛋白也被激活表达[33]。本研究显示,激发子处理后杏GLU和CHT活性较对照组均有显著增加,随着处理时间的推移其活性逐渐增强。与此类似的报道表明,Harpin处理可诱导甜瓜CHT活性增强[13],目前未见真菌源激发子诱导植物组织产生PR蛋白的报道。这可能由于激发子被识别后产生ROS,其作为信号分子激活了果实体内的SA积累,诱导一系列抗氧化酶活性的变化,同时激活了GLU和CHT的大量表达,从而诱导杏的抗病性。因此该蛋白激发子处理后诱导杏果抗病性过程中产生的ROS与GLU、CHT可通过SA联系起来进行进一步研究。
T. roseum菌体粗蛋白激发子处理能显著降低接 种A. alternate‘兰州大接杏’杏果病斑直径的扩展。其中14.4 μg/mL的蛋白激发子抗病效果最显著,72 h时抗病效果最好。用激发子处理后有短暂而大量的ROS产生,并诱导了杏果抗性相关酶SOD、PPO、POD、CHT、GLU等活性的提高。由此表明,T. roseum菌体粗蛋白激发子处理可通过影响果实ROS及抗性相关酶来增强杏对采后病害的控制。激发子一般是通过早期信号被激活、影响能量代谢最后通过苯丙烷代谢过程形成抗性相关物质来体现其诱导抗性,因此本实验杏抗病性的研究中需进一步系统研究能量及苯丙烷代谢过程进一步阐述其诱导抗性作用机理;同时需进一步纯化菌体粗蛋白,研究何种蛋白在抗性中起关键性作用。
[1] 张波, 韩舜愈, 蒋玉梅, 等. 硅酸钠处理对杏品质和风味物质的影响[J].农业工程学报, 2011, 27(6): 375-381.
[2] 于希志. 试谈我国杏生产现状与对策[J]. 北方果树, 2003, 5(9): 25-25. [3] 陈松江, 毕阳, 李永才, 等. 一氧化氮处理对杏果实贮藏品质的影响[J].食品科技, 2011, 36(6): 46-50.
[4] ANTUNES M D C, MIGUEL M G, NEVES M A, et al. Quality changes during storage of apricot (Prunus armeniaca L.) cv. ‘Beliana’and ‘Lindo’ trated with calcium[M]//NUNES C. Environmentall y friendly and safe technologies for quality of fruit and vegetables. Universidade do A lgarve, 2010: 117-120.
[5] 王文娟, 李永才, 毕阳, 等. 硼酸盐处理对采后杏果软腐病的控制及贮藏品质的影响[J]. 食品科学, 2012, 34(18): 280-284.
[6] 范存斐, 毕阳, 王云飞, 等. 水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响[J]. 中国农业科学, 2012, 45(3): 584-589.
[7] 邱德文. 生物农药与生物防治发展战略浅谈[J]. 中国农业科技导报, 2011, 13(5): 88-92.
[8] 邱德文. 微生物蛋白农药研究进展[J]. 中国生物防治, 2004, 20(2): 91-94.
[9] KULYE M, LIU Hua, ZHANG Yu liang, et al. Hrip1, a novel protein elicitor from necrotrophic fungus, Alternaria tenuissima, elicits cell death, expression of defence-related genes and systemic acquired resistance in tobacco[J]. Plant, Cell and Environment, 2012, 35(12): 2104-2120.
[10] 彭学聪, 杨秀芬, 邱德文, 等. 蛋白激发子Hrip1基因在拟南芥中表达可提高植株的耐盐耐旱能力[J]. 作物学报, 2013, 39(8): 1345-1351.
[11] QIU Dewen, MAO Jianjun, YANG Xiufen, et al. Expression of an elicitor-encoding gene from Magnaporthe grisea enhances resistance against blast disease in transgenic rice[J]. Plant Cell Reports, 2009, 28(6): 925-933.
[12] CAPDEVILLE G D, BEER S V, WILSON C L, et al. Some cellular correlates of harpin-induced resistance to blue mold of apples[J]. Tropical Plant Patholo gy, 2008, 33: 103-113.
[13] BI Yang, TIAN Shiping, ZHAO Jie, et al. Harpin induces local and systemic resistance against Trichothecium roseum in harvested Hami melons[J]. Postharvest Biology and Technology, 2005, 38(2): 183-187.
[14] ZHAO Mingzhi, YANG Xiufen, ZHANG Ming, et al. Purification and bioactivities of a protein growth-activator from Aternaria tenuissima[J]. Chinese Journal of Biological Control, 2007, 23(2): 170-173.
[15] 周德庆. 微生物学实验教程[M]. 2版. 北京: 高等教育出版社, 2006.
[16] 王云飞, 毕阳, 任亚琳, 等. 硅酸钠处理对厚皮甜瓜果实采后病害的控制及活性氧代谢的作用[J]. 中国农业科学, 2012, 45(11): 2242-2248.
[17] 高雄杰. 采后硅酸钠处理对‘玉金香’甜瓜活性氧及其代谢体系的诱导[D]. 兰州: 甘肃农业大学, 2010.
[18] 曹建康, 姜微波, 赵玉梅. 果 蔬采后生理生化实验指导书[M]. 北京:中国轻工业出版社, 2007.
[19] 任亚琳, 毕阳, 葛永红, 等. BTH浸泡处理对厚皮甜瓜采后病害的控制及贮藏品质的影响[J]. 食品科学, 2013, 34(2): 267-272.
[20] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[21] LUCON C M M, GUZZO C O, de JESUS C O, et al. Postharvest harpin or Bacillus thuringiensis treatments suppress citrus black spot in ‘Valencia’ oranges[J]. Crop Protection, 2010, 29(7): 766-772.
[22] 关文强, 李宁, 段双科. 真菌源激发子对采后葡萄果皮抗性产生的诱导[J]. 西北植物学报, 2005, 25(12): 2408-2412.
[23] VELLOSILLO T, VICENTE J, KULASEKARAN S, et al. Emerging complexity in reactive oxygen species production and signaling during the response of plants to pathogens[J]. Plant Physiology, 2010, 154(2): 444-448.
[24] ALBERT P, MIYA A, HIRATSUKA K, et al. A high-throug hput evaluation system for Arabidopsis mutants for defense signaling[J]. Plant Biotechnology, 2006, 23(5): 459-466.
[25] 袁肖寒, 顾成波, 邱德文, 等. 新型真菌源激活蛋白诱导水稻抗病性及其生理机制[J]. 植物研究, 2013, 33(2): 220-224.
[26] QUAN Lijuan, ZHANG Bo, SHI Weiwei, et al. Hydrogen peroxide in plants: a versatile molecule of the reactive oxygen species network[J]. Journal of Integrative Plant Biology, 2008, 50(1): 2-18.
[27] HYON G S, IKEDA K, HOSOGI N, et al. Inhibitory effects of antioxidant reagent in reactive oxygen species generation and penetration of appressoria of Alternaria alternata Japanese pear pathotype[J]. Phytopathology, 2010, 100: 840-847.
[28] GONZALEZ A G A, VILLA J A, AYALA J F, et al. Improvement of the antioxidant status of tropical fruits as a secondary response to some postharvest treatments[J]. Trends in Food Science and Technology, 2010, 21: 475-482.
[29] 李丽, 刘峥, 杨秀芬, 等. 植物激活蛋白对番茄防御酶活性的影响[J].湖南农业大学学报: 自然科学版, 2008, 34(5): 534-537.
[30] 张志刚, 杨晓萍, 卢翰, 等. 细极链格孢菌蛋白激发子对棉花生长相关酶活性的影响[J]. 棉花学报, 2010, 22(2): 120-124.
[31] 李永才, 毕阳, 胡洁, 等. 真菌菌丝细胞壁提取物对马铃薯块茎组织抗干腐病的诱导效应[J]. 西北植物学报, 2009, 29(4): 749-753.
[32] MANDAL S, MITRA A. Reinforcement of cell wall in roots of Lycopersicon esculentum through induction of phenolic compounds and lignin by elicitors[J]. Physiological and Molecular Plant Pathology, 2007, 71(4): 201-209.
[33] GENDA Y, KANDA A, HAMADA H, et al. Two amino acid substitutions in the coat protein of pepper mild mottle virus are responsible for overcoming the L4gene-mediated resistance in capsicum spp[J]. Phytopathology, 2007, 97(7): 787-793.
Mechanism of Alternaria Rot Resistance Induced in Apricot Fruits by Protein Elicitor from Trichothecium roseum
YU Xiaoyan, BI Yang, LI Yongcai*, YAN Lu, SHEN Keping, HU Lingang, TANG Yamei
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
The effect of protein elicitor from the nonhost Trichothecium roseum on black rot of apricot fruits and its possible induction mechanisms were studied. The inductive effect and its time-dependent manner of the protein elicitor in apricot fruits inoculated with Alternaria alternate at different times after treatment were studied. The effect of selected optimum concentration of protein elicitor on reactive oxygen species (ROS) and resistance-related enzymes in apricot fruit tissue were also evaluated. The lesion development of wound-inoculated apricot fruits were signifi cantly reduced by protein elicitor treatment(P < 0.05), and at 72 h after treatment with 14.4 μg/mL protein elicitorthe best induction effect on apricot fruits was observed. The rate of superoxide anion (O2-・) production and the content of hydrogen peroxide (H2O2) in fruit tissue reached the peak at 48 and 72 h, respectively. The activities of superoxide dismutase (SOD), peroxidase (POD), polyphenol oxidase (PPO), β-1,3-glucanase (GLU) and chitinase (CHT) in apricot fruit tissue treated with the protein elicitor were also increased. The protein elicitor treatment could signifi cantly increase the disease resistance of apricot fruit tissue, and the possible mechanism might be due to the outburst of RO S and the improved activities of resistance-related enzymes. So protein elicitor from Trichothecium roseum may be a potential resistance inducer and can be further applied to postharvest diseases control.
Trichothecium roseum; protein elicitor; apricot fruit; reactive oxygen species; induced disease resistance; Alternaria rot
TS201.3
A
1002-6630(2015)04-0254-06
10.7506/spkx1002-6630-201504050
2014-04-21
甘肃省农牧厅生物技术专项(GNSW-2011-11)
余晓燕(1988—),女,硕士研究生,研究方向为采后生物学与技术。E-mail:y198808150028@163.com
*通信作者:李永才(1972—),男,副教授,博士,研究方向为果蔬采后生物学与技术。E-mail:liyongcai@gsau.edu.cn

