竹节参根状茎总RNA提取方法的研究与优化
通信作者:陈平(1958-),女,教授,E-mail:chenpingvip24@163.com.
竹节参根状茎总RNA提取方法的研究与优化
吴亚运1,张绍鹏1,赵小龙1,宋佳1,陈平1,2
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;湖北道地药材分子生物学实验室,湖北 武汉 430023)
摘要:针对竹节参根状茎质地坚硬、植物纤维多,富含多糖、酚类、蛋白质及其他多种次生代谢产物的特点,研究竹节参根状茎总RNA提取方法。分别运用Trizol法、Total RNA Kit植物提取试剂法、CTAB法进行总RNA的提取。借鉴人参根组织RNA的提取经验,根据竹节参的自身特点,有针对性的对CTAB法和Trizol法进行了优化,样品裂解后中加入PVPP(聚乙烯聚吡咯烷酮)和B-巯基乙醇去除酚类,并加入乙酸钠营造出高浓度钠离子环境去除多糖,之后再加入70%高氯酸钠溶液去除蛋白质,并对提取的总RNA进行电泳和OD值检测与分析。优化后的3种方法进行对比发现,对于竹节参总RNA的提取效果有较大差异,其中优化的Trizol法提取的RNA电泳28S、18S条带清晰,比值约为2:1,经紫外光谱分析OD260/OD280比值为1.93,OD260/OD230比值为2.07,获得了纯度高、完整性好的总RNA。进一步以优化的Trizol法提取所得RNA为模版进行反转录,并做RT-PCR,结果表明,RT-PCR的带型特异稳定,优化方法提取的总RNA质量稳定可靠,适用于基因表达等后续分子生物学研究。优化的Trizol法是一种适合于竹节参根状茎总RNA抽提的简单快速有效的方法。
关键词:竹节参;RNA提取;RT-PCR;根状茎;多糖;多酚
收稿日期:2015-01-22.修回日期:2015-04-28.
作者简介:吴亚运(1990-),男,硕士研究生,E-mail:282595491@qq.com.
基金项目:湖北省教育厅科学研究青年项目(Q20141704).
文章编号:2095-7386(2015)03-0011-05
DOI:10.3969/j.issn.2095-7386.2015.03.003
中图分类号:Q 949;TQ 460.6
Analysis and optimization of high-quality RNA extraction
in rhizomesofPanaxjaponicusC.A.Mey
WUYa-yun1,ZHANGShao-peng1,ZHAOXiao-long1,SONGJia1,CHENPing1,2
(1.School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China;
2.Lab of MolecularPharmacology of Traditional Chinese Medicine in Hubei, Wuhan 430023,China)
Abstract:Extraction of high-quality total RNA from the rhizomes secondary metaboli tes of Panax japonicus is always difficult due to rich fibers and hard tissues during the sampling grinding, and high levels of polyphenolcs, polysaccharides even secondary metabolies that coprecipitate with RNA during the RNA extraction. Three extraction methods, modified Trizol, Total RNA Kit plant extraction reagent method, modified CTAB were compared and improved to isolate RNA of rhizomes from Panax.japonicus. Especiallly of CTAB and Trizol method, the PVPP(Polyvinylpyrrolidone) and B-Mercaptoethanol were added after plant cell lysis so as to remove polyphenolcs. And Sodium acetate trihydrate and 70% Sodium perchlorate were then added to remove polysaccharides and protein. After these three methods, total RNA can be obtained with different RNA quality as determined by electrophoresis and UV-spectroscopic analysis. The modified Trizol method can extract high-quality and high-integrity RNA as determined by UV-spectroscopic analysis showing the OD260/OD280 at 1.93 and OD260/OD230 at 2.07. The electrophoresis profile showed that the lightness at 28S was 2 times higher than that at 18S. Then, the RNA were transcribed into complementary DNA (cDNA) by using poly(A) primer. The resulting cDNA were used for reverse transcription polymerase chain reaction (RT-PCR), which showed the stable and specific bands. These results indicate that our extracted RNA is suitable for gene expression analysis. The result showed that the modified Trizol method was simple, convenient, efficient for extracting Panax japonicus rhizomes total RNA.
Key words:PanaxjaponicusC.A.Mey;RNA extraction; RT-PCR;rhizomes;polysaccharide;polyphenol
1引言
竹节参(PanaxjaponicusC.A.Mey)是五加科人参属植物。该植物的主要活性成分是次生代谢产物三萜皂苷,根状茎则是其最常用的药用部位[1]。竹节参兼具人参滋补和三七活血化瘀的功效,在我国南方土家苗族民间医疗中被誉为“万草之王” ,市场应用前景十分广泛。目前对竹节参的药用研究主要集中于其有效成分、结构、药理作用以及临床应用等几个方面,这是传统中药与现代药物化学、药理学、病理学的常规、宏观的结合项目。但在微观领域的分子层面,利用现代基因组与基因组学即基因的结构、表达、控制与功能分析和植物分子生物技术来影响植物体内次生代谢产物的合成与调控等方面却趋于空白。
要深入研究竹节参中基因遗传学基础对次生代谢产物的影响,获取纯度高、质量好的总RNA就成为了首要前提。由于植物细胞壁及植物组织细胞中内含物多,成分复杂且含有包括RNAse在内的多种酶等因素的影响,使得植物组织RNA的提取相比于其它类型的组织样本较为困难。竹节参属人参属,与人参相比较,在其根状茎中不但含有多糖、多酚、色素、蛋白质等人参组织中常见的与RNA结构相似或是易与RNA发生反应并产生沉淀的“特有物质” ,而且竹节参根状茎组织质地更加坚硬、植物纤维更多、RNA的富含丰度更小,使得竹节参RNA的提取难度相比于人参组织更大[2]。鉴于此,笔者在人参根组织总RNA提取方法和经验的基础上,结合竹节参的自身特点,尝试了优化的Trizol法、Total RNA Kit植物提取试剂法、优化的CTAB法3种从竹节参根状茎组织中提取总RNA的方法。经过多次试验和对提取结果的综合比较,发现优化的Trizol法能够快速简单有效的提取出高质量的总RNA。每克新鲜组织RNA产量在100—120 μg之间,电泳分析28sRNA荧光亮度约为18sRNA亮度的2倍,OD260/280值介于1.8—2.0之间,OD260/OD230值介于2.0—2.2之间。这就成为开展RT-PCR、RACE、CDNA文库构建,进行基因克隆和基因表达分析等后续分子生物学实践操作的基础。
2材料与试剂
2.1实验材料
6年生竹节参植株,采自湖北省恩施市人参培养基地。取新鲜竹节参根茎由自来水冲洗,70%乙醇浸泡消毒,无菌水冲洗后经消毒滤纸吸干水分,于液氮中快速冷冻并保存于-80 ℃。
2.2实验试剂
(1)CTAB提取液:2%CTAB(Hexadecyl trimethyl ammonium Bromide );2%β-Mercaptoethanol;2%PVP(Polyvinylpyrrolidone);100mmol/L Tris-Hcl(pH8.0);30mmol/L EDTA;2.0mmol/L Nacl;氯仿-异戊醇(24:1);4mol/L LiCl。(2)SSTE:1mmol/L EDTA(pH8.0);1.0mol/L Nacl;0.5%SDS;10mmol/L Tris-Hcl(pH8.0)。(3)用于总RNA提取操作使用的塑料制品如Eppendorf管(以下简称EP管)、枪头等用0.1%DEPC水,37 ℃处理12 h,然后高压灭菌后备用。玻璃器皿于180 ℃干热灭菌6 h,电泳槽用3%双氧水处理。总RNA提取操作中的配置的溶液(Tris除外)均需经0.1%DEPC水,37℃处理24 h,高压灭菌后方可使用。含Tris的溶液用经高压灭菌的0.1%DEPC处理的水配置。(4)Trizol购自Invitrogen公司;Total RNA Kit试剂盒购自北京艾德莱生物科技有限公司;PVP、DEPC、SDS购自AMRESCO公司其它生化试剂均为国产分析纯。
3实验方法和检测
3.1优化的CTAB法
(1)提取操作开始前先将CTAB提取液分装,每管100 μL,置于水浴锅中65 ℃预热30 min。(2)称0.1 g竹节参根状茎样本于经液氮预冷的研钵中充分研磨至粉末,快速转移样本粉至装有100 μL CTAB提取液的EP管中,立即涡旋振荡30 s,65℃水浴锅中水浴5min。(3)每管加入100 uL 氯仿/异戊醇(24:1)充分振荡后,12 000 r/min 离心20min,转移上清液到新的EP管中,重复氯仿/异戊醇(24:1)抽提一次。(4)转移上清液到新的EP管,加入上清液1/2体积的4mol/L氯化锂,-4℃过夜沉淀。(5)4℃ 12 000 r/min 离心20 min,弃上清液保留沉淀。(6)向管中加入500 μL 75%乙醇漂洗除去氯化锂,室温 12 000 r/min离心2 min 弃上清液后加入500μL SSTE溶解沉淀并将溶液转移到新的EP管中,向管中加入500μL 氯仿/异戊醇(24:1)混匀,12 000 r/min离心20 min,取上清液到新的EP管中,加入上清液2倍体积的无水乙醇 -20 ℃沉淀2 h,4 ℃ 12 000 r/min 离心20 min沉淀RNA,弃上清液,加入400 μL 70%乙醇洗涤沉淀,4℃ 12 000 r/min 离心10 min。 再加入400μL 无水乙醇洗涤沉淀4℃ 12 000 r/min 10 min。(9)将得到的沉淀置于通风橱中晾干,加入30 μL DEPC水,-80℃保存[3]。
3.2优化的Trizol法
(1)称0.1g竹节参根状茎样本于经液氮预冷研钵中充分研磨至粉末,快速转移样本粉末至装有1mL Triaol裂解液的EP管中,涡旋混匀后室温静置10min。(2)4 ℃ 12 000 r/min 离心10 min弃沉淀,收集上清液至新的EP管中。(3)向EP管中加入200 μL 氯仿,50μL 乙酸钠(2mol/L),15μL B-巯基乙醇,2%pvp5μL涡旋混匀,冰浴10 min,使反应充分进行。(4)4 ℃ 12 000 r/min 离心15 min,收集上清液至新的EP管中,加入70%高氯酸钠200 μL充分混匀后 4 ℃ 12 000 r/min 离心10 min 弃沉淀 转移上清液至新的EP管中。(6)向EP管中加入与上清液等体积的异丙醇和200 μL乙酸钠(3mol/L) 颠倒混匀 -20℃沉淀1h(7)4℃ 12 000r/min 离心10 min 弃上清液 后用1mL 75%乙醇洗涤沉淀在温度为4 ℃时,12 000 r/min 离心5 min 弃上清液(重复一次)。(8)将得到的沉淀置于通风橱中晾干,加入30 μL DEPC水,-80℃保存[3]。
3.3Total RNA Kit植物提取试剂法
(1)称0.1g竹节参根状茎样本于经液氮预冷研钵中充分研磨至粉末,快速转移样本粉末至装有1mL TRNsol裂解液的EP管中,涡旋混匀。(2)每1mL TRNsol中加入200 μL 氯仿,剧烈震荡15s,冰上放置5 min。室温12 000 r/min 离心10 min。(3)将上层水相体积80%转移至新的EP管中,加入水相体积70%的无水乙醇,混匀。(4)将混合液全部注入GBC吸附柱中,12 000 r/min 离心30 s。(5)离心后弃掉收集管中的废液,向GBC吸附柱中加入500 μL wash buffer 1 室温 12 000 r/min 离心1 min 后弃废液。(6)向GBC吸附柱中加入600 μL wash buffer 2,室温 12 000 r/min,离心30 s 弃废液。(7)再向GBC吸附柱中加一次600 μL wash buffer 2 离心30 s 弃废液 将GBC吸附柱放入新的收集管中。(8)室温 12 000 r/min 空离1 min弃废液,以彻底去除吸附柱中的漂洗液。(9)将GBC吸附柱放入新的收集管中,向柱中加入30 μL DEPC水,室温放置2 min,12 000 r/min离心1 min得到RNA,-80℃保存。
3.4竹节参总RNA质量检测
3.4.1RNA完整性检测
RNA的非变性琼脂糖凝胶电泳在1×TBE中进行,琼脂糖浓度为1%(每100mL凝胶中加入2 μLEB)。反应条件为:5 μL上样量,180V恒压,20min,而后于紫外凝胶成像仪中观察总RNA完整性。
3.4.2RNA纯度及产率检测
运用紫外分光光度计测定总RNA样本在230 nm、260 nm、280 nm处的吸光。取1 uL总RNA溶液,溶于1mL经DEPC处理的去离子水中,检测其吸光度值。无污染的总RNA其OD260/OD280为1.8—2.0,OD260/OD230为2.0—2.2。并可通过吸光度值得出RNA浓度:即每单位OD260的RNA浓度为40 μg/mL,RNA产率公式:(μg/g)=[OD260×稀释倍数×40 μg/mL×Vrna(mL)]/材料质量。
3.4.3RT-PCR
以TaKaRa公司AMV反转录酶操作说明,合成cDNA第一链,再以常规的PCR法扩增cDNA第二链。PCR(25 μL)体系包括:2 μL cDNA,15mmol/L MgCl2,1U Taq酶,0.2mmol dNTP,正向和反向引物各1mmol,根据NCBI人参16S核糖体RNA基因序列设计其特异引物D1、D2(引物序列为,正向引物D1:5’-GCTCGTGTCGTGAGATGTT-3’;反向引物D2:5’-TGTAGCCCAGGTCATAAGG-3’,上海桑尼生物科技有限公司合成)。扩增条件为:cDNA模版先于94 ℃变性3 min,再经35个循环扩增(94℃变性55 s,55 ℃退火40 s,72 ℃延伸1 min),最后72℃延伸8min。扩增完成后取4组产物每组5 μL于1%琼脂糖凝胶电泳检测。
4结果与分析
4.1总RNA电泳检测
采用1%琼脂糖凝胶电泳对总RNA的完整性进行检测(见图1)。
生物体内总RNA中rRNA含量最多,所以提取组织的总RNA中得到最多的就是rRNA。rRNA在植物组织中较多的是5 s、18 s和28 s,其中28 s和18 s含量多于5 s,所以电泳检测中的关键特征条带实际上就是28 s和18 s这两条带。28 s大约为4KNT而18 s为2KNTt,在细胞内28 S和18 S的分子数相同的(来源于同一个转录本),28 S的质量应该是18 S质量的2倍,电泳时插入28 S中的核酸燃料数量为18 S的2倍,所以条带的荧光亮度也是2倍。据图1中结果表明,优化的CTAB法提取的总RNA,18 s、28 s两条带十分模糊,在条带周围存在明显的拖带现象,说明得到的RNA降解严重。Total RNA Kit植物提取试剂法得到的总RNA能够看到两条带,但是28 s和18 s条带的荧光亮度几乎相等,未呈现出2倍的关系,说明提取得到的RNA有部分降解。优化的Trizol法提取的总RNA,在电泳后呈现出两条明显的条带,28 s和18 s两条特征条带的荧光亮度接近2∶1,表明总RNA没有降解,也无明显的DNA和蛋白质污染。
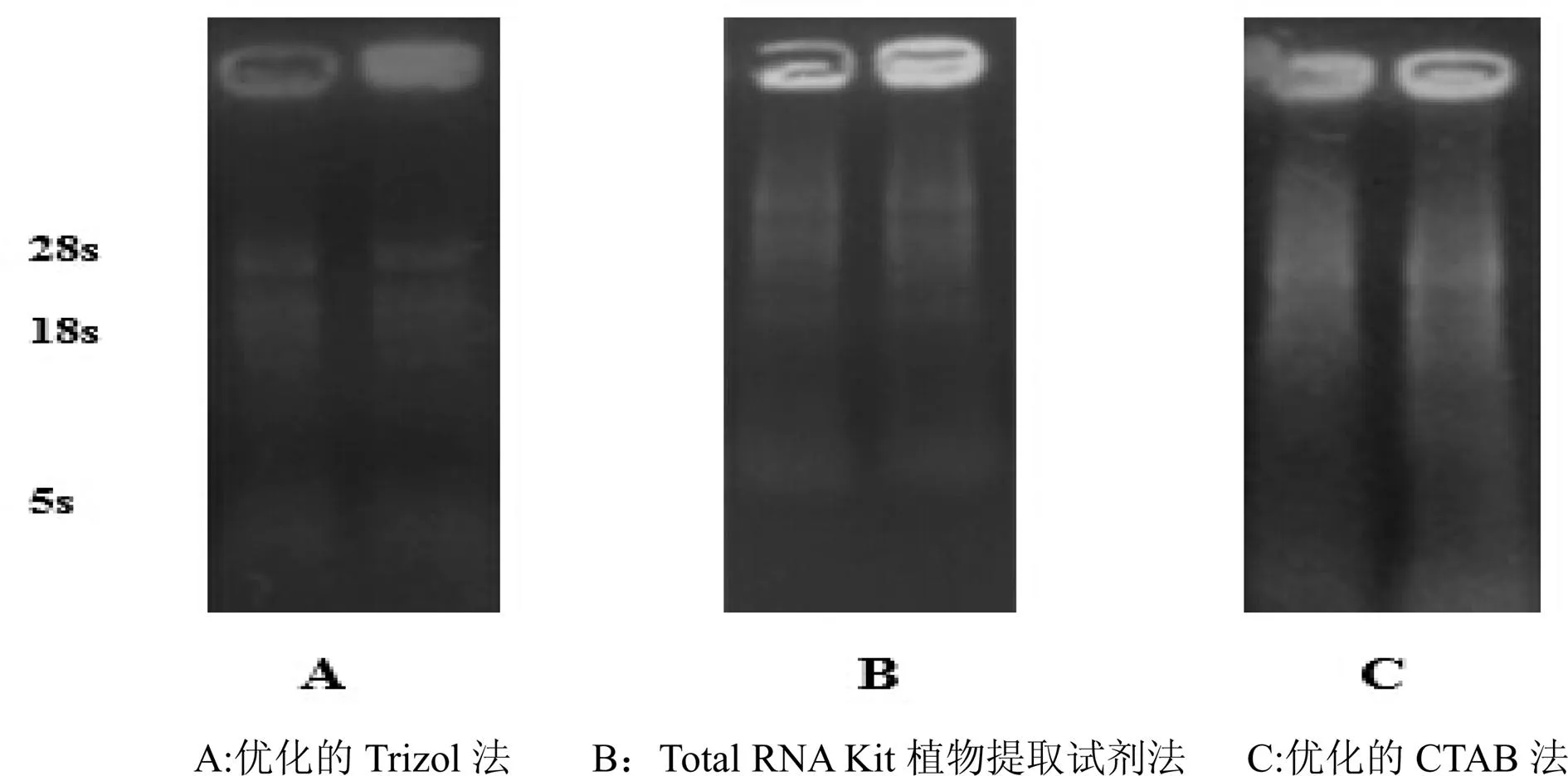
图1 电泳图
4.2总RNA质量检测
采用紫外分光光度计对总RNA的纯度及产率进行检测结果见表1。
纯净RNA的OD260/OD280比值的正常范围是1.8—2.0,比值小于1.8说明可能存在蛋白质或酚类等有机物的污染,比值大于2.0说明可能有残留的B-巯基乙醇。纯净RNA的OD260/OD230比值的正常范围是2.0—2.2,比值大于2.2说明RNA已水解为单核酸,比值小于2说明可能存在次生代谢产物(如萜类)干扰,通过吸光度值得出RNA浓度即每单位OD260的RNA为40 μg/mL,而RNA产率(ug/g)=[OD260×稀释倍数×40 μg/mL×Vrna(mL)]/材料质量。由表1中结果表明,优化的Trizol法提取的总RNA纯度较好,适宜于后续的实验研究。
表1纯度与产率
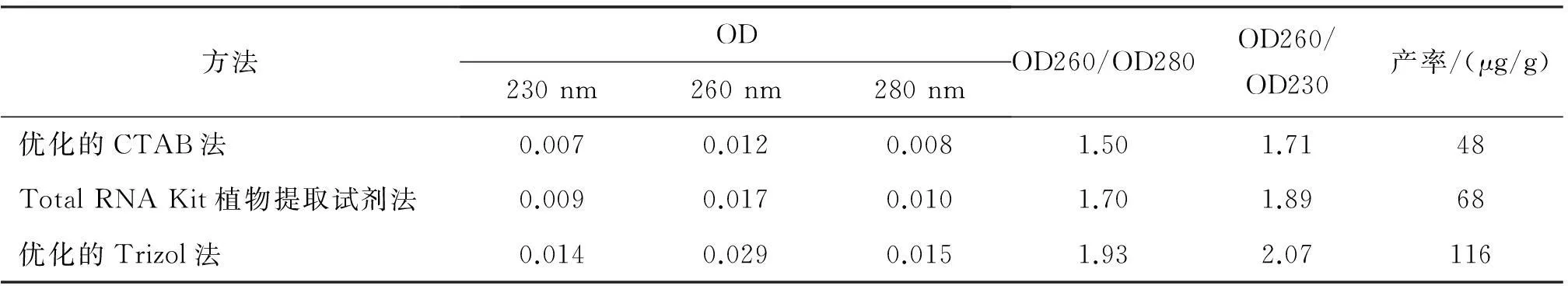
方法OD230nm260nm280nmOD260/OD280OD260/OD230产率/(μg/g)优化的CTAB法0.0070.0120.0081.501.7148TotalRNAKit植物提取试剂法0.0090.0170.0101.701.8968优化的Trizol法0.0140.0290.0151.932.07116
4.3RT-PCR
以优化的Trizol法提取的竹节参根状茎总RNA反转录合成cDNA为模版,人参16S核糖体RNA基因特异引物D1、D2为引物进行RT-PCR,预期扩增的目的片段长度为500 bp。实验结果表明(图2),已成功扩增出预计的目的片段,且目的片段条带清晰、长度相适,琼脂糖凝胶上亦未出现非特异产物。由此说明,优化的Trizol法提取得到了适宜于开展分子克隆和基因表达等后续分子生物学实验与研究所需的高质量RNA。
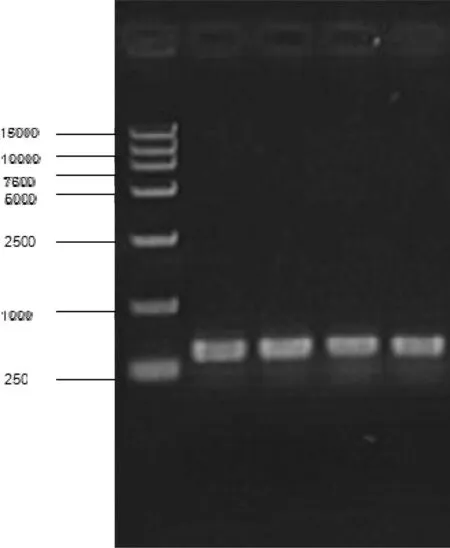
图2
5讨论
在竹节参根状茎总RNA的提取过程中,由于其质地坚硬,富含植物纤维,磨样困难。且根状茎组织中多糖、多酚含量高,在生长成熟过程中积累了许多的水解酶和色素,使得常规的提取方法无法从竹节参中获得高质量的RNA。探究其原因,是由于没有特殊针对性的试剂来去除这些杂质,导致RNA的损失。本研究中提取总RNA效果最好的方法,优化的Trizol法,在多次常规方法操作经验的基础上,有针对性的增加选用了除杂试剂、改进了实验操作步骤。检验结果表明,实验提取得到了高质量的总RNA。
酚类物质:在氧化条件下易被氧化成醌类。在常规实验操作中,有醌类物质的存在就会使处理液变为褐色,且颜色会随氧化程度的增加而加深,结果就是醌类与RNA发生不可逆结合并产生沉淀,导致RNA的大量损失。针对这种情况,在本次操作中加入了PVPP(聚乙烯聚吡咯烷酮)和B-巯基乙醇。B-巯基乙醇是强还原剂,能够产生还原环境防止多酚被氧化。PVPP是多酚类化合物的螯合剂,其中的O=C-N=基有很强的结合多酚化合物的能力。这两种试剂相互协作,B-巯基乙醇产生还原环境,使多酚保存原状并与PVPP充分结合,由后续的抽提步骤将它们去除[4]。在实验操作中发现,单一的加入B-巯基乙醇或是PVPP都无法有效的抑制多酚物质的氧化,两种试剂一起加入效果最好。多糖类:多糖在竹节参的根状茎中含量接近50%,它的理化性质与RNA相似,使得它们很难分离。在提取过程中,常规的氯仿分层抽提在除多糖的同时也会有RNA的损失。在沉淀RNA时,会产生大量白色沉淀,这些沉淀难溶于水或是溶解后产生黏稠状溶液,由于多糖可抑制多种酶的活性,受到多糖污染的RNA根本无法用于下一阶段的分子研究[5]。针对这种情况,在本次操作中加入了大量的乙酸钠,营造出高浓度的钠离子环境,在这种条件下,多糖会溶解在高浓
度的盐溶液中而RNA则会析出,通过氯仿和醇的抽提,可〗以很好的去除多糖杂质。在常规提取过程中,蛋白质是另外一个重要的障碍,在Trizol裂解液中,含有异硫氰酸胍、B-巯基乙醇等蛋白质变性剂,后续步骤中的氯仿也能变性蛋白质[6-7]。但Trizol法的工作容量是有限度的,当蛋白质含量较为丰富时,有的蛋白质就不会沉淀在中间层,而是溶解在上层液中。在竹节参根状茎RNA提取常规操作中,即使反复的加入氯仿分层抽提多次,依然可以清晰看到中间层的白色蛋白质沉淀,并且加入异丙醇后,会产生白色絮状沉淀,说明依然有蛋白质残留。针对这种情况,在本次试验操作中加入了70%高氯酸钠溶液,在此溶液中RNA的溶解度大于蛋白质,使蛋白质能在离心后沉淀下来。取上清液后加入2倍体积无水乙醇,RNA会在其中沉淀而残留的蛋白质会溶解在无水乙醇中,再次离心保留沉淀,就能较好的除去蛋白质。横向对比文中的3种方法,在相同的实验条件下。优化的Trizol法,操作更简便、耗时更短,样本处理液始终处于强变性剂中。这些特点降低了RNA在提取过程中被降解的概率,进一步确保了实验结果的有效性。
参考文献:
[1]国家药典委员会.中国药典[M].北京:化学工业出版社,2005:261.
[2]欧阳丽娜,向大位,吴雪,等. 竹节参化学成分及药理活性研究进展[J]. 中草药,2010(06):1023-1027.
[3]孙德权,郭启高,胡玉林,等. 改良Trizol法提取香蕉叶片总RNA[J]. 广东农业科学,2009(05):162-164.
[4]胡薇,白石,祝涛,等. 人参根组织RNA提取方法的研究与优化[J]. 吉林农业大学学报,2010(05):505-508;522.
[5]刘文宝. 一种快速高质量植物总RNA提取方法介绍[J]. 山东蔬菜,2007(02):48.
[6]宗成志,左欣欣,严海燕. 影响RNA提取质量的因素分析[J]. 广西农学报,2011(01):31-34.
[7]李宏. 植物组织RNA提取的难点及对策[J]. 生物技术通报,1999(01):38-41.

