N+注入番茄红素生产菌株的选育及基因转录分析*
裴敏,王强,罗玮,顾秋亚,巩尊洋,余晓斌
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
番茄红素是一种天然的功能性色素,分子式为C40H56,属于直链碳氢化合物,含有11个碳碳共轭双键和2个非共轭双键,这种特定的不饱和分子结构,赋予了番茄红素极强的自由基清除能力[1]。番茄红素作为食品添加剂,动物饲料补充剂,广泛用于药物和化妆品领域,对某些癌症和慢性疾病具有一定的治疗作用[2-4]。目前,番茄红素的合成主要有3种方法,即化学合成法、天然提取法和微生物合成法。化学合成的番茄红素由于副产物较多[5],限制了产品质量和使用范围;天然提取法提取率低、成本高、价格也相对较高,限制了其大规模合成;而利用丝状真菌三孢布拉霉合成番茄红素是一种极具工业化潜力的方法,在发酵过程中添加番茄红素环化酶抑制剂即可得到产物番茄红素。Blakeslea trispora隶属毛霉目笄霉科,有正负菌之分,负菌是番茄红素主要生产菌,正菌作为配对菌与负菌混合发酵可产生性激素三孢酸,显著促进番茄红素的合成。其合成的番茄红素为全反式结构,生产周期短、成本较低、生产过程易于控制且产物易于提取,具有巨大的市场前景。国外采用三孢布拉霉菌发酵生产番茄红素产量已达到3.4 g/L[6],而国内的番茄红素产量基本在1.5 g/L左右,与国外仍有较大差距,限制了其大规模工业化生产。
近年来产番茄红素基因工程菌研究相对较多,但其最大缺点是外源载体不稳定、易丢失;番茄红素产量仍然较低。相对于基因工程育种,传统微生物菌株选育操作简单,更适用于丝状真菌的选育过程。
离子束注入诱变技术是最近20年发展起来的一种生物诱变技术,被广泛应用于转基因工程和生物品种改良。研究者普遍认为,低能离子与生物物质之间相互作用有能量、动量、质量和电荷等方面的效应,可引起靶分子(或原子)的电离和激发;此外,等离子束注入诱变有物理、化学等诱变方法的特点,而且生理损伤小、突变率高、突变谱广,并有一定的重复性和方向性[7-8]。三孢布拉霉菌的菌丝体和孢子均为多核体,厚壁多核的特性增加了诱变的困难,需经多次诱变或复合诱变才能取得较好的效果。低能离子束可诱变微生物产生比较高的特异生化突变率,本文选用N+束对B.trispora进行诱变选育。
1 材料和方法
1.1 菌株和种子培养基
试验所用的菌株是三孢布拉霉菌(B.trispora)NRRL 2895正菌和NRRL2896负菌。正负菌孢子接种在5°麦汁平板上,于25℃恒温箱中培养4 d,待孢子长满整个平板后,在每个平板中加入10 mL已灭菌的蒸馏水冲洗孢子,收集孢子悬液并使用灭菌的玻璃珠的锥形瓶中将孢子充分打散,并调整孢子浓度。正、负菌孢子浓度分别为5.0×105个/mL和1.0×106个/mL,以10%的接种量接种到含有50 mL种子培养基的250 mL锥形瓶中,在25℃、180 r/min条件下培养48 h。种子培养基含有30 g/L玉米粉,50 g/L大豆粉,1.5 g/L KH2PO4,0.5 g/L MgSO4·7H2O 和0.002 g/L VB1,pH为6.5,然后121℃高压蒸汽灭菌20 min。
1.2 发酵培养基
待种子液黏稠后以10%(v/v)的接种量接种到含有25 mL发酵培养基的250 mL锥形瓶中,正负菌的接种比例为1∶5(v/v)。发酵培养基含有50 g/L玉米粉,25 g/L大豆粉,40 g/L棉籽油,1.5 g/L KH2PO4,0.5 g/L MgSO4·7H2O 和 0.002 g/L VB1,pH调为6.5,然后121℃高压蒸汽灭菌20 min。在25℃、180 r/min下培养,摇瓶发酵48 h时向锥形瓶中加入0.3 g/L的环化酶抑制剂2-甲基咪唑[9],120 h后结束发酵,然后离心发酵物收集菌体并测定菌体干重和番茄红素含量。
1.3 筛选平板的准备
在5°的麦汁中加入0.005 g/L的洛伐他汀,20 g/L的琼脂粉和0.5 g/L的乳化剂OP-10,121℃高压蒸汽灭菌20 min。制备好的平板应避光冷藏待用。
1.4 番茄红素高产菌的诱变选育
1.4.1 N+注入诱变
取0.1 mL的负菌孢子悬浮液均匀涂布在无菌培养皿上,并以无菌风吹至干燥。注入能量为10 keV,注入量分别为0(对照)、3.0 ×1015、6.0 ×1015、9.0 ×1015、1.2 × 1016、1.5 × 1016、1.8 × 1016个/cm2。离子注入室真空度为10-2Pa,电流为400 μA,每次以5 s脉冲式注入,间隔30 s。离子注入结束后,取出培养皿,用0.5 mL的无菌生理盐水洗下孢子,并均匀涂布于筛选培养基上,置于25℃培养箱中培养3~5 d以长出单菌落。
1.4.2 存活率和突变率的计算
存活率的计算公式为:存活率/%=(C1/C0)×100,C1指处理组在筛选平板上长出的菌落数;C0指对照组在筛选平板长出上的菌落数。正突变率/%=(M1/M0)×100。负突变率/%=(M2/M0)×100,M1指筛选平板上长出的呈红色和深黄的单菌落数;M2指筛选平板上长出的呈白色和浅黄的单菌落数;M0指生长在筛选平板上所有的单菌落数。
1.4.3 高产番茄红素三孢布拉霉菌的筛选
从筛选平板上挑出菌丝呈红色或者比原始菌株菌丝更黄的单菌落,在不含发酵液的麦汁平板上传代4~5次以挑选出性状稳定的菌株。分别将这些菌株接种到筛选平板的一侧,在另一侧接种正菌菌株,培养3 d后观察正负菌接合区域的颜色,根据接合区域的颜色深浅确定番茄红素的产量的高低,然后挑选接合带颜色深的负菌进行传代。挑选出的负菌与正菌需进行摇瓶发酵以进一步确定番茄红素的产量。
1.5 番茄红素的提取和分析
发酵结束后收集发酵液离心,将得到的菌丝置于40℃的真空干燥箱干燥24 h,取出置于研钵中,加入适量石油醚研磨,多次抽提直至菌丝无色。取适量提取液稀释,在502 nm测定此稀释液的吸光度[10],对比番茄红素标准曲线计算番茄红素含量。
1.6 总RNA的提取和电泳分析
取0.1 mL负菌孢子液接种到种子培养基,培养48 h,离心种子液,取适量菌丝体于研钵(-20℃预冷)中,倒入适量液氮,迅速研磨成粉状。之后按照柱式真菌总RNA抽提纯化试剂盒(上海生工)说明书进行RNA的提取。提取结束后,凝胶电泳分析所提取的RNA的质量,电泳后应出现明显的3条带,依次是28 s、18 s、5 s条带。若5 s带不发生降解,且18 s条带的亮度是5 s条带亮度的2倍左右,无拖尾现象,即可用于后续试验。
将出发菌株和高产番茄红素突变株分别与正菌共培养发酵48 h后提取总RNA,并电泳分析所提取RNA的质量。
1.7 反转录和荧光定量PCR
反转录在Techne TC-5000 PCR仪器上进行,试剂盒为AMV第一链cDNA合成试剂盒。反应体系与反应程序按试剂盒说明书设定。反应结束后,-20℃保存或进行RT-PCR反应。
RT-PCR所用的试剂盒是SGExcel Fast SYBR Miture,所用仪器为 Bio-Rad实时荧光定量定量 PCR仪。RT-PCR 反应体系:cDNA(0.1 μL),引物(10 μm,0.5 μL),RNase free ddH2O(10.5 μL),12.5 μL的SGExcel FastSYBR Miture(含有Fast Taq DNA聚合酶、PCR Buffer、dNTPs、SYBR GreenⅠ荧光染料和Mg2+),最终体积为25 μL。反应程序:预变性95℃,20 s;变性95℃,30 s;退火60℃,30 s;35~40个循环。溶解曲线分析:95℃,15 s;60℃,1 min;95℃,15 s;60℃,15 s。每个样品设3个重复以确保数据的可信度。反应结束后,为了确定产物只有目标片段,分析溶解曲线并将反应液电泳鉴定结果。实验中采用的内参照基因为延伸因子tef1[11],定量PCR结果采用 2-ΔΔCt分析[12],在定量 PCR 中所用基因hmgR、carB、carRA和tef1的引物见表1。

表1 本试验所用引物Table 1 Oligonucleotide primers used in this paper
2 结果与讨论
2.1 存活率曲线和诱变剂量的选择
如图1所示,不同剂量的N+束对入对B.trispora(-)菌的存活率和突变率影响明显。离子注入剂量从0上升到6.0×1015个/cm2时B.trispora菌存活率急剧下降,而在注入剂量从9.0×1015个/cm2增加到1.2×1016个/cm2时存活率却有小幅度上升,且在剂量为1.2×1016个/cm2达到最大,随着注入剂量再增加存活率又下降,呈现出离子束注入诱变特有的“马鞍型”曲线,而一般电离辐射造成的剂量-效应曲线为“指数型”[13]。离子注入生物体是集多种效应于一体的联合作用过程,其对生物体的作用可产生更广泛的生物学效应。马鞍型存活曲线体现了等离子束注入细胞后经物理、化学和生物等一系列作用过程后产生的生物学效应[14]。在进行诱变育种时,增加正突变率相对容易获得高产菌株。由图1可知,注入剂量为0~6.0×1015个/cm2时正负突变率均较低;剂量为9.0 ×1015个/cm2到1.2 ×1016个/cm2时,可获得较高的正突变率,随着诱变剂量的加大,正突变率也逐渐下降。
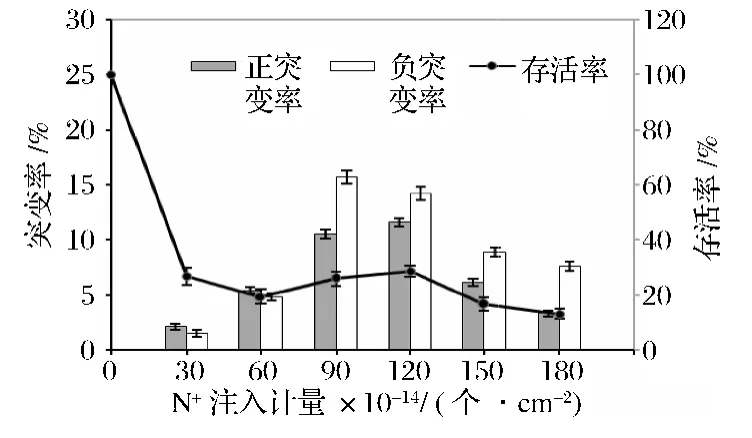
图1 N+注入剂量对B.trispora(-)存活率和诱变率的影响Fig.1 Effect of N+ implantation dose on the survival rate and mutation rate of B.trispora(-)
2.2 高产番茄红素突变株的筛选
N+束注入后诱变后的孢子液涂布在筛选平板上,3天左右长出单菌落,挑选菌丝呈红色或深黄色的菌落传代培养。浅黄色突变株产较少类胡萝卜素,有可能是类胡萝卜素合成前期由于基因突变某些酶活性较低;红色菌落则是由于番茄红素环化酶缺失或活性较弱,积累较多的番茄红素;深黄色菌落含有较多的类胡萝卜素或者其合成前体。挑选出来的菌株与正菌在麦汁平板上进行接合试验,接合区域的颜色呈明亮的黄色到深红色,差异较明显。挑选深黄色菌落或红色菌落在平板上传代5~6次以确定其遗传性状稳定性。最终选育出8株突变菌,命名为2a、2b、3d、4c、5a、7c、7f和 8d。

图2 出发菌株和部分突变株与正菌的配对接合试验Fig.2 The mating test of parent strain and partial mutants with the(+)strain respectively
2.3 高产番茄红素突变株的产量
挑选出的高产番茄红素负菌株和出发菌株分别与正菌共培养确定菌株产番茄红素的能力。本文选择了8株负菌进行试验,最终的番茄红素产量和菌体干重如图3所示,每个试验重复3次。结果表明,N+注入对三孢布拉霉负菌正诱变效应明显。诱变后,菌株4c发酵96 h的最高产量为25.97 mg/g,干重为56.8 g/L,与出发菌株相比产量提高了39%。试验中发现虽然在麦汁平板上正负菌结合试验时接合区域的菌丝颜色较深,但进行共培养发酵时番茄红素的产量并没有达到预期值,同时发现发酵液的颜色并不是先前的米色或淡黄色,而是呈浅红色或深红色,这说明菌体发生了自溶,可能是该菌株不适合液体发酵条件或培养基成分。
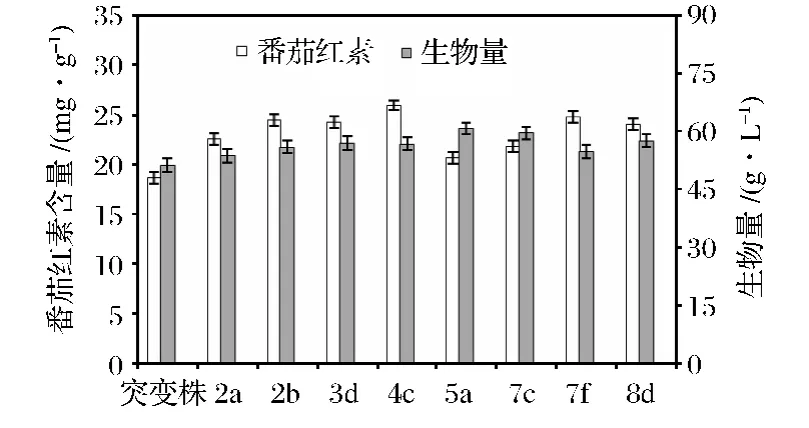
图3 B.trispora(-)突变株的番茄红素产量和生物量Fig.3 Lycopene content and biomass of B.trispora mutants obtained by N+ implatation
2.4 高产番茄红素的遗传稳定性分析
为考察突变株高产特性的稳定性,将突变株4c传代5次并进行摇瓶发酵试验,如表2所示,突变株4c具有稳定的高产番茄红素的能力。
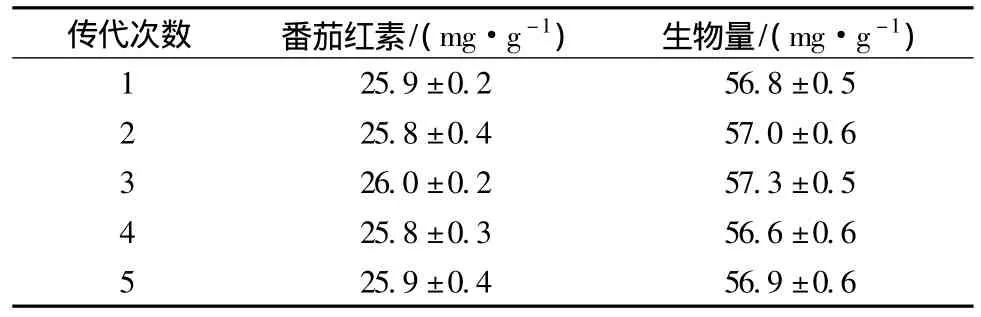
表2 4c菌株的遗传稳定性Table 2 Lycopene concentration stability of the mutant 4c during generations
2.5 番茄红素合成关键酶基因转录水平分析
3-羟基-3-甲基戊二酸单酰CoA(HMG-CoA)还原酶(hmgR编码),八氢番茄红素脱氢酶(carB编码),番茄红素环化酶/八氢番茄红素合成酶(carRA编码)是B.trispora番茄红素合成途径中的关键酶[15]。HMG-CoA还原酶催化HMG-CoA不可逆生成类异戊二烯合成的前体甲羟戊酸,这是类异戊二烯合成的限速步骤。增强hmgR的表达可提高细胞内HMG-CoA还原酶的含量,进而提高番茄红素的产量。carB和carRA是类胡萝卜素合成途径中所特有的,并控制着类胡萝卜素合成途径[15],因此本文分析了番茄红素合成过程中这3个关键酶基因的转录水平。
诱变后番茄红素的产量有明显提高,其原因在于类胡萝卜素合成过程中前体或中间代谢物合成水平的增加。如图4所示,诱变后高产B.trispora(-)菌株的番茄红素合成关键基因的表达量有了明显提高,与出发菌株相比较,hmgR、carB和carRA的表达量分别提高了2.2倍、2.35倍和2.16倍。为进一步验证番茄红素产量的提高与合成番茄红素关键基因的表达水平提高有关,在正负菌共培养发酵48 h时,对3个关键基因的表达水平进行分析,与出发菌株相比,hmgR、carB和carRA的表达量分别提高了2.0倍、1.52倍和1.35倍。hmgR的转录水平略有所下降,有可能是因为发酵培养基的培养基成分并没有种子培养基的营养成分高。Tang Qiong等[16]在正负菌共培养30 h时加入30 mg/L的酮康唑处理24 h,hmgR和carRA的表达量分别提高了3.5倍和3倍,β-胡萝卜素产量达到0.41 mg/g,提高了140%;而André D.Schmidt等[17]研究发现,正负菌共同培养48 h时carB和carRA的表达量分别提高了148倍和128倍,这是因为正负菌混合培养时产生性激素三孢酸,强烈诱导类胡萝卜素合成酶基因的表达,也说明了类胡萝卜素的合成主要受到性激素的影响;在高产菌株和出发菌株分别与正菌共同培养时,hmgR、carB和carRA的表达量差异则不是特别显著。
研究发现,N+注入后菌体内发生了复杂的生物学效应,可认为离子束注入后产生的一系列物理化学等原初反应既可能会对保护酶(CAT、SOD)合成从转录到翻译等不同水平上进行调控,也可能会作用于它们的固有酶结构和活性中心的空间构象,从而导致酶活改变。N+注入后高产负菌突变株以及负菌株与正菌共培养48 h后番茄红素合成关键基因hmgR、carB和carRA表达水平不同程度地提高,因此,N+束注入后产生大量的自由基以及应激产生大量的保护酶,可能在细胞内产生一系列物质进入细胞核作用于hmgR、carB和carRA基因,基因结构或者基因的表达调节发生某种可稳定遗传的变化,提高了 hmgR、carB和carRA基因的转录水平,由此实现番茄红素的积累。
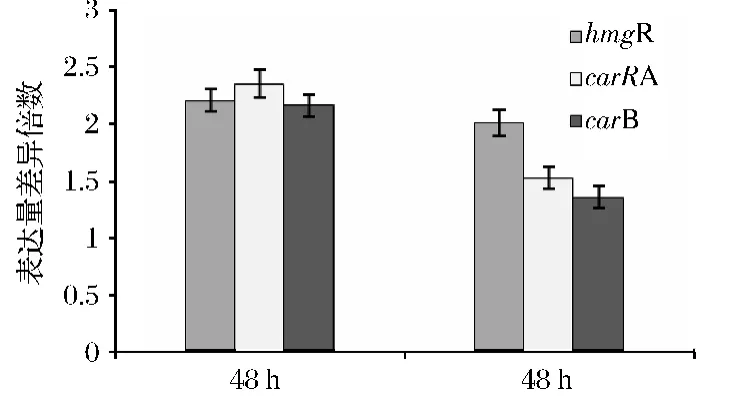
图4 诱变后4c菌株单独培养48 h和与正菌共培养48 h基因hmgR、carB和carRA的表达量Fig.4 Relative quantification by real-time PCR of hmgR,carB and carRA gene transcripts in 4c strain cultured for 48 h period in breeding cultures and cultured with B.trispora(+)strain for 48 h period in submerged cultures respectively
3 结论
本实验采用新型离子束诱变技术,经过诱变筛选、平板筛选和发酵实验获得了高产番茄红素菌株。hmgR、carB和carRA是三孢布拉霉菌合成番茄红素的关键基因,本文研究了N+束注入后高产菌株与出发菌株关键基因表达水平的变化,诱变后关键酶基因的转录水平均有所提高,初步探究了离子束诱变后的高产机制。目前用于食品和医药行业的番茄红素产品仍依赖天然提取,因此市场上番茄红素价格相对偏高。ZHU等[18]构建筛选出1株高产番茄红素大肠杆菌,在2.5 L发酵罐中产量达到1.44 g/L;在真核宿主中番茄红素最高产量达到16 mg/g[19],但工程菌在从实验室试验到工业化生产过程中仍有诸多问题待解决。三孢布拉霉菌是目前唯一应用于工业生产天然番茄红素的真菌,在发酵过程中添加Fe3+[20],液体石蜡[21]等引起氧化应激,实现番茄红素的积累;但也存在着高产株难以筛选、产量低、菌种易退化、番茄红素环化酶抑制剂的添加与残留等问题,在建立新型高产株筛选策略、寻找低毒无害环化酶抑制剂等方面需要大量的研究,这将对推进番茄红素在工业化生产中的发展有重要意义。
[1] Mascio P D,Kaiser S,Sies H.Lycopene as the most efficient biological carotenoid singlet oxygen quencher[J].Archives of Biochemistry and Biophysics,1989,274(2):532-538.
[2] Franceschi S,Bidoli E,Vecchia C,et al.Tomatoes and risk of digestive tract cancers[J].International Journal of Cancer,1994,59(2):181-184.
[3] Giovannucci E,Ascherio A,Rinlm E B,et al.Intake of carotenoids and retinol in relation to risk of prostate cancer[J].J Natl Cancer Inst,1995,87(23):1 767-1 776.
[4] Riso P,Brusamolino A,Porrini M.Functional Foods and Nutraceuticals in Cancer Prevention[M].Iowa:Iowa State Press,2003:1-33.
[5] 柳巧宁,朱丽雯,王义华,等.发酵法生产番茄红素的研究进展[J].食品与发酵工业,2009,35(6):157-161.
[6] Marcos Rodriguez,Estrella De Castro,Costa Perez,et al.Method of producing lycopene through the fermentation of selected strains of Blackeslea trispora,formulations and uses of the lycopene thus obtained:Spain,EP1471151A1[P].2004-10-27.
[7] 邵春林,许安,余增亮.离子注入生物分子的电荷交换效应[J].核技术,1997:70-73.
[8] HUANG W D,YU Z L,ZHUANG Y H.Repair by radiation itself or not?A study of threonine irradiated by keV ion[J].Nuclear Instruments and Methods in Physics Research Section B,1998,134(2):202-208.
[9] Kiriaki P,Fani M,Maria Z T.Lycopene production using Blakeslea trispora in the presence of 2-methyl imidazole:yield,selectivity,and safety aspects[J].J Agric Food Chem,2008,56(12):4 482-4 490.
[10] 张连富,丁霄霖.番茄红素简便测定方法的建立[J].食品与发酵工业,2001,27(3):51-55.
[11] Slobin L I.The role of eucaryotic factor Tu in protein synthesis.The measurement of the elongation factor Tu content of rabbit reticulocytes and other mammalian cells by a sensitive radioimmunoassay[J].European Journal of Biochemistry,1980,110(2):555-563.
[12] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtMethod[J].Methods,2001,25(4):402-408.
[13] 宋道军,姚建铭,邵春林,等.离子注入微生物产生"马鞍型"存活曲线的可能作用机制[J].核技术,1999,22(3):129-132.
[14] WANG X H,LI G,LU J,et al.Changes of M_1 generation of coloured cotton by N+ion implantation [J].Acta Laser Biology Sinica,2004,13(4):294-297.
[15] Rodríguez-Sáiz M,Paz B,de la Fuente J L,et al.Blakeslea trispora genes for carotene biosynthesis[J].Applied and Environmental Microbiology,2004,70(9):5 589-5 594.
[16] TANG Q,LI Y,YUAN Q P.Effects of an ergosterol synthesis inhibitor on gene transcription of terpenoid biosynthesis in Blakeslea trispora[J].Curr Microbiol,2008,57(6):527-531.
[17] André D S,Thorsten H,Markus M,et al.Analysis of mating-dependent transcription of Blakeslea trispora carotenoid biosynthesis genes carB and carRA by quantitative real-time PCR[J].Appl Microbiol Biotechnol,2005,67(4):549–555.
[18] ZHU F,LU L,FU Sh,et al.Targeted engineering and scale up of lycopene overproduction in Escherichia coli[J].Process Biochemistry,2015,50(3):341-346.
[19] Matthäus F,Ketelhot M,Gatter M,et al.Production of lycopene in the non-carotenoid-producing yeast Yarrowia lipolytica[J].Applied and Environmental Microbiology,2014,80(5):1 660-1 669.
[20] Nanou K,Roukas T.Oxidative stress response of Blakeslea trispora induced by iron ions during carotene production in shake flask culture[J].Appl Biochem Biotechnol,2013,169(8):2 281-2 289.
[21] HU X M,MA X J,TANG P W,et al.Improved β-carotene production by oxidative stress in Blakeslea trispora induced by liquid paraffin[J].Biotechnol Lett,2013,35(4):559-563.

