浙江1株水稻细菌性条斑病菌株的分离鉴定
路 梅, 凌丹燕, 张发成 , 辛德东
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.金华市植保站,浙江 金华 321017)
浙江1株水稻细菌性条斑病菌株的分离鉴定
路 梅1, 凌丹燕1, 张发成2, 辛德东1
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.金华市植保站,浙江 金华 321017)
细菌性条斑病(简称细条病)是水稻的重要病害之一,随着气候的变暖,某些水稻品种有逐年发生加重的趋势,对产量影响较大。2013年浙江省金华市部分水稻种植区域发生细条病,发病严重的田块减产30% 以上。采用组织分离法从发病水稻叶片分离获得6株细菌菌株,选择典型菌株JH01回接水稻幼苗,进行柯赫法则验证。接种后发病症状与自然发病症状一致,并重新分离得到此菌株,证明菌株JH01为水稻细条病的致病菌。通过形态学观察、常规生理生化指标测定、16S rDNA 序列测定和同源性分析,鉴定菌株JH01为稻黄单胞菌水稻致病变种(Xanthomonasoryzaepv.oryzicola,Xoc)。
水稻;细条病;分离;鉴定;稻黄单胞菌
稻黄单胞菌水稻致病变种(Xanthomonasoryzaepv.oryzicola,Xoc)引起的水稻细菌性条斑病(bacterial leaf streak,BLS;简称细条病或条斑病)是水稻的重要细菌病害,是全国农业植物检疫性对象之一。1918年最早在菲律宾发现该病,目前在东南亚各国和亚洲中部稻区都有发生。1955年我国广东省首次发现该病,而后随着作物引种试种、南繁加代以及材料交换逐步传播蔓延,20世纪80、90年代成为我国南方稻区的主要病害之一[1-2]。该病害传播途径多,可由水稻叶片上的气孔或伤口侵入,侵染频繁,条件适宜时极易流行,一旦发病很难控制。2013年8月下旬,浙江省金华市部分稻区的单季晚稻品种正处在齐穗期,突然发生水稻细菌性条斑病。本次病害的显著特点就是发生突然,扩展迅速,严重田块减产30 %以上。金华市地处浙江中部,为浙中丘陵盆地地区,属亚热带季风气候。2013年7月至8月上旬,金华地区高温干旱,8月下旬受台风影响,气候呈高温、高湿特点。这与高温、高湿有利于水稻细条病害发生的规律相符。准确的病原菌鉴定是病害诊断的关键。本研究对从发病田块采集到的病样进行了病原菌的分离和致病性测定,并根据细菌形态学、生理生化特性、16S rDNA 及同源性分析等对病原菌进行鉴定,以期为该病害的防治工作提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试植物材料 水稻病样采自浙江省金华市水稻产区;致病性检测用水稻品种为“浙优 86”,过敏性坏死反应用烟草品种为“本氏烟(Nicotianabenthamiana)”。
1.1.2 培养基 供试培养基为NA培养基、PDA培养基、BPA培养基[3]。
1.2 方法
1.2.1 病原菌株的分离纯化 将经过1%次氯酸钠表面消毒处理的水稻病叶组织,剪成1~2 cm大小,放入无菌研砵中,加入1~2 mL无菌水,轻轻碾碎,使叶片组织中的细菌充分流出。研磨后静置15 min,用无菌水将研磨液稀释103倍,在含有25 μg/mL rif抗生素的NA培养基平板上划线培养。3 d后,观察平板菌落生长情况。将单菌落接种纯化培养。
1.2.2 病原菌致病性检测 选取处于5~6叶幼苗期的水稻植株用于试验,试验前一天将水稻移至28 ℃培养室中适应环境。供试菌株接种于NA 培养基上培养48 h 后,转接至含25 μg/mL rif的NB 培养基中,28 ℃,200 r/min摇床培养过夜。次日,用NB 培养基将菌液稀释至约3×108cfu/mL (OD600≈0.6),选择水稻第3、4 片叶,用改良的针刺接种法接种[4]。以NB 培养基为空白对照,重复3组,每组6~8片叶。接种后,保湿、保温28 ℃,弱光照24 h。然后转为正常光照,3 d 后观察水渍症状的形成,同时取注射区域的水稻叶片研碎,通过梯度稀释涂布在含有相应抗生素的NA 平板上,进行病原菌的再分离鉴定。以3×108cfu/mL浓度的菌液注射非寄主烟草本氏烟,进行烟草过敏性坏死反应实验。置于室温,24 h 内观察是否产生过敏性反应。每次注射3 片叶子,重复3 次。
1.2.3 菌株鉴定 ①形态学鉴定[3]: 将分离菌株接种在NA 平板上,于12、24、48 h 分别进行鞭毛染色、革兰染色、荚膜染色、细胞壁染色、芽胞染色、抗酸染色,观察菌体的形态和菌落特征;②生理生化特征检测:葡萄糖产气试验、糖醇发酵试验、明胶液化试验、淀粉水解试验、V-P 测定试验、硝酸盐还原试验、脲酶试验、H2S产生试验、M.R.试验(甲基红)、纤维素分解、乳糖、麦芽糖利用,分别参照文献[5-6]的方法进行。
1.2.4 16S rDNA 基因组序列检测及其系统进化树的构建 ①病原菌总DNA提取:单菌落过夜培养(28 ℃,180 r/min),取1.5 mL菌液12 000 r/min离心3 min,去上清,保留沉淀;加200 μL裂解液 (40 mmol/L Tris-acetate pH 7.8,20 mmol/L sodium-acetate,1 mmol/L EDTA,1% SDS),移液器吸吐混匀,悬浮裂解细菌细胞;加60 μL的5 mol/L NaCl混匀,4 ℃下12 000 r/min 离心 10 min;取上清到新的EP管中,加入等体积的氯仿,充分混匀后12 000 r/min离心3 min;转移上清至新的离心管,加预冷2倍体积的无水乙醇沉淀,12 000 r/min离心 10 min,用400 μL 70%乙醇漂洗2次,室温干燥;溶入50 μL TE缓冲液,-20 ℃保存[3]。②分离菌株基因组16S rDNA序列的特异PCR扩增:PCR扩增采用细菌通用引物AW39056 (5′-AGTCGTAACAAGGTAGCCGT-3′)和AW39057 (5′-GTGCCAAGGCATCCACC-3′),反应体系为25 μL,以双蒸水为模板做阴性对照。反应液包括10×PCR buffer 2.5 μL,2.5 mmol/L dNTP 1.0 μL,5 u/μLTaqDNA聚合酶0.5 μL,上游引物与下游引物均为10 μmol/L,各取1.0 μL,DNA模版2.0 μL,ddH2O 17 μL;PCR反应程序:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,36个循环,72 ℃终延伸7 min,4 ℃保温。扩增产物用1%琼脂糖凝胶电泳,用凝胶成像仪紫外观察并拍照。PCR产物送上海英潍捷基有限公司测序。测序结果在GenBank数据库 (http://www.ncbi.nlm.nih.gov) 中进行Blast比对分析,并从GenBank中下载15个菌株16S rRNA 基因,用MEGA4 (Molecular Evolutionary Genetics Analysis Version 4) 软件的Kimura-2-Parameter 模型,采用邻接法(NJ) 构建系统发育树(Replications=1 000,Bootstrap值取百分比) 。 ③水稻细菌性条斑病菌专化性PCR检测[7]:以XoocF(5′-ATATTGGGCTGGTGGGTGATC-3′)和XoocR(5′-TTGGTACGCGATGCCCTTTGCGACGG-3′)为引物,以菌株JH01的基因组DNA为模板,进行病原菌专化性扩增。引物退火设置为62 ℃ 1 min,扩增体系和反应程序其他设置同上述16S~23S 扩增。
2 结果与分析
2.1 病原菌的分离及其致病性检测
从水稻染病叶片(图1)病斑处分离获得6株菌株,选取其中1株典型菌株JH01接种健康的水稻幼苗叶片,3 d后开始出现水稻细菌性条斑病病斑的典型症状。病斑出现在叶脉两侧并顺着叶脉扩张,初为暗绿色水浸状小斑,然后很快在叶脉间扩展为暗绿至黄褐色的细条斑,见图2。

图1 病害大田图片Fig.1 Picture of disease in field

图2 典型叶片病害症状Fig.2 Typical disease symptoms
从染病植株叶片上重新分离得到的病原物与所接种菌株培养的细菌性状相同,依照柯赫氏法则说明分离得到的疑似病原菌JH01是引起水稻细菌性条斑病的致病细菌。将菌株JH01接种本氏烟20 h后,即出现肉眼可见的水浸状斑;3 d后,形成坏死斑,见图3。

图3 JH01接种本氏烟20 h
分离菌株在NA培养基上的菌落形态特征:菌落淡黄色,圆形,光滑,全缘,凸起,黏性,水浸状,见图4。染色发现,该菌革兰染色反应呈阴性,菌体杆状,单胞,偶成对,但不成链,单根极生鞭毛,可运动,无孢子,无荚膜,染色结果见图5、表1。

图4 菌株JH01在NA培养基上的培养性状Fig.4 Characters of strain JH01 cultured in NA culture
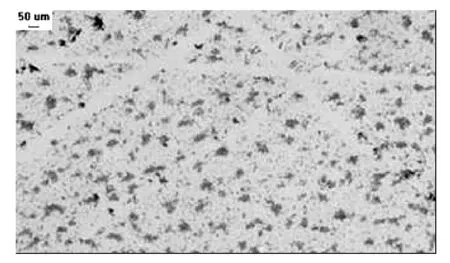
图5 菌株JH01革兰染色结果Fig.5 Negative result of stain JH01 gram staining
2.2 生理生化特征
菌株JH01的生理生化特征表明分离菌株符合黄单胞菌属稻黄单胞菌稻生致病型的基本特征,见表1,在甲基红试验和VP试验中均呈阴性;葡萄糖、蔗糖和甘露糖发酵产生酸,乳糖、麦芽糖不产生酸;产生H2S 和3-羟基丁酮,不产生吲哚;液化明胶,固体培养基上不水解淀粉,但在培养液中能水解淀粉;能在4 ℃低温生长,最适生长温度为28 ℃;营养肉汤中,中度混浊,后期有沉淀,表面环状生长,但不形成显著的菌苔;在含有5% NaCl的肉汁胨中不生长,对青霉素不敏感。

表1 菌株JH01生理生化特征
注:“+”表示有,“-”表示无
2.3 系统发育树的构建及同源性分析
以JH01基因组总DNA 为模板,用细菌的通用引物AW39056和AW39057进行PCR 扩增,得到约0.5 kb 的特异条带产物(图6:3~5泳道);以水稻细条病原特异引物XoocF和XoocR扩增,得到约0.3 kb的特异条带产物(图6:1~2泳道)。PCR 产物回收纯化后,经DNA 测序,序列长度分别为527 bp和369 bp;将菌株JH01 的16S rDNA 序列向GenBank 进行提交,其序列登记号为KF977194。

图6 菌株JH01 PCR电泳结果Fig.6 The 16S rDNA PCR of strain Xoc JH011~2:样品(引物XoocF和XoocR扩增);3~5:样品(引物Aw39056和Aw39057扩增);6~7:阴性对照;M:分子量标记1~2: Samples (amplified with primer XoocF and XoocR); 3~5: Samples (amplified with primer AW39056 and AW39057); 6~7: Negative control; M: Marker
将JH01 菌株的16S rDNA 序列与GenBank 中的序列进行比较,与其同源性最高的菌为黄色单胞菌属。以16S rDNA 同源性为基础构建包括15株相关种属细菌(分别属于Xanthomonas、Stenotrophomonas和Rhizobium属)在内的系统发育树(图7)。系统发育树中,分离菌株JH01(KF977194)与X.oryzaepv.oryzicolaBLS25(CP003057)和X.oryzaepv.oryzicolastrain GX01(JF938915)在同一分支,序列相似性最大,均为99%。而与StenotrophomonasmaltophiliaR551-3(CP001111)和Rhizobiumsp. Hc200(JQ081301)亲缘关系相对较远,均为85%。
根据菌株的形态特征、生理生化特征、16S rDNA序列同源性及系统发育树分析结果,确定分离纯化的菌株JH01属于细菌域 (Bacteria) 中的变形菌门(Proteobacteria)、变形菌纲(Gammaproteobacteria)、黄色单胞菌目(Xanthomonadales)、黄色单胞菌科(Xanthomonadaceae)、黄色单胞菌属(Xanthomonas)中的稻黄单胞菌稻生致病型(X.oryzaepv.oryzicola)菌。

图7 根据16S rDNA基因序列构建系统发育进化树Fig.7 The Phylogenetic tree based on 16S rDNA gene sequences
3 讨 论
水稻细菌性条斑病对水稻生产危害很大,可造成高达30 %的产量损失,已经成为我国南方稻区的主要病害[8]。本研究从浙江省金华市的发病水稻上分离鉴定了1株水稻细菌性条斑病菌,命名为XocJH01。金华市位于浙江的中部,该地区自古以来就是浙江稻米主要产区之一,也是农产品流通、种子交流的中心;该地区地处盆地,具典型的亚热带气候,夏季高温多雨,无论地理环境还是气候条件都适合水稻细条病的发生。
水稻细菌性条斑病病原菌的发现及确认过程较为漫长,曾一度与水稻白叶枯病病原相混淆。直到1990年,Swing等[9]根据水稻条斑病病原菌的表型、基因型、化学分类资料认为,引起水稻白叶枯病和细菌性条斑病的病原分别为黄单胞杆菌白叶枯致病型(X.oryzaepv.oryzae,Xoo)和细菌性条斑病致病型 (X.oryzaepv.oryzacola,Xoc)两个变种。本研究在传统形态学基础上,采用16S~23S rDNA ITS 序列分析方法对病原分离物进行了快速鉴定。与在GenBank 数据库中进行序列对比发现,分离菌株XocJH01不仅与XocBLS256和XocGX01[4]菌株16S~23S rDNA ITS 序列相似性达99%,与XooPXO99A和XooMAFF311018的序列相似性也达到99%。进而结合分离菌株的表型鉴定和致病性检测,最终确定该菌株为黄单胞菌科黄单胞菌属的稻黄单胞菌致病型变种Xoc。
水稻细条病病菌主要从气孔或伤口侵入,借风、雨、露等传播,在无病区主要通过带菌种子传入。在中国南方,病害发生的原因有以下几个方面:①种子带病;②台风造成的水稻伤口;③高温高湿;④水稻品种与病菌菌株的互作模式中,菌株的致病性变强,亦或水稻的抗病性减弱或感病性加强。其中,②和③方面是天气因素,利于病害的传播。据金华市气象台发布的信息,2013年7月,金华市平均气温较常年高2.5 ℃,雨量较常年少87%; 8月上旬旬平均气温比常年明显偏高,旬雨量比常年少90%多,而8月中下旬受台风“潭美”和“康妮”的影响,旬平均气温比常年高1.5 ℃,旬雨量比常年多近50%;9月份月平均气温比常年高约1 ℃,雨量比常年少50%。因此,推测病害的发生在7月至8月中上旬因为高温干旱得以控制;8月下旬,因为季节性台风带来大量的雨水和叶片伤口,同时水稻处于齐穗期,抵抗力减弱,导致病害快速发展;9月份的干旱天气又抑制了病害的继续加重。至于病菌的初来源,有待进一步的追踪调查研究。
为了研究病害发生的根本原因,在进行病原分离鉴定的基础上,应进行病原菌的致病性与不同栽培水稻品种的抗病性等后续研究。XocJH01菌株作为浙中稻区的水稻细菌性条斑病菌的代表,为研究区域性水稻细条病发病规律、成灾机理、病原菌进化机理与分布规律提供材料。
[1] 方中达, 任欣正, 陈泰英,等. 水稻白叶枯病及条斑病和李氏禾条斑病病原细菌的比较研究[J]. 植物病理学报, 1957, 3(2): 99-124.
[2] Chen G Y, Wang J S. Exchangeability of TwohrpGene Fragments fromXanthomonasoryzaepv.oryzaeand pv.oryzicolafor ypersensitive Response on obacco and athogenicity on Rice [J]. Agricultural Sciences in China, 2003, (9): 975-981.
[3] 方中达. 植病研究法[M]. 北京: 中国农业出版社, 1998.
[4] 肖永胜, 韦雪雪, 郜惠苹,等. 一株水稻细菌性条斑病的鉴定与遗传操作系统的建立[R]. 基因组学与应用生物学, 2011, (30):1211-1217.
[5] Holt J G, Krieg N R, Sneath P H, et al. Bergey’s Manual of Determinative Bacteriology(9th ed)[M].Baltimore: Williams &Wilkins, 1994.
[6] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[7] 张华, 姜英华, 胡白石,等.利用PCR技术专化性检测水稻细菌性条斑病菌[J], 植物病理学报, 2008, 38(1): 1-5.
[8] 黄大辉, 岑贞陆, 刘驰,等. 野生稻细菌性条斑病抗性资源筛选及遗传分析[J], 植物遗传资源学报, 2008, 9(1): 1-14.
[9] Swings J, Van Den Mooter M, Vauterin L, et al. Reclassification of the Causal Agents of Bacterial Blight (Xanthomonascampestrispv.oryzae) and Bacterial Leaf Streak (Xanthomonascampestrispv.oryzicola) of Rice as Pathovars ofXanthomonasoryzae(ex Ishiyama 1922) sp. nov., nom. rev. [J]. IJSEM, 1990, 40(3): 309-311.
Isolation & Identification of a Bacterial Rice Leaf Streak Strain in Zhejiang Province
LU Mei1, LING Dan-yan1, ZHANG Fa-cheng2, XIN De-dong1
(1.Coll.ofChem. &LifeSci.,ZhejiangNormalUni.,Jinhua321004; 2.JinhuaPlantProtect.Stat’n,Jinhua321017)
Bacterial leaf streak (BLS) is one of the most important diseases of rice, and as the climate warming; it has a worsening tendency to occur year by year that greatly affect the production. In 2013, BLS broke out in some rice planting areas of Jinhua City, Zhejiang Province, and caused decline over 30% of rice yield in some field with serious disease. Adopting the method of plant tissue pathogen isolation from pathogenic leaves, 6 bacterial strains were isolated and purified, the typical strain JH01 was selected to inoculate the rice seedlings to validate Koch’s law. The disease symptoms of inoculation were consistent with the disease occurred in nature, and the same strain was re-isolated from the infected rice leaves. And proved that strain JH01 was the pathogen of rice BLS. The strain JH01 was characterized asXanthomonasoryzaepv.oryzicolaby morphological observation, routine physiological and biochemical indices tests, and 16S rDNA sequences and homology analyses.
rice; bacterial leaf streak (BLS); isolation; identification;Xanthomonasoryzae
浙江省自然科学基金项目(Y3110194)
路梅 女,高级实验师,硕士研究生。主要研究方向为植物病理学。E-mail:lumei@zjnu.cn
2014-01-15;
2014-08-04
Q939.96
A
1005-7021(2015)04-0013-06
10.3969/j.issn.1005-7021.2015.04.003

