共价偶联法在玻片表面固定适配体的研究
武建超,袁 敏,,徐 斐,曹 慧,于劲松,
(1.上海理工大学医疗器械与食品学院,上海200093;2.上海理工大学食品质量与安全研究所,上海200093)
适配体技术是分析检测领域的一项新兴技术,主要原理是核酸适配体能够与靶分子通过氢键、疏水作用、范德华力等分子作用发生特异性的结合,形成诸如发夹、凸环、G-四聚体等特殊三维结构,然后利用相关技术手段实现靶分子的快速、灵敏、特异性检测[1]。该法目前被广泛应用于重金属及DNA、蛋白质等生化物质的快速灵敏检测。Zhou等[2]利用有荧光基团修饰的适配体与Ag+发生特异性的结合,生成C-Ag-C的双链结构,之后通过传感器即可检测Ag+含量。有研究者[3-5]利用含2个T 碱基的适配体与Hg2+形成的稳定结构检测水中Hg2+含量。上述研究均是在将特定适配体固定在载体的基础上实现的。而常见的固定载体包括VT 共聚物、纤维素载体、树脂、金片、水凝胶载体、玻片等。前5种固定载体存在一定弊端,如较低的固定率、复杂的操作过程、材料昂贵且较难获取等。而玻片价格低廉、操作简单、固定效果较好,作为常用载体被广泛应用于核酸检测相关的各项研究[6-8]。
目前,相关研究多采用经过修饰的核酸片段固定到玻片表面或者采用特定基团修饰玻片,应用成本相对较高[9],且对玻片固定适配体的条件优化尚无深入研究。作者以硅烷化玻片为载体,将未经修饰的核酸适配体通过共价偶联法直接固定在玻片上,采用单因素实验考察硅烷化试剂浓度、硅烷化反应温度和时间以及适配体与玻片反应时间和温度、适配体浓度和长度对适配体固定率的影响,优化了适配体的固定条件,成功实现了对水溶液中Hg2+的吸附,达到初步富集和去除Hg2+的功能,为后续富集水中Hg2+的研究开拓了新的研究思路。
1 实验
1.1 材料、试剂与仪器
玻片(18mm×18mm×0.17mm);适配体片段:AP-16:5′-AGTGATTCGTATTACC-3′、AP-20:5′-TTTTTTTTTTTTTTTTTTTT-3′、AP-21:5′-TTCTTTCTTGGGTTGTTTTGTT-3′、AP-22:5′-ATCGAGATAGTAAGTGCAATCT-3′、AP-44:5′-ACTACTCTCATCATACTCTGGGGACTGTGTTTGTTGTGTGTTGT-3′、AP-50:5′-ATCGAGATAGTAAGTGCAATCT-3′、AP-76:5′-ATTTTACAGAAC AACCAACGTCGCTCCGGGTACTTCTTC-3′,生工生物工程上海股份有限公司。
γ-缩水甘油醚氧丙基三甲氧基硅烷(GOPS)、1-甲基咪唑、3-(N-吗啡啉)丙磺酸(MOPS),阿拉丁试剂有限公司;二甲基亚砜、丙酮、无水乙醇、硝酸钠、氯化钠、柠檬酸二钠、氢氧化钠、浓硝酸、浓盐酸、浓硫酸、双氧水,国药集团化学试剂有限公司;以上试剂均为分析纯。MiliQ 超纯水;自制。
TG16-WS型台式高速离心机,金坛恒丰仪器厂;HH 型系列数显恒温水浴锅,金坛科析仪器有限公司;FA2204B型电子天平,上海精科天美科学仪器有限公司;NanoDrop 2000/2000C 型超微量紫外分光光度计,美国赛默飞世尔科技有限公司;普兰德单道可调移液器,德国普兰德公司;调温万用电炉、101A-2S型数显不锈钢电热鼓风干燥箱,上海锦屏仪器仪表有限公司;LHS-150SC型智能恒温恒湿箱,南通利豪实验仪器有限公司;GBC 型原子吸收光谱仪,澳大利亚GBC科学仪器公司。
1.2 缓冲溶液的配制
缓冲溶液:用移液器移取0.1 mL 1-甲基咪唑、1.255mL二甲基亚砜、11.19mL双蒸水于烧杯中,将pH 值调至10.0,备用。
1×SSC 缓冲溶液:分别称取0.876g 氯化钠、0.411g柠檬酸二钠,定容于100 mL 容量瓶,之后转移至广口瓶中,加入盐酸调节pH 值至7.0,备用。
1.3 适配体的固定化
1.3.1 玻片的羟基化
将玻片放入30%双氧水和98%浓硫酸混合溶液(体积比1∶3)中,于电炉上煮至微沸后取下冷却至室温,去除废液并用大量双蒸水冲洗玻片数次,烘干,备用。
1.3.2 玻片的硅烷化
取11.4μL GOPS溶液,加入50mL丙酮溶液中,稀释成1×10-3mol·L-1的混合溶液。然后将羟基化后的玻片浸入该溶液中,室温反应30min后取出。分别用丙酮和无水乙醇冲洗3 次,以除去未结合的GOPS,最后将洗净的玻片烘干。玻片硅烷化的原理如图1所示。
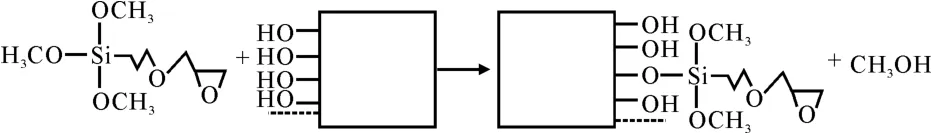
图1 玻片硅烷化的原理Fig.1 The principle of silylation on the glass chips
1.3.3 适配体在玻片上的固定
分别移取18μL缓冲溶液和1μL 1×10-4mol·L-1的适配体溶液于200μL 离心管中混合均匀,制得浓度为5.3×10-6mol·L-1的反应适配体溶液。取9.6μL反应适配体溶液均匀涂抹于玻片表面后,将其放至恒温恒湿培养箱中,45 ℃下反应120min[10-13],剩余溶液用于检测适配体反应液的质量浓度。适配体在玻片表面固定的原理如图2所示。

图2 适配体固定到玻片上的原理Fig.2 The principle of fixing aptamers on the surface of glass chips
1.3.4 适配体固定率的计算
反应过后的玻片用1×SSC 缓冲溶液冲洗4 次,再用MiliQ 超纯水冲洗2次,共得到96μL的洗脱液,收集于200μL离心管中,混匀2min。用移液器移取2μL样品滴于检测仪器上进行检测,每个样品平行检测3次。实验所用洗脱液的体积为反应适配体溶液体积的10倍,通过微量紫外分光光度计对反应适配体溶液和洗脱溶液的浓度进行检测,适配体在玻片上的固定率按式(1)计算:

1.4 适配体对水溶液中Hg2+的吸附
将修饰有适配体的玻片浸没于20mL 0.1mol·L-1的HgCl2溶液(内有1×10-5mol·L-1MOPS,1×10-4mol·L-1NaNO3,pH=11)中,15 ℃下反应3h[10]。取出玻片,用少量双蒸水将玻片表面未结合适配体的游离Hg2+冲洗干净,冲洗废液和浸泡过玻片的溶液合并定容至50mL。用原子吸收光谱仪通过冷原子吸收光谱法检测废液中Hg2+的浓度,从而得到玻片上适配体所吸附的汞量,适配体吸附Hg2+的吸附效率按式(2)计算:

式中:c0为浸泡过空白玻片的HgCl2溶液定容至50mL时的Hg2+浓度;c1为与玻片上固定的适配体反应后残余的HgCl2溶液定容至50mL时的Hg2+浓度。
2 结果与讨论
2.1 硅烷化试剂浓度对适配体固定率的影响
将浓度为1.59×10-5mol·L-1的AP-16适配体涂抹在20 ℃下分别用浓度为0 mol·L-1、1×10-3mol·L-1、2×10-3mol·L-1、4×10-3mol·L-1、8×10-3mol·L-1、16×10-3mol·L-1的硅烷化试剂处理30min后的玻片表面,于45℃的恒温恒湿培养箱中固定化反应120min,检测适配体固定率,结果见图3。
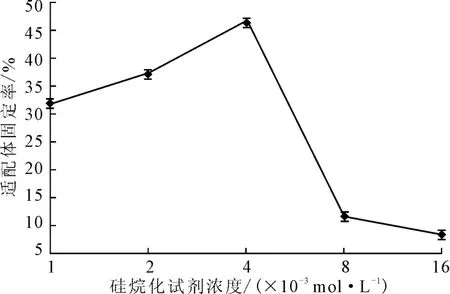
图3 硅烷化试剂浓度对适配体固定率的影响Fig.3 Effect of concentration of silylation reagent on fixed rate of aptamers
由图3可知,随着硅烷化试剂浓度的增大,适配体固定率先升后降,当硅烷化试剂浓度为4×10-3mol·L-1时,适配体固定率最高。未进行硅烷化处理的玻片仍然能够吸附25.23%的适配体。这主要是靠玻片和适配体之间的电荷相互吸引达到固定效果。而如果硅烷化试剂浓度过高,会使其在玻片表面的密度过大,发生重叠,降低了环氧基团与适配体分子的结合效力,导致适配体固定率降低。因此,硅烷化试剂浓度以4×10-3mol·L-1为宜。
2.2 硅烷化反应温度对适配体固定率的影响
硅烷化反应温度设定为35 ℃、45 ℃、55 ℃、65 ℃、75 ℃,硅烷化反应时间为30min,硅烷化试剂浓度为4×10-3mol·L-1,将1.59×10-5mol·L-1的AP-16适配体在45 ℃恒温恒湿培养箱中固定化反应120min,检测适配体固定率,结果见图4。

图4 硅烷化反应温度对适配体固定率的影响Fig.4 Effect of silylation reaction temperature on fixed rate of aptamers
由图4可知,当硅烷化反应温度为45 ℃时,适配体固定率最高,达到66%。当硅烷化反应温度低于45 ℃时,随着温度的升高,适配体固定率不断升高,硅烷化反应温度的升高有利于Si-O-Si键的形成。但当温度高于55 ℃时,高温会使环氧基团失去活性,破坏了硅烷化试剂和适配体的结合,适配体固定率大幅降低[15]。因此,硅烷化反应温度以45 ℃为宜。
2.3 硅烷化反应时间对适配体固定率的影响
玻片在45 ℃下经4×10-3mol·L-1硅烷化试剂分别处理15 min、30 min、45 min、60 min、120 min、150min,表面涂抹浓度为1.59×10-5mol·L-1的AP-16适配体,在45℃的恒温恒湿培养箱中固定化反应120min,检测适配体固定率,结果见图5。
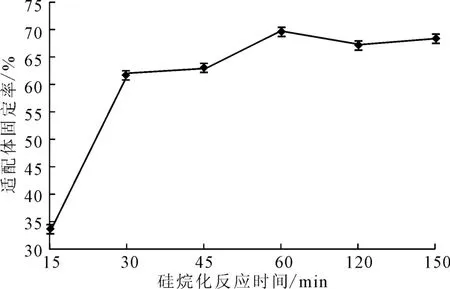
图5 硅烷化反应时间对适配体固定率的影响Fig.5 Effect of silylation reaction time on fixed rate of aptamers
由图5可知,硅烷化反应时间从15min延长到30 min时,适配体固定率明显提高,之后随着硅烷化反应时间的延长,适配体固定率增幅趋缓,在硅烷化反应时间为60min 时,适配体固定率最高,达67.25%。为提高操作效率,选择硅烷化反应时间为30min。由于玻片上的羟基和GOPS发生反应需要一定的时间,反应60min硅烷化基本结束,反应30 min的适配体固定率为62.05 %,与反应60 min 适配体固定率为67.8%相差不大。因此,适当延长硅烷化反应时间能够提高适配体在玻片上的固定率。
2.4 反应时间对适配体固定率的影响
玻片在20 ℃下经过浓度为4×10-3mol·L-1的硅烷化试剂处理30 min,然后将浓度为1.06×10-5mol·L-1AP-16 适配体涂抹于玻片上,将其放入45 ℃的恒温恒湿培养箱中分别固定化反应15 min、30min、60 min、120 min、150 min,检测适配体固定率,结果见图6。
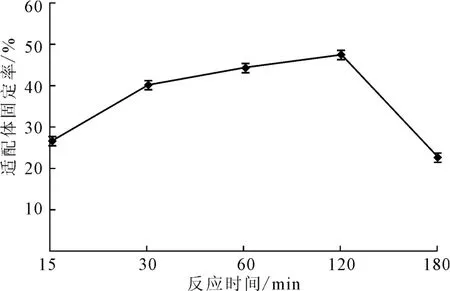
图6 反应时间对适配体固定率的影响Fig.6 Effect of reaction time on fixed rate of aptamers
由图6可知,适配体和玻片表面的硅烷化试剂的反应主要发生在15~120min之间。随着反应时间的延长,适配体固定率呈上升趋势,120min后反应基本结束,适配体固定率急速降低。这可能是因为,表面硅烷偶联剂分子层长期受热,使其自聚交联或者氧化造成Si-O-Si键断裂[14]。因此,反应时间以120 min为宜。
2.5 反应温度对适配体固定率的影响
将浓度为1.06×10-5mol·L-1AP-16适配体涂抹于在20 ℃下经过浓度为4×10-3mol·L-1的硅烷化试剂处理30min后的玻片上,分别在25 ℃、35 ℃、45 ℃、55 ℃、65 ℃、75 ℃的恒温恒湿培养箱中固定化反应120min,检测适配体固定率,结果见图7。
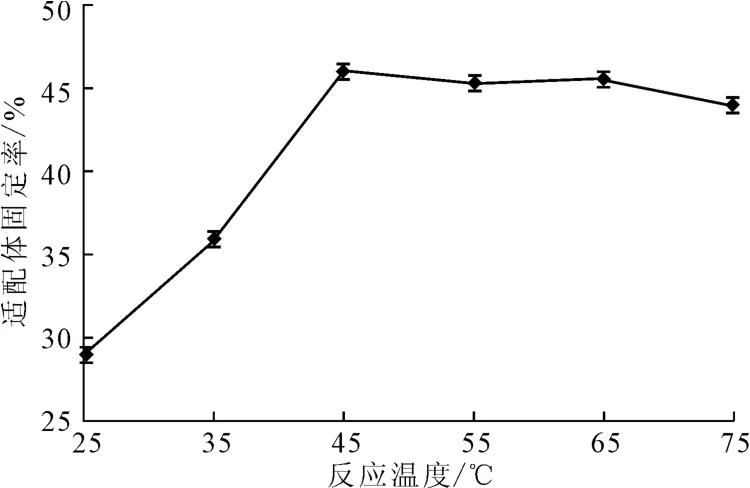
图7 反应温度对适配体固定率的影响Fig.7 Effect of reaction temperature on fixed rate of aptamers
由图7可知,随着反应温度的升高,适配体固定率逐渐上升;当反应温度超过45 ℃后,适配体固定率基本保持稳定。这可能是因为,反应温度过低,适配体上的末端磷酸根与硅烷化试剂的环氧基团的开环反应不充分,不利于适配体在玻片上的固定。反应温度超过45 ℃后,反应较为稳定,即使达到75 ℃的高温,适配体固定率变化也不大,说明该固定方法对反应温度较为宽容。综合考虑,反应温度以45 ℃为宜。
2.6 适配体浓度对适配体固定率的影响
将浓度分别为5.3×10-6mol·L-1、10.6×10-6mol·L-1、15.9×10-6mol·L-1、21.2×10-6mol·L-1、26.5×10-6mol·L-1的适配体涂抹于在20℃下经浓度为4×10-3mol·L-1的硅烷化试剂处理30min后的玻片上,在45℃下固定化反应120min,检测适配体固定率,结果见图8。
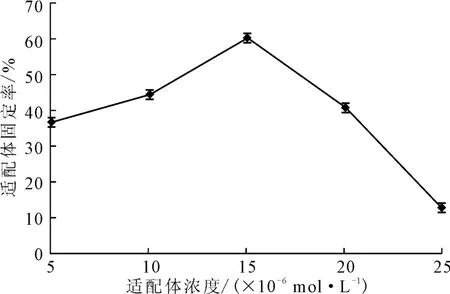
图8 适配体浓度对适配体固定率的影响Fig.8 Effect of concentration of aptamers on fixed rate of aptamers
由图8可知,当适配体浓度在5.3×10-6~15.9×10-6mol·L-1之间时,随着适配体浓度的增大,适配体固定率逐渐上升;当适配体浓度为15.9×10-6mol·L-1时,适配体固定率最高,达到60.46%;之后随着适配体浓度的继续增大,适配体固定率逐渐降低。这可能是因为,适配体片段在玻片上的密度过大,重叠度较高,导致反应效率降低。因此,适配体浓度以15.9×10-6mol·L-1为宜。
2.7 适配体长度对适配体固定率的影响
将浓度为5.3×10-6mol·L-1的AP-16、AP-21、AP-44、AP-50、AP-76适配体涂抹于在20 ℃下经浓度为4×10-3mol·L-1的硅烷化试剂处理30min后的玻片上,在45 ℃下固定化反应120 min,检测适配体固定率,结果见图9。

图9 适配体长度对适配体固定率的影响Fig.9 Effect of aptamers length on fixed rate of aptamers
由图9可知,适配体固定率随着碱基数目的增加即适配体长度的增加而降低。当碱基数目由50增至76时,适配体固定率的降低尤为明显。一方面,由于适配体长度的增加导致其在玻片上可能卷曲,增加了适配体末端磷酸根离子和玻片上硅烷化的环氧基团结合的难度;另一方面,适配体长度的增加,其对应的分子量增加,使得悬挂在玻片上的力相应增大,因此增加了适配体从玻片上脱落的几率,导致适配体固定率降低。因此,适配体长度以16个碱基即AP-16为宜。
2.8 对水中Hg2+的吸附
将玻片按照优化条件分别固定AP-20和AP-22,其中AP-20为能够特异性吸附Hg2+的适配体,AP-22作为对照。AP-20 和AP-22 的平均固定率分别为50.61%和49.51%,较AP-16 的最优固定率(67.25%)略低,这是由于碱基数量的增加导致的。将相同的玻片分别均匀地放到20 mL 浓度为1×10-7mol·L-1的HgCl2溶液中,并做空白对照,结果见图10。
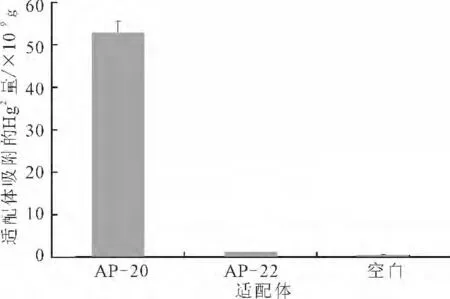
图10 固定有适配体的玻片对Hg2+的吸附Fig.10 Hg2+Adsorbed by glass chips with immobilized aptamers
空白对照组的数据在原子吸收光谱仪允许的误差范围内[16-17]。由图10可知,空白玻片和固定了AP-22的玻片都没有吸附溶液中的Hg2+,而固定有AP-20的玻片对Hg2+具有明显的吸附作用。经计算,固定在玻片上的AP-20吸附Hg2+的量为52.97×10-9g,吸附效率为49.84%。而固定AP-22的玻片,其洗脱溶液的浓度和空白组接近,表明非特异性吸附Hg2+的适配体AP-22不能吸附水溶液中的Hg2+。
3 结论
以玻片为载体,采用共价偶联法对适配体进行了固定,考察了硅烷化试剂浓度、硅烷化温度和时间、适配体与玻片的反应时间和温度、适配体浓度和长度对适配体固定率的影响,确定了固定适配体于玻片上的最佳条件:浓度为1.59×10-5mol·L-1AP-16适配体与硅烷化玻片在45 ℃下反应120min,最佳硅烷化条件:浓度为4×10-3mol·L-1的硅烷化试剂在45 ℃下反应30 min。该条件下,适配体的固定率达62.05%。该法固定化适配体于玻片上具有操作简单易行的特点。在该最优条件下,将适配体AP-20固定在玻片上,初步探索了其对水溶液中Hg2+的吸附效果,固定有适配体的单个玻片吸附Hg2+的效率为49.84%,为利用适配体对水中重金属的富集与去除提供了一种新的研究思路和参考。
[1]徐敦明,吴敏,邹远,等.核酸适体技术在食品安全分析中的应用[J].分析化学,2011,39(6):925-933.
[2]ZHOU Z X,DU Y,DONG S J.DNA-Ag Nanoclusters as fluorescence probe for turn-on aptamer sensor of small molecules[J].Biosens Bioelectronics,2011,28(1):33-37.
[3]LI M,ZHOU X J.Fluorescent aptamer-functionalized graphene oxide biosensor for label-free detection of mercury(Ⅱ)[J].Biosensors and Bioelectronics,2013,41:889-893.
[4]TORIGOE H,MIYAKAWA Y,ONO A,et al.Positive cooperativity of the specific binding between Hg2+ion and T∶T mismatched base pairs in duplex DNA[J].Thermochimica Acta,2012,532:28-35.
[5]VIGNERESSE J L.Evaluation of the chemical reactivity of the fluid phase through hard-soft acid-base concepts in magmatic intrusions with applications to ore generation[J].Chem Geol,2009,263:69-81.
[6]ZAMMATTEO N,JEANMART L,HAMELS S,et al.Comparison between different strategies of covalent attachment of DNA to glass surfaces to build DNA microarrays[J].Anal Chem,2000,280(1):143-150.
[7]HACKLER L Jr,DORMAN G,KELE Z.Development of chemically modified glass surfaces for nucleic acid protein and small molecule microarrays[J].Mol Divers,2003,7(1):25-36.
[8]杨涛,杨婕,张伟,等.聚合物膜与自组装膜法制备电化学DNA 传感器的研究进展[J].分析测试学报,2007,26(3):431-437.
[9]MISRA A,DWIVEDI P.Immobilization of oligonucleotides on glass surface using an efficient heterobifunctional reagent through maleimide-thiol combination chemistry[J].Anal Biochem,2007,369(2):248-255.
[10]MAHAJAN S,KUMAR P,GUPTA K C.An efficient and versatile approach for the construction of oligonucleotide microarrays[J].Bioorg Med Chem Lett,2006,16(21):5654-5658.
[11]ALDAYE F A,PAMER A L,SLEIMAN H F.Assembling materials with DNA as the guide[J].Science,2008,321(5897):1795-1799.
[12]ONO A,TOGASHI H.Highly selective oligonucleotide-based sensor for mercury(Ⅱ)in aqueou solutions[J].Chem Int Ed,2004,43(33):4300-4302.
[13]DENDANE N,HOANG A,GUILLARD L,et al.Efficient surface patterning of oligonucleotides inside a glass capillary through oxime bond formation[J].Bioconj Chem,2007,18(3):671-676.
[14]MIYAKE Y,TOGASHI H,TASHIRO M,et al.MercuryⅡ-mediated formation of thymine-HgⅡ-base pairs in DNA duplexes[J].Journal of the American Chemical Society,2006,128(7):72-76.
[15]王辉,邸明伟,王清文.热环境对偶联剂处理聚乙烯木塑复合材表面性质的影响[J].林业科学,2013,49(12):114-120.
[16]夏新,吴志强,康长安,等.测定汞的原子荧光法和冷原子吸收法比对研究[J].中国测试,2012,38(2):60-62.
[17]区红,张燕子,吴庆晖,等.冷原子吸收光谱法结合热解-原子吸收光谱法快速测定废水样中痕量无机汞和总有机汞[J].分析测试学报,2004,23(4):68-70.

