手性萃取剂与液-液萃取拆分对映体技术研究进展
黄钰清,鲍宗必,邢华斌,杨亦文,张治国,任其龙
(生物质化工教育部重点实验室,浙江大学化学工程与生物工程学院,浙江 杭州 310027)
手性萃取剂与液-液萃取拆分对映体技术研究进展
黄钰清,鲍宗必,邢华斌,杨亦文,张治国,任其龙
(生物质化工教育部重点实验室,浙江大学化学工程与生物工程学院,浙江 杭州 310027)
手性对映体的拆分是当前备受关注的一个研究领域。手性对映体的拆分方法有多种,手性液-液萃取拆分法是其中有较好发展前景的一种手性对映体拆分技术。本文概述了手性液-液萃取技术的基本原理,并进一步对酒石酸类手性萃取剂、环糊精类手性萃取剂、冠醚类手性萃取剂、金属络合物类手性萃取剂等不同种类手性萃取剂及其研究进展进行了综述。分析表明,手性液-液萃取拆分技术对外消旋体特别是药物外消旋体的拆分有较好的效果,随着对手性萃取剂研究的进一步深入,手性液-液萃取有望成为一种手性化合物拆分的重要方式。
手性萃取剂;萃取分离;手性拆分;药物
手性是某些物质不能与其镜像重合的特征,互成实物和镜像对映的两个异构体,称为对映异构体。由于单一对映体天然来源有限,不对称合成仍存在一些问题有待解决,因此通过拆分外消旋体制备光学纯手性化合物仍具有重要的研究意义。
目前,手性对映体拆分是获得单一对映体的主要途径之一,手性拆分是在手性助剂的作用下将外消旋体中的两个对映异构体分开,从而获得光学纯手性化合物的方法。现有的拆分方法[1-2]一般有化学拆分法[3]、生物拆分法[4]、结晶拆分法[5]、色谱拆分法[6]等。传统手性拆分方法都存在着一定的局限性,近年来,许多新的手性拆分方法不断发展,其中手性液-液萃取拆分法是研究较广泛的一种手性拆分方法。
1 手性液-液萃取技术原理
传统的液-液萃取工业应用表明,液-液萃取法具有设备简单、易于放大、生产过程易实现自动化与连续化等优点,且一般在常温、常压下进行,能耗低。手性液-液萃取拆分法是将传统的液-液萃取技术应用于外消旋体的拆分,因此手性液-液萃取技术中也存在互不相容的两相,多为水相和有机相。待拆分的外消旋体溶解在一相中,在另一相中溶解有手性萃取剂;也有研究同时在两相中添加不同的手性萃取剂,通过手性萃取剂对两对映体的手性识别使其中一个对映体被选择地萃取到另一相中。手性识别是手性液-液萃取技术的关键,手性识别是通过手性萃取剂与对映体形成非对映体而实现的,非对映体的形成是一系列分子间作用的结果,可能有静电作用、氢键作用、范德华力、π-π相互作用、立体排斥作用等。手性识别过程通常用三点相互作用模式来解释[7]。两种非对映体具有不同的化学和物理特性而存在一定的自由能差。手性液-液萃取正是依靠两非对映体的自由能差实现外消旋体拆分,理论上,欲使两对映体选择性系数(或称分离因子)达到1.2,常温下所需的自由能差(ΔG = −RTlnα)仅为−0.46kJ/mol,那么在足够多的级数下,即可实现两者的高纯度分离。
2 手性萃取剂
目前至少存在3种萃取拆分体系:即亲和萃取拆分体系、配位萃取拆分体系和形成非对映体立体异构体萃取拆分体系[8]。
在手性液-液萃取拆分外消旋体的技术中,关键在于高立体选择性的萃取拆分剂。然而,目前尚无广谱的高效手性拆分萃取剂的报道。手性萃取剂的种类较多,但对不同外消旋体的手性拆分效果差别大,且拆分效果不理想,是目前手性液-液萃取技术难以大规模推广应用的一个重要原因。目前,研究报道的手性萃取剂主要有酒石酸类手性萃取剂、环糊精类手性萃取剂、冠醚类手性萃取剂、金属络合物类手性萃取剂以及其他特殊的手性萃取剂。
2.1 酒石酸类手性萃取剂
酒石酸酯是酒石酸在酸催化下与醇发生酯化反应生成的酯。研究中较多用到的为L或D-酒石酸的正丁酯、异丁酯、正戊酯、异戊酯、正己酯、环己酯、苄酯等。不同的酒石酸酯因其取代基不同,对某种外消旋体的拆分能力也有所不同。酒石酸酯是目前研究最广的一类手性萃取剂。
最初,Bowman等[9]研究了用酒石酸异丙酯萃取拆分一些酸、醇的外消旋体。如以 L-(+)-酒石酸异戊酯为萃取剂萃取拆分樟脑磺酸、二-(4-吡啶基)-乙二醇等消旋化合物,获得一定拆分效果。
岑仲浙等[10]以光学纯的酒石酸和醇为原料,经酯化反应合成了左旋、右旋、消旋三种酒石酸正丁二酯、酒石酸异戊二酯,并将其应用于麻黄碱差向异构体的手性萃取。实验表明,L-酒石酸正丁二酯作萃取剂,α可达 1.87,L-酒石酸异戊二酯作萃取剂,α可达1.93。
易健民等[11]以酒石酸酯为手性萃取剂,研究了顺式二氯菊酸对映体立体选择性萃取的分配行为,考察了有机相种类、L-酒石酸酯浓度、水相pH值、L-酒石酸酯烷基链长度和萃取温度等因素对萃取分离效果的影响,获得如下规律:酒石酸酯对顺式二氯菊酸有手性识别能力,且随着酯浓度的增加,分配系数 K和分离因子α逐渐增大,当酯浓度等于0.20mol/L时,α值开始减小;水相pH值增大,分配系数和分离因子降低;L-酒石酸酯烷基链长度和萃取温度对K和α也有较大影响。
Ren等[12]以L-酒石酸酯为手性萃取剂,对外消旋布洛芬进行了手性液-液萃取研究。研究考察了L-酒石酸酯的种类、萃取剂浓度、有机相种类、水相pH值等因素对萃取拆分效果的影响,结果表明L-酒石酸二戊酯为萃取剂萃取效果最佳,采用正癸醇、1,2-二氯乙烷等极性有机溶剂萃取拆分效果较好,水相 pH值减小有利于提高分配系数和分离因子。
此外,许多文献还报道了酒石酸衍生物作为萃取剂对外消旋体进行拆分。酒石酸酯[13-14]、苯甲酰酒石酸[15]、磷酸酒石酸复合物[16-18]等酒石酸衍生物都在研究中被证实有一定的手性拆分能力。如Sunsandee等[19]以苯甲酰酒石酸为手性萃取剂,研究了氨氯地平的手性液-液萃取拆分效果。研究中萃取剂溶于正癸醇有机相,待拆分的外消旋体溶于水相,考察了萃取剂浓度、平衡时间、水相pH值等因素对萃取效果的影响。研究表明,苯甲酰酒石酸对氨氯地平有较好的手性拆分效果,单次萃取(S)-氨氯地平的对映体过量值(ee值)可达 24.27%。Tan等[20]以季铵盐离子和酒石酸衍生物为共萃取剂,两共萃取剂先形成复合物,对氨基酸对映体进行手性萃取分离研究。研究考察了萃取剂组成、溶质浓度、分子结构、pH值、温度等因素的影响。随着体系中所加的三辛基甲基氯化铵的浓度增大,手性萃取的分配系数和分离因子均增大。随着体系中所加的手性萃取剂浓度的增大,手性萃取的分配系数减小,分离因子增大。氨基酸的分子结构中疏水基增加,分配系数增大,亲水基增加,分配系数减小。
2.2 环糊精类手性萃取剂
环糊精(CD)是由淀粉酶经环合而得的 6~8个 D-吡喃葡萄糖单元以α-(1,4)糖苷键连接成的低聚糖化合物。环糊精的葡萄糖单元已知有6~12个,最常见的3种是α、β、γ-CD,其中以β-环糊精的应用最为广泛。β-环糊精是由 7个葡萄糖残基通过α-(1,4)糖苷键连接的类似于厚壁截顶圆锥桶的环状分子,筒状内腔密布氧原子,具有很高的电子云密度,而分布在筒状两端的羟基使得分子表面呈现亲水性。这种“外亲水,内疏水”的结构特性使环糊精可与一些化合物分子形成包合物,使亲水性较差的化合物和化合物的基团能包合在环糊精的分子空腔里得到保护。目前,关于环糊精在手性物质的分析分离上的应用越来越受关注,尤其是在色谱分析分离领域常用作色谱手性固定相或手性流动相添加剂,因此β-环糊精及其衍生物有望作为新的手性萃取剂[21]。

图1 β-环糊精的分子结构
苗家兵[22]研究了亲水性β-环糊精衍生物作为手性萃取剂在两相体系中对α-环己基扁桃酸和苯基琥珀酸外消旋体的手性拆分效果,其中萃取剂溶解于水相,待拆分的外消旋体溶解于有机相。研究中对不同的β-环糊精衍生物萃取剂(β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、羟乙基-β-环糊精)、有机溶剂种类、水相中萃取剂浓度、对映体浓度、pH值、温度等因素进行了考察。研究表明,在较优的条件下,α-环己基扁桃酸和苯基琥珀酸的分离因子均可达到2.4左右。周从山等[23]以磺丁基-β-环糊精为萃取剂研究了氯丙那林的萃取拆分。
环糊精类手性萃取剂也常和其他手性萃取剂同时使用,两者分别溶解在两相中,构成双相识别手性萃取体系。唐课文等[24]研究了萘普生在 D(L)-酒石酸异丁酯的1,2-二氯乙烷有机相和羟丙基-β-环糊精的水相组成双相萃取体系中的分配行为。研究中合成的酒石酸酯溶于1,2-二氯乙烷中配成一定浓度的有机相,萘普生外消旋体溶于含有羟丙基-β-环糊精的 0.1mol/LNaH2PO4/H3PO4缓冲溶液中作为水相。在较优的条件下,分离因子可达1.65。双相识别手性萃取是一种新的手性分离技术,其分离能力比只在单一相中添加手性萃取剂的分离能力好。此外,也有许多研究者研究了环糊精和其他手性萃取剂构成的双相识别手性萃取体系的萃取效果[25-27],证实双相识别手性萃取体系有较理想手性萃取效果。
2.3 冠醚类手性萃取剂
冠醚类手性萃取剂是一种高手性选择性的手性萃取剂,是一种重要的手性萃取剂。手性冠醚的合成可从联萘酚及其衍生物、手性有机酸、单糖及其他天然或非天然的手性源出发。手性冠醚的一大用途是用于对映体的手性识别与拆分,特别是对某些手性氨基酸、氨基醇和胺类物质选择性较高。手性冠醚的结构特征是大醚环上必须含有或兼连有手性中心,使手性冠醚分子对被络合的客体分子具有结构选择性和手性选择性,或可根据被识别的客体分子的立体模型而设计主体手性冠醚,其空腔大小、电荷分布以及分子的不对称性必须使之能与客体分子相匹配[28]。
Colera等[29]合成了4种新的疏水性手性18-冠-6-醚(图2),并将合成的冠醚作为手性萃取剂,对苦味酸铵外消旋体进行了手性萃取拆分研究。萃取研究中,苦味酸铵外消旋体溶解在水相,合成的冠醚手性萃取剂溶解在氯仿有机相。研究表明,4种冠醚作手性萃取剂均有较好的手性拆分效果,最大的分离因子达2.8,单次萃取后水相中的对映体过量值(ee值)均大于23%,最大可达33%。
Bredikhina等[30]以愈创木酚甘油醚为原料合成了带有ArO-或MeO-侧链的套索醚(图3)。将合成的几种套索醚作为手性萃取剂分别应用于甲基苯基甘氨酸六氟磷酸盐、α-苯乙胺六氟磷酸盐外消旋体的手性拆分,其中手性萃取剂溶解在氯仿有机相,待拆分的外消旋体溶解在水相。研究表明,11c手性萃取剂有较好的手性识别效果。

图2 4种疏水性手性18-冠-6-醚

图3 5种套索醚
Steensma等[31]考察了偶氮酚冠醚手性萃取剂(图 4)的手性拆分效果。偶氮酚冠醚最初被用作制备手性色谱固定相。研究考察了偶氮酚冠醚作为手性萃取剂萃取拆分多种胺类和氨基醇,其中偶氮酚冠醚溶解在氯仿有机相,待拆分的外消旋体溶解于水相。研究表明,偶氮酚冠醚对部分胺类和氨基醇有明显的手性拆分效果,对苯甘氨醇的手性萃取分离因子可达5.0。
Demirel等[32]合成了二氮烷基冠醚手性萃取剂,这是一种含氮的杂环冠醚(图5)。研究考察了二氮烷基冠醚作为手性萃取剂对苯甘氨酸、苯丙氨酸、色氨酸等多种手性氨基酸外消旋体的萃取拆分效果,其中二氮烷基冠醚溶解在氯仿有机相,待拆分的外消旋体溶解在水相。研究表明,二氮烷基冠醚对氨基酸外消旋体的拆分效果较好,最高的分离因子达1.95。

图4 偶氮酚冠醚

图5 二氮烷基-18-冠-6醚
2.4 金属络合物类手性萃取剂
近年来,过渡金属复合物应用于手性液-液萃取取得了较好的萃取拆分效果。铜、钯、钴、镍等金属与不同配体作用形成的复合物均有一定的手性拆分能力。研究中,金属复合物类手性萃取剂较多应用于手性氨基酸的拆分,并有较好的拆分效果。
唐课文等[33]研究了氧氟沙星对映体在含有Cu2+和 N-n-十二烷基-L-脯氨酸手性配体(L)两相体系中的分配平衡。氨基酸衍生物萃取剂作为手性配体存在于有机相,水相则含有Cu2+等配体离子,基于配体交换反应,两个对映体分别和Cu2+及手性配体形成铜三元配合物,两对映体转变成两个非对映体,从而可在两相中实现分配。研究考察了pH值、Cu2+浓度、手性配体浓度等因素对氧氟沙星对映体在两相中的分配系数和分离因子的影响。随着 pH值增大,分配系数增大,分离因子减小;随着Cu2+浓度的增大,分配系数和分离因子先增大后减小;随着手性配体浓度的增大,分配系数和分离因子先增大后略有减小。Steensma等[31]以铜-脯氨酸衍生物作萃取剂研究了胺类和氨基醇的液-液萃取拆分。
Verkuijl等[34-35]以钯-BINAP(联萘二苯基磷)复合物为手性萃取剂(图6),研究了其对未衍生化的氨基酸、苯丙氨酸衍生物的手性拆分效果。萃取过程可用界面反应萃取机理来解释(图7),氨基酸在水相中电离,阴离子和萃取剂钯-BINAP复合物在相界面进行离子交换,从而以形成新络合物的方式将氨基酸萃取到有机相中。萃取研究中,钯-BINAP复合物溶解在二氯甲烷有机相,待拆分的氨基酸外消旋体溶解在水相。研究表明,萃取分离因子可高达2.4。此外,唐课文等[36]和张盼良等[37-39]还研究了多种金属-BINAP复合物为手性萃取剂对手性氨基酸的手性拆分效果。

图6 可能的[PdCl((S)-BINAP)D-Trp]复合物结构

图7 萃取模型
Verkuijl等[40]以钯-N配体复合物为手性萃取剂(图8),研究了其对未衍生化氨基酸的手性萃取拆分效果。萃取研究中,钯复合物作为萃取剂溶解在有机相,待拆分的氨基酸溶解在水相。以Pd-pyBOX作萃取剂(1.0mmol/L),蛋氨酸为拆分对象(2.0mmol/L),6℃和pH值为8时,氯苯为有机相时萃取分离因子可达2.3。

图8 两种Pd-N配体复合物
Tsukube等[41]以镧-氟化-β-二酮复合物为手性萃取剂(图 9)研究了其对未受保护的氨基酸的萃取拆分效果。考察多种镧系金属离子作金属中心,包括镨、铕、镝、铒、镱等。氨基酸阴离子或两性离子和萃取剂络合方式如图10所示,萃取剂通过络合反应方式将氨基酸萃取到有机相中。不同金属离子的手性选择性顺序为Yb3+>Er3+>Eu3+≥Pr3+。研究中,部分拆分对象的对映体过量值(ee值)较高,最高为2e,以2e作萃取剂溶解在二氯甲烷有机相,拆分水相的苯甘氨酸,pH值为6.2时,ee值达49%。
Reeve等[42]以疏水性手性salen配体-钴复合物为手性萃取剂(图11),研究了其对N-苄基-α-氨基酸的手性萃取效果。该钴复合物萃取 N-苄基-α-氨基酸的反应过程如图12所示,萃取剂与一个对映体通过络合形成新复合物,从而拆分两个对映体。研究中,萃取剂溶于二氯甲烷有机相,待拆分的氨基酸溶于水相。研究表明,不同萃取剂拆分 N-苄基-丙氨酸,(R,R)-[CoIII(3)(OAc)]萃取剂拆分效果最好,对映体过量值(ee值)达93.0%;以(R,R)-[CoIII(3) (OAc)]为萃取剂拆分不同的N-苄基-α-氨基酸,拆分N-苄基-亮氨酸效果最好,ee值可达99.0%。
2.5 其他手性萃取剂
此外,有研究考察了一些特殊的具有手性识别能力的手性萃取剂,这些手性萃取剂对部分手性化合物有一定的拆分效果。
Schuur等[43-44]以金鸡纳碱作为手性萃取剂,见手性酮(S)-3萃取剂(图15),在含有三辛基甲基氯化铵的萃取体系中考察了其对一般未衍生化氨基酸图 13),在离心萃取器中萃取拆分 3,5-二硝基苯甲酰基-D,L-亮氨酸。萃取机理如图14所示,CA代表萃取剂。研究中,萃取剂溶解在 1,2-二氯乙烷有机相,拆分对象溶解在水相,在反萃后水相无回流的情况下,萃取级数为12时可实现对映体过量值(ee值)大于99%。

图9 镧系金属复合物萃取剂

图10 阴离子、两性离子与萃取剂络合

图11 手性salen配体

图12 salen配体-钴复合物萃取外消旋的N-苄基-丙氨酸

图13 金鸡纳碱萃取剂
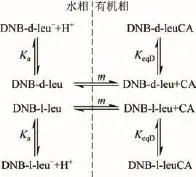
图14 萃取模型
Huang等[45]以手性联萘酚醛为原料合成了一种的萃取拆分效果,并对萃取机理进行了探索。研究中,该萃取剂溶于氯仿有机相,拆分对象溶于水相,该萃取剂对大部分氨基酸都有一定的手性拆分效果。对其萃取苯丙氨酸的研究表明,萃取可能是通过形成中间产物(S)-3-苯丙氨酸-水实现的。手性选择性(D∶L)可达18∶1。

图15 手性酮萃取剂
Verkuijl等[46]以3,3'-二芳基-二萘酚磷酸为手性萃取剂(图 16),将其应用于外消旋苄基伯胺的手性拆分。研究中,萃取剂溶于有机相,拆分对象溶于水相。研究表明,以PA1为萃取剂拆分不同消旋体,对苯甘氨醇拆分效果最好;拆分苯甘氨醇PA1萃取剂效果最好,拆分苯丙胺PA4萃取剂效果最好;以四氯化碳、1,2-二氯甲烷等为有机溶剂拆分效果较好。

图16 联萘酚磷酸
Lacour等[47]以TRISPHAT盐为手性萃取剂(图17),将其应用于三(二亚胺)钌复合物(图 18)的手性萃取。研究中,萃取剂溶于氯仿有机相,拆分对象溶于水相。研究表明,萃取率可达45%以上,有机相中两复合物比例最高可达49∶1。
Baragaña等[48]合成了甾体类胍盐(图19)并将其作为手性萃取剂用于 N-乙酰-α-氨基酸的萃取拆分。实验中,萃取剂溶于氯仿有机相,拆分对象溶于水相,萃取剂作为手性受体将氨基酸萃取到有机相中,手性选择性(L∶D)达7∶1-10∶1。

图17 TRISPHAT盐

图18 两种钌复合物

图19 甾体类胍基盐萃取剂
Peng等[49]合成了扁桃酸酯衍生物,并将其作为手性萃取剂用于萃取拆分左匹克隆外消旋体。研究中,萃取剂溶于有机相,拆分对象溶于水相,考察了不同酒石酸酯、萃取剂浓度、有机溶剂种类、pH值、温度等因素对萃取效果的影响。结果表明,邻氯扁桃酸丙酯为萃取剂拆分效果较好,最高分离因子可达1.64。
Schuur等[50]以杯芳烃为萃取剂(图20),将其应用于甲基苯甘氨酸的手性萃取。研究中,萃取剂溶于甲苯有机相,拆分对象溶于水相。研究表明,温度25℃,pH值8.8时,分离因子可达1.5。

图20 杯芳烃萃取剂
3 总结和展望
以手性萃取剂为介质,通过液-液萃取对手性化合物的外消旋体进行拆分是有研究意义的。研究中主要的难点在于开发高效的手性萃取剂,理想的萃取剂应能通过简单、廉价的合成途径获得,有较高的萃取选择性,且适用的萃取拆分对象范围较广。酒石酸酯类手性萃取剂的的手性识别能力相对较差;环糊精类手性萃取剂对疏水性物质的包结作用使其对部分手性物质有较理想的手性识别能力;冠醚类手性萃取剂的空腔结构使其手性识别能力较好;金属络合物类手性萃取剂对于能形成络合物的手性物质的手性识别能力好,大多应用于氨基酸及其衍生物的手性拆分,但一些金属的价格较高;其他新开发的手性萃取剂对一部分手性物质也有着较好的手性识别能力,特别是一些大分子物质显示出较好的手性识别能力。随着研究的不断完善,更多的手性萃取剂应用于手性液-液萃取,手性液-液萃取有望成为一种手性化合物拆分的重要方式。
[1]Lorenz H,Seidel-Morgenstern A. Processes to separate enantiomers[J]. Angewandte Chemie International Edition,2014,53(5):1218-1250.
[2]王彦广,吕萍,张殊佳,等. 有机化学[M]. 北京:化学工业出版社,2008:59-60.
[3]黄蓓,杨立荣,吴坚平. 手性拆分技术的工业应用[J]. 化工进展,2002,21(6):375-380.
[4]Xu D,Li Z,Ma S. Novozym-435-catalyzed enzymatic separation of racemic propargylic alcohols. A facile route to optically active terminal aryl propargylic alcohols[J]. Tetrahedron Letters,2003,44(33):6343-6346.
[5]Lorenz H,Perlberg A,Sapoundjiev D,et al. Crystallization of enantiomers[J]. Chemical Engineering and Processing:Process Intensification,2006,45(10):863-873.
[6]Feitsma K G,Drenth B F H. Chromatographic separation of enantiomers[J]. Pharmaceutisch Weekblad,1988,10(1):1-11.
[7]Schuur B,Verkuijl B J V,Minnaard A J,et al. Chiral separation by enantioselective liquid–liquid extraction[J]. Organic & Biomolecular Chemistry,2011,9(1):36-51.
[8]李俊,蔡水洪. 手性化合物的萃取拆分研究[J]. 化学世界,2001,42(5):233-236.
[9]Bowman N S,McCloud G T,Schweitzer G K. Partial resolutionn of some organic racemates by solvent extraction[J]. Journal of the American Chemical Society,1968,90(14):3848-3852.
[10]岑仲浙,蔡水洪. 手性溶剂萃取麻黄碱差向异构体[J]. 化工学报,2000,51(3):418-420.
[11]易健民,陈立根,唐课文,等. 手性溶剂萃取分离顺式二氯菊酸对映体[J]. 化学通报,2008,71(9):701-705.
[12]Ren Z,Zeng Y,Hua Y,et al. Enantioselective liquid–liquid extraction of racemic ibuprofen by l-tartaric acid derivatives[J]. Journal of Chemical & Engineering Data,2014,59(8):2517-2522.
[13]唐课文,周春山. L-酒石酸酯立体选择性萃取分离扁桃酸对映体[J].应用化学,2003,20(11):1108-1110.
[14]周丹,刘佳佳,唐课文. 手性酯类萃取剂萃取拆分α-环己基扁桃酸外消旋体[J]. 分析测试学报,2006,25(6):49-52.
[15]黄可龙,胡卫国,焦飞鹏,等. 组合手性萃取拆分克伦特罗外消旋体[J]. 分析科学学报,2007,23(3):283-286.
[16]Tan B,Luo G S,Qi X,et al. Enantioselective extraction of d,l-tryptophan by a new chiral selector:Complex formation with di(2-ethylhexyl) phosphoric acid and O,O’-dibenzoyl-(2R,3R)-tartaric acid[J]. Separation and Purification Technology,2006,49(2):186-191.
[17]Tan B,Luo G,Wang J. Enantioseparation of amino acids by co-extractants with di (2-ethylhexyl) phosphoric acid and tartaric acid derivatives[J]. Tetrahedron:Asymmetry,2006,17(6):883-891.
[18]Jiao F,Yang W,Huang D,et al. Enantioseparation of ofloxacin enantiomers by mixed extractants in biphasic system[J]. Separation Science and Technology,2012,47(13):1971-1976.
[19]Sunsandee N,Pancharoen U,Rashatasakhon P,et al. Enantioselective separation of racemic amlodipine by two-phase chiral extraction containing O,O’-Dibenzoyl-(2S,3S)-tartaric acid as chiral selector[J]. Separation Science and Technology,2013,48(15):2363-2371.
[20]Tan B,Luo G,Wang J. Extractive separation of amino acid enantiomers with co-extractants of tartaric acid derivative and Aliquat-336[J]. Separation and Purification Technology,2007,53(3):330-336.
[21]松丽涛. 对映体手性萃取分离及包结作用研究[D]. 长沙:中南大学,2010.
[22]苗家兵. 包合反应手性萃取分离芳香酸对映体及其动力学研究[D].长沙:中南大学,2010
[23]Zhou C S,Xu P,Tang K W,et al. Enantioselective extraction of clorprenaline enantiomers with hydrophilic selector of sulfobutylether-β-cyclodextrin by experiment and modeling[J].Journal of Central South University,2014,21:891-899.
[24]唐课文,陈圆圆,刘佳佳. 双相 (O/W) 识别手性萃取分离萘普生对映体[J]. 中国药学杂志,2008,43(8):620-623.
[25]陈圆圆. 双相(O/W)识别手性萃取分离对映体的研究[D]. 长沙:中南大学,2008
[26]Szwed K,Górecki M,Frelek J,et al. Enantioselective extraction system containing binary chiral selectors and chromatographic enantioseparation method for determination of the absolute configuration of enantiomers of cyclopentolate[J]. Chromatographia,2013,76(23-24):1603-1611.
[27]Tang K,Yi J,Huang K,et al. Biphasic recognition chiral extraction:A novel method for separation of mandelic acid enantiomers[J]. Chirality,2009,21(3):390-395.
[28]高明章,杨奕群,许遵乐. 手性冠醚的研究进展[J]. 有机化学,2001,21(7):477-484.
[29]Colera M,Costero A M,Gaviña P,et al. Synthesis of chiral 18-crown-6 ethers containing lipophilic chains and their enantiomeric recognition of chiral ammonium picrates[J]. Tetrahedron:Asymmetry,2005,16(15):2673-2679.
[30]Bredikhina Z A,Eliseenkova R M,Fayzullin R R,et al. Synthesis and extraction properties of some lariat ethers derived from the spontaneously resolved guaifenesin , 3-(2-methoxyphenoxy) propane-1,2-diol[J]. Arkivoc,2011,10:16-32.
[31]Steensma M,Kuipers N J M,De Haan A B,et al. Identification of enantioselective extractants for chiral separation of amines and aminoalcohols[J]. Chirality,2006,18(5):314-328.
[32]Demirel N,Bulut Y,Hoşgören H. Enantioselective transport and liquid-liquid extraction of amino acids as their potassium and sodium salts by optically active diaza-18-crown-6 ethers[J]. Chirality,2004,16(6):347-350.
[33]唐课文,陈国斌,易健民,等. 基于手性配体交换反应立体选择性萃取分离氧氟沙星对映体[J]. 化学学报,2004,62(17):1621-1625.
[34]Verkuijl B J V,Minnaard A J,de Vries J G,et al. Chiral separation of underivatized amino acids by reactive extraction with palladium-BINAP complexes[J]. The Journal of Organic Chemistry,2009,74(17):6526-6533.
[35]Verkuijl B J V,Schuur B,Minnaard A J,et al. Chiral separation of substituted phenylalanine analogues using chiral palladium phosphine complexes with enantioselective liquid-liquid extraction[J]. Organic & Biomolecular Chemistry,2010,8(13):3045-3054.
[36]Tang K W,Fu T,Zhang P L. Enantioselective liquid-liquid extraction of (D,L)-valine using metal-BINAP complex as chiral extractant[J]. Journal of Chemical Technology and Biotechnology,2013,88(10):1920-1929.
[37]Zhang P L,Liu C,Tang K W,et al. Studies on enantioselective liquid-liquid extraction of amino-(4-nitro-phenyl)-acetic acid enantiomers:Modeling and optimization[J]. Chirality,2014,26(2):79-87.
[38]Zhang P L,Luo J J,Tang K W,et al. Kinetics of enantioselective liquid-liquid extraction of phenylglycine enantiomers using a BINAP-copper complex as chiral selector[J]. Chemical Papers,2014,68(10):1317-1324.
[39]Zhang P,Liu C,Tang K,et al. Modeling and optimizing the biphasic enantioselective partitioning of 2-fluoro-phenylalanine enantiomers with binap-metal complexes as chiral selector[J]. Journal of Solution Chemistry,2015,44(1):112-130.
[40]Verkuijl B J V,Schoonen A K,Minnaard A J,et al. The use of N-type ligands in the enantioselective liquid-liquid extraction of underivatized amino acids[J]. European Journal of Organic Chemistry,2010,2010(27):5197-5202.
[41]Tsukube H,Shinoda S,Uenishi J,et al. Molecular recognition with lanthanide (Ⅲ) tris (β-diketonate) complexes:Extraction,transport,and chiral recognition of unprotected amino acids[J]. Inorganic Chemistry,1998,37(7):1585-1591.
[42]Reeve T B,Cros J P,Gennari C,et al. A practical approach to the resolution of racemic N-benzyl-α-amino acids by liquid-liquid extraction with a lipophilic chiral salen-cobalt (III) complex[J]. Angewandte Chemie International Edition,2006,45(15):2449-2453.
[43]Schuur B,Floure J,Hallett A J,et al. Continuous chiral separation of amino acid derivatives by enantioselective liquid-liquid extraction in centrifugal contactor separators[J]. Organic Process Research & Development,2008,12(5):950-955.
[44]Schuur B,Winkelman J G M,de Vries J G,et al. Experimental and modeling studies on the enantio-separationof 3,5-dinitrobenzoyl-(R),(S)-leucine by continuous liquid–liquid extraction in a cascade of centrifugal contactor separators[J]. Chemical Engineering Science,2010,65(16):4682-4690.
[45]Huang H,Nandhakumar R,Choi M,et al. Enantioselective liquid–liquid extractions of underivatized general amino acids with a chiral ketone extractant[J]. Journal of the American Chemical Society,2013,135(7):2653-2658.
[46]Verkuijl B J V,de Vries J G,Feringa B L. 3,3’-diaryl-BINOL phosphoric acids as enantioselective extractants of benzylic primary amines[J]. Chirality,2011,23(1):34-43.
[47]Lacour J,Goujon G C,Torche H S,et al. Efficient enantioselective extraction of tris (diimine) ruthenium (II) complexes by chiral,lipophilic TRISPHAT anions[J]. Angewandte Chemie International Edition,2000,39(20):3695-3697.
[48]Baragaña B,Blackburn A G,Breccia P,et al. Enantioselective transport by a steroidal guanidinium receptor[J]. Chemistry:A European Journal,2002,8(13):2931-2936.
[49]Peng Y,He Q,Zuo B,et al. Enantioselective liquid-liquid extraction of zopiclone with mandelic acid ester derivatives[J]. Chirality,2013,25(12):952-956.
[50]Schuur B,Blahušiak M,Vitasari C R,et al. Selector screening for enantioseparation of DL-α-methyl phenylglycine amide by liquid-liquid extraction[J]. Chirality,2015,27(2):123-130.
Chiral extractants and enantioselective liquid-liquid extraction
HUANG Yuqing,BAO Zongbi,XING Huabin,YANG Yiwen,ZHANG Zhiguo,REN Qilong
(Key Laboratory of Biomass Chemical Engineering of Ministry of Education,College of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310027,Zhejiang,China)
Techniques for separating enantiomers are the focus of concern currently. Among numerous techniques for separating enantiomers,such as crystallization,chromatography,enantioselective liquid-liquid extraction is one of the most promising techniques for industrial application. This review firstly introduced the basic principles of the enantioselective liquid-liquid extraction technique,and then summarized various chiral extractants including tartrates-based extractants,cyclodextrin-based extractants,crown ether based-extractants,metal complexes-based extractants,and other enantioselective extraction agents as well as their recent advances. Researches indicate that enantioselective liquid-liquid extraction shows remarkable enantioseparation ability for enantiomers especially racemic pharmaceuticals. With the developing of new chiral extractants,enantioselective liquid-liquid extraction can be an important technique for enantiomers separation.
chiral extractants; extraction separation; enantioseparation; pharmaceuticals
TQ 460.6
A
1000-6613(2015)12-4324-09
10.16085/j.issn.1000-6613.2015.12.032
2015-03-09;修改稿日期:2015-04-08。
浙江省教育厅科研项目(Y201016430)、国家自然科学基金(21376205)及浙江省自然科学基金(Y13B060004)项目。
黄钰清(1992—),女,硕士研究生。E-mail yuqing_wong @163.com。联系人:鲍宗必,副教授。E-mail baozb@zju.edu.cn。

