野慈姑对吡嘧磺隆抗性的分子机理
刘 延, 刘华招, 高增贵
(1.黑龙江省农垦科学院植物保护研究所,黑龙江哈尔滨 150038;2.黑龙江省农垦科学院水稻研究所,黑龙江哈尔滨 150038;
3.沈阳农业大学植物免疫研究所,辽宁沈阳 110866)
野慈姑对吡嘧磺隆抗性的分子机理
刘延1, 刘华招2, 高增贵3
(1.黑龙江省农垦科学院植物保护研究所,黑龙江哈尔滨 150038;2.黑龙江省农垦科学院水稻研究所,黑龙江哈尔滨 150038;
3.沈阳农业大学植物免疫研究所,辽宁沈阳 110866)
摘要:野慈姑是我国稻田危害最严重的杂草之一。以黑龙江稻田采集的野慈姑(Sagittaria trifolia Linn.)为研究对象,通过室内生物测定和分子克隆技术,对野慈姑的吡嘧磺隆抗性水平进行检测,并从靶标位点突变的角度解释抗性产生原因。结果表明,采自哈尔滨稻田的2个野慈姑种群N03及N06均为高抗种群,抗性达到4倍剂量以上。经比对2个抗性种群的靶标酶ALS基因发现,Pro197的脯氨酸分别被亮氨酸、丝氨酸取代,该位点的突变可能是野慈姑种群对磺酰脲类除草剂产生抗药性的主要原因。
关键词:野慈姑;除草剂抗性;ALS基因;吡嘧磺隆

水稻是黑龙江省的主要粮食作物。2014年黑龙江省水稻种植面积突破340万hm2,除北部高寒地区外,全省80个市(县)中72个市(县)种植水稻[1]。杂草是影响水稻产量的主要因素之一[2],随着除草剂的大量使用,稻田杂草的种群变化和群落演替加速,原来处于次要防治地位的莎草科及泽泻科杂草成为主要杂草。野慈姑(SagittariatrifoliaL.)别称狭叶慈姑、长瓣慈姑,俗称驴耳菜,为泽泻科多年沼生草本植物。野慈姑喜温暖湿润环境,生长适宜温度为20~25 ℃,既能种子繁殖也可宿生根繁殖[3-4]。通过田间调查和与农民交流获知,野慈姑近年来发生日益严重,己成为黑龙江省寒地稻区主要恶性杂草。
磺酰脲类除草剂苄嘧磺隆和吡嘧磺隆,自20世纪80年代末在我国登记以来,由于其具有活性高、用量低、杀草谱广、对作物安全及毒性低等特点,一直是水田防除阔叶杂草的主推品种[5]。我国东北地区水稻田使用磺酰脲类除草剂已有20多年历史[6]。长期单一品种的除草剂施用极易诱导杂草产生抗药性,造成野慈姑对磺酰脲类除草剂敏感性降低。日本于2014年报道了由于ALS基因突变而对苄嘧磺隆和吡嘧磺隆高抗的野慈姑种群[7]。国内也有相关报道:吴明根等在吉林省延边已发现抗磺酰脲类除草剂苄嘧磺隆生态型慈姑[8];陈丽丽等在黑龙江省庆安县发现ED50比值4.5倍于敏感型的野慈姑[9]。笔者在试验区中也发现对苄嘧磺隆、吡嘧磺隆不敏感的野慈姑生态型。
世界范围内已有大量与ALS抑制剂抗性相关的报道。对于抗性机制的解释主要有2个方面——靶标位点抗性(target-site-resistance,TSR)和非靶标位点抗性(non-target-site-resistance,NTSR)。目前已发现的151种ALS抑制剂抗药性杂草中,经证实与TSR直接相关的ALS基因突变位点共有8个[10-11]。根据拟南芥中ALS氨基酸的位置,8个位点分别为Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653、Gly654。对于NTSR的研究主要集中在解毒和代谢2个方面[12]。
目前野慈姑抗性机制的解释主要为编码靶标酶ALS基因发生突变。本研究以吡嘧磺隆为例,主要目的为探明黑龙江省野慈姑对磺酰脲类除草剂产生抗性的靶标位点的抗性机制。
1材料与方法
1.1供试材料
采自黑龙江省哈尔滨市不同田块的野慈姑种群(SagittariatrifoliaL.)见表1。各种群分别取植株幼嫩部分,冻存于-80 ℃。

表1 慈姑种群采集地点及用药史
1.2试验方法
1.2.1整株生测法选取4~6叶期长势均匀的野慈姑,进行喷雾处理。试验按照表2设计用量处理,每处理重复4次。喷药后放在暗处吸收6 h,然后光暗交替12 h继续培养。
1.2.2野慈姑ALS基因扩增引物的设计与合成根据已发表的野慈姑ALS基因序列(AB301496.1),设计并于生工生物工程(上海)股份有限公司合成正反向2条引物(表3)。
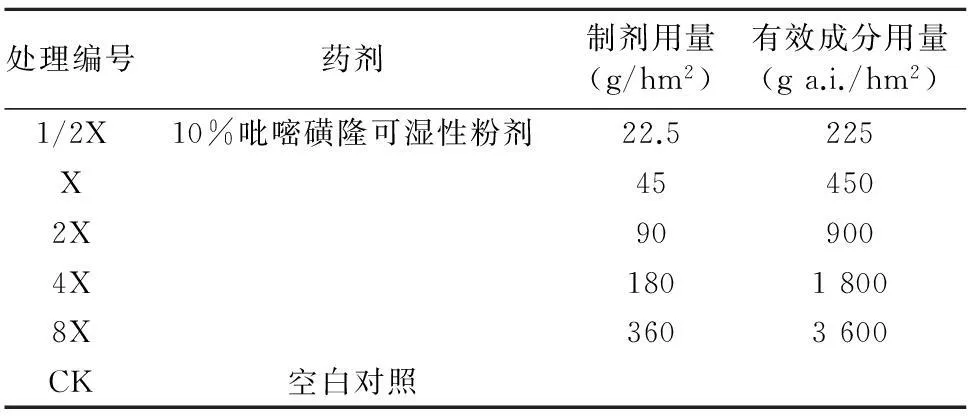
表2 吡嘧磺隆试验用量设计

表3 扩增野慈姑ALS基因的引物
1.2.3野慈姑ALS基因片段的克隆及测序对目的条带切胶回收、纯化后连接到pMD18-T载体,然后转到大肠杆菌感受态细胞中。将菌液均匀涂布于含有Ampicilin和X-gal/IPTG的LB固体培养基上,37 ℃过夜培养。从培养基上挑取15个白色单菌落到含Ampicilin的LB培养液中,以200 r/min的速度在37 ℃摇床内振荡培养5 h,然后以菌液为模板进行转化鉴定。25 μL的菌液PCR组分包括9.5 μL ddH2O、12.5 μL 2×Pfu PCR MasterMix(TIANGEN公司)、1 μL菌液、上下游引物各1 μL(10 μmol/L)。挑选其中至少5个阳性克隆送公司双向测序,引物为通用引物M13。
1.2.4生物学信息分析用DNAMAN V6软件对试验反枝苋种群ALS基因片段的测序结果进行比对,寻找6个突变位点的差异性。
2结果与分析
2.1生物测定结果及分析
施药7 d后,调查吡嘧磺隆对各野慈姑样本地上鲜质量的抑制差异。随吡嘧磺隆剂量的升高,对8个样本的抑制率增强。其中样本N03和N06抗性水平较高,4倍剂量时的生长抑制率低于50%,即对吡嘧磺隆抗性达到4倍剂量以上(表4)。对这2个野慈姑抗性种群和敏感种群进行ALS基因片段的生物信息学分析。
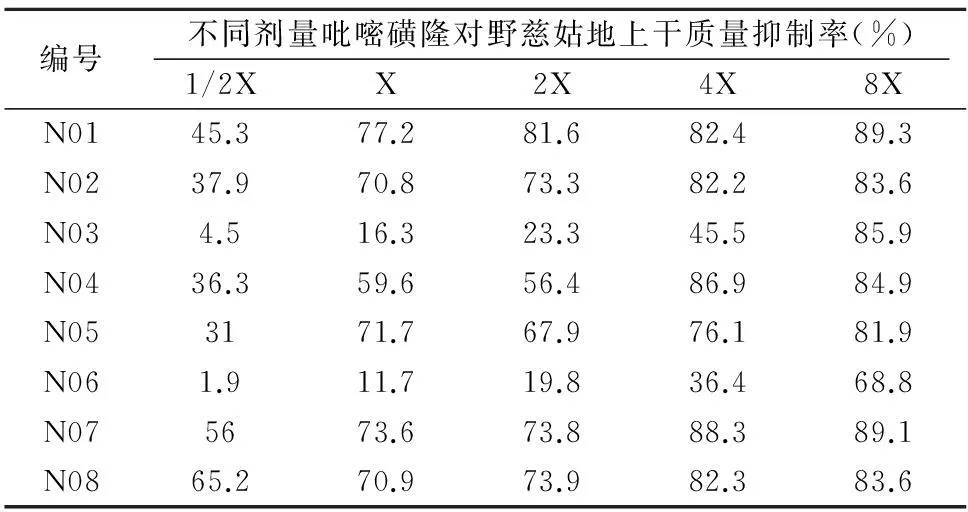
表4 吡嘧磺隆对野慈姑地上干质量的影响
2.2野慈姑基因组DNA的提取及目的片段扩增
3种野慈姑取幼嫩组织在液氮中研磨成细粉,使用快捷型植物基因组DNA提取系统,对基因组DNA进行提取,电泳检测提取成功(图1)。
PCR反应条件为94 ℃预变性5 min;94 ℃变性30 s、59 ℃退火30 s、72 ℃延伸2 min,共进行33 次循环;72 ℃延伸10 min。扩增产物点样于1%琼脂糖凝胶中进行电泳检测,扩增成功(图2)。
2.3野慈姑ALS基因片段的生物信息学分析
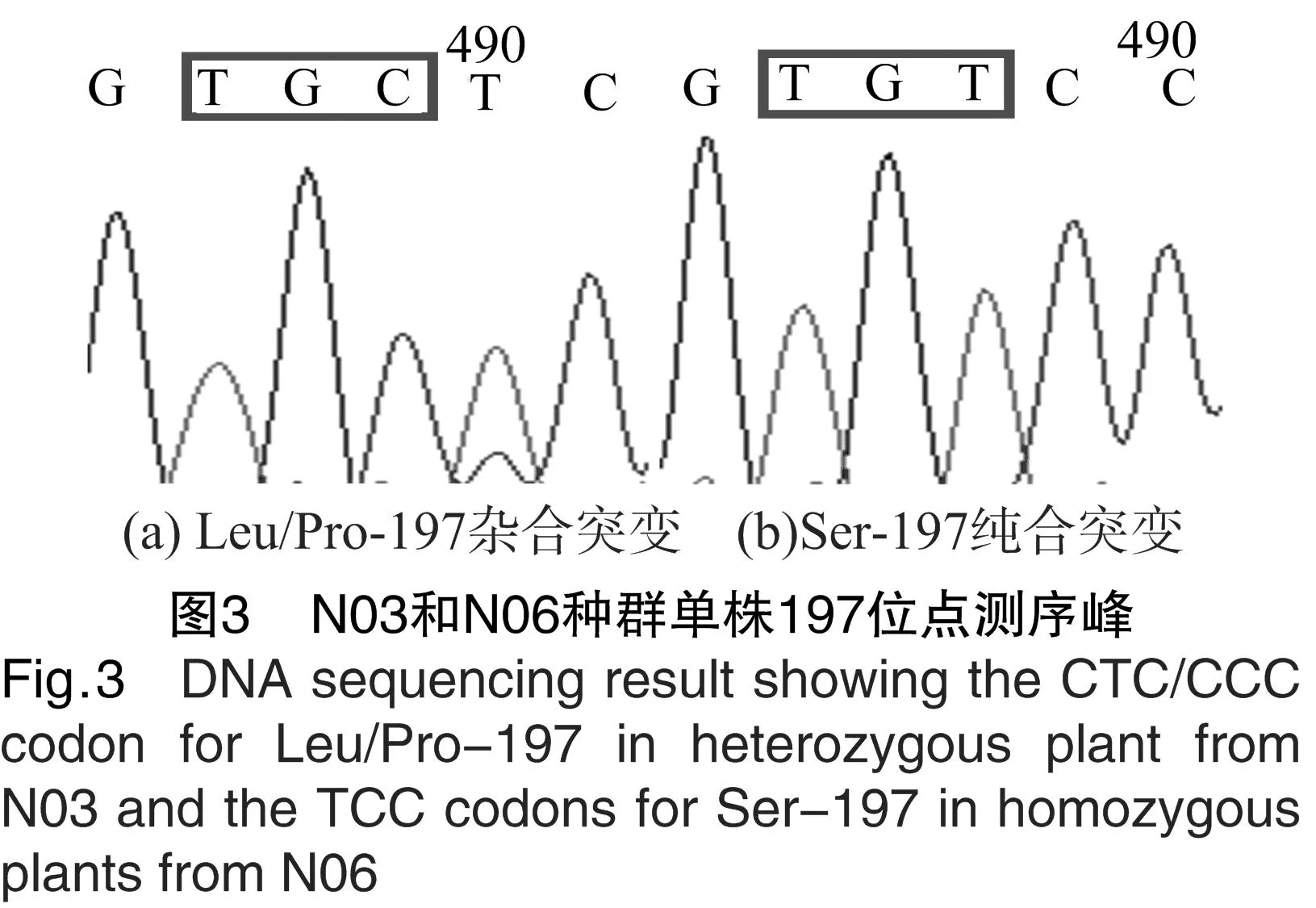
对3个野慈姑种群的ALS测序片段进行比对后发现,抗性种群N03和N06在Pro197位发生了导致不同氨基酸发生取代的突变。其中,N03由CCC突变为CTC,亮氨酸取代了脯氨酸;N06由CCC突变为TCC,丝氨酸取代了脯氨酸(表5)。从测序峰图(图3)上来看,N03种群的单株在编码Ser的第2个碱基处出现了套峰,N06种群的单株无套峰出现。由于野慈姑为二倍体[13],因此峰图表明,N03的197位点突变仅发生在野慈姑的1条染色体上,即N03种群野慈姑单株Pro197Pro/Leu为杂合突变,而N06种群野慈姑单株Pro197Ser为纯合突变。
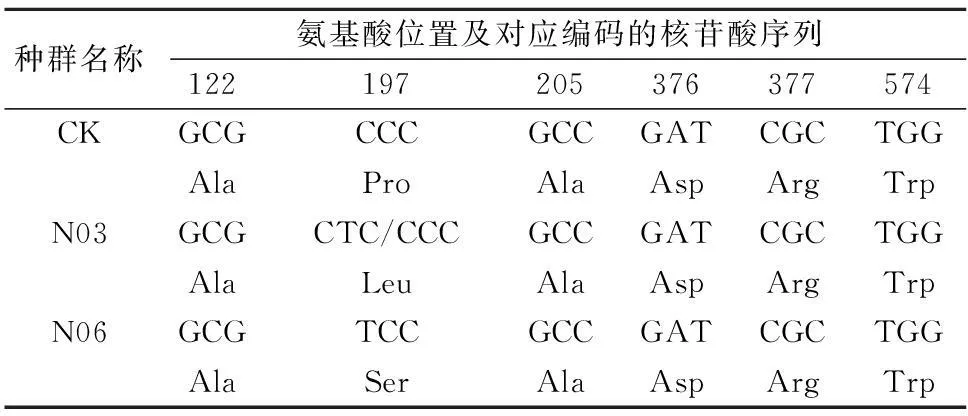
表5 3个野慈姑种群ALS基因片段及编码氨基酸的比较
3讨论与结论
本试验通过整株生物测定法,对采自8个地块野慈姑的抗药性水平进行了检测,发现有2个地块的野慈姑对吡嘧磺隆的敏感性降低,抗性达到4倍剂量以上。对靶标酶ALS的部分基因片段进行扩增、克隆、测序后发现,2个抗性种群——N03、N06靶标酶ALS的高度保守区域Domain A发生了基因突变,197位由CCC分别突变为CTC/CCC、TCC,分别导致脯氨酸被亮氨酸、丝氨酸取代。突变的发生可能是导致野慈姑对磺酰脲类除草剂产生抗性的重要原因之一。
基于靶标位点突变的ALS抑制剂抗性是杂草产生抗性的重要机制,通常是由于ALS的编码基因保守区域发生突变,导致单个氨基酸被取代[14-15],这种取代也可在多个位点同时发生。在过去20年里,全球范围内在50个杂草种群中,共发现8个能够导致抗性产生的突变位点以及26种氨基酸替代方式[16]。目前野慈姑的靶标位点抗性情况已有报道,2014年日本Iwakami等发现了发生CCC/TCC杂合突变的野慈姑种群,本研究发现的2种突变方式尚未报道。
非靶标位点导致的除草剂抗性原理较复杂,可能由除草剂代谢机制的增强或解毒酶(P450解毒酶,GSTs等)活性提高引起[12,17]。本次试验未对非靶标方面机理进行研究,因此不能排除其对抗性产生的贡献,这有待进一步证实。
参考文献:
[1]关昕,安龙哲. 黑龙江省水稻生产概况[J]. 农机使用与维修,2013(1):10-12.
[2]Florez J A,Fischer A J,Ramirez H,et al. Predicting rice yield losses caused by multispecies weed competition[J]. Agronomy Journal,1999,91(1):87-92.
[3]王枝荣. 中国农田杂草原色图谱[M]. 北京:农业出版社,1990:357.
[4]余柳青,韩逢春,玄松南,等. 东北水稻生产与杂草防除[J]. 杂草科学,2009(4):7-10.
[5]李茹,罗小娟,董立尧,等. 鳢肠种群对除草剂的敏感性[J]. 江苏农业学报,2013,29(6):1514-1516.
[6]吴明根,郑承志,李昕珈. 抗苄嘧磺隆慈姑ALS基因突变位点[J]. 江苏农业学报,2010,26(1):222-224.
[7]Iwakami S,Watanabe H,Miura T,et al. Occurrence of sulfonylurea resistance inSagittariatrifolia,a basal monocot species,based on target-site and non-target-site resistance[J]. Weed Biology and Management,2014,14(1):43-49.
[8]吴明根,吴松权,朴仁哲,等. 磺酰脲类除草剂对抗、感性慈姑ALS活性的影响[J]. 农药,2007,46(10):701-703.
[9]陈丽丽,何付丽,范丹丹,等. 黑龙江省野慈姑对吡嘧磺隆的敏感性测定[J]. 植物保护,2013,39(6):120-123.
[10]Beckie H J,Tardif F J. Herbicide cross resistance in weeds[J]. Crop Protection,2012,35:15-28.
[11]Powles S B,Yu Q. Evolution in action:plants resistant to herbicides[J]. Annual Review of Plant Biology,2010,61:317-347.
[12]Yu Q,Powles S. Metabolism-based herbicide resistance and cross-resistance in crop weeds:A threat to herbicide sustainability and global crop production[J]. Plant physiology,2014,166(3):1106-1118.
[13]李林初. 泽泻和慈姑核型的比较研究[J]. 植物科学学报,1985,3(4):397-402.
[14]Rajguru S N,Burgos N R,Shivrain V K,et al. Mutations in the red rice ALS gene associated with resistance to imazethapyr[J]. Weed science,2005,53(5):567-577.
[15]Shaner D L. Resistance to acetolactate synthase (ALS) inhibitors in the United States:history,occurrence,detection,and management[J]. Weed Research,1999,44(4):405-411.
[16]Yu Q,Powles S B. Resistance to AHAS inhibitor herbicides:current understanding[J]. Pest Management Science,2014,70(9):1340-1350.
[17]Vila-Aiub M M,Neve P,Powles S B. Resistance cost of a cytochrome P450 herbicide metabolism mechanism but not an ACCase target site mutation in a multiple resistantLoliumrigidumpopulation[J]. New Phytologist,2005,167(3):787-796.
邹红梅,李香菊,崔海兰,等. 菵草对3种ACCase抑制剂抗性的琼脂快速检测方法建立[J]. 杂草科学,2015,33(3):24-28.
Molecular Resistance Mechanism ofSagittariatrifoliaL.
to Pyrazosulfuron-methyl
LIU Yan1, LIU Hua-zhao2, GAO Zeng-gui3
(1. Plant Protection Research Institute,Heilongiiang Academy of Land Reclamation Sciences,Harbin 150038,China;
2. Rice Research Institute,Heilongiiang Academy of Land Reclamation Sciences,Harbin 150038,China;
3. Institute of Plant Immunity,Shenyang Agricultural University,Shenyang 110866,China)
Abstract:Sagittaria trifolia L. is one of the most serious weeds in paddy fields in China. In this study,two S. trifolia populations collected from Heilongjiang Province were found highly resistant (resistance indexes above 4.0) to pyrazosulfuron-methyl in dose-response curves. The resistance mechanism was elucidated through amplifycation and cloning sections of the ALS gene. Different mutations were found in Pro197 in the two resistant populations. In one of the populations (N03),CCC was changed to CTC/CCC at 197,leading to the substitution of Pro by Leu/Pro. Population N06 possessed a TCC to CCC mutation,resulting in a Ser-197-Pro substitution. These mutations may be responsible for the resistance mechanism.
Key words:Sagittaria trifolia L.;herbicide resistance;ALS gene;pyrazosulfuron-methyl
作者简介:刘延(1978—),女,博士,副研究员,主要研究方向为杂草抗药性与农田杂草防控。E-mail:liuyanzb1226@163.com。
基金项目:国家公益性行业(农业)科研专项(编号:201203098);黑龙江省农垦科学院2011年院长基金。
收稿日期:2015-03-20
中图分类号:S451.21
文献标志码:A
文章编号:1003-935X(2015)03-0020-04

