缺血性损伤致薄型子宫内膜动物模型的建立▲
李 楠 陈 梅 李小宁 孙 康
(陕西中医药大学附属医院妇科,咸阳市 712000,E-mail:linan_80_311@163.com)
论著·基础研究
缺血性损伤致薄型子宫内膜动物模型的建立▲
李 楠 陈 梅 李小宁 孙 康
(陕西中医药大学附属医院妇科,咸阳市 712000,E-mail:linan_80_311@163.com)
目的 利用缺血性损伤建立薄型子宫内膜的动物模型。方法 将30只SD大鼠分为对照组、模型1组和模型2组各10只。模型1组和2组分别阻断双侧卵巢动脉20 min和30 min,随后恢复血流,对照组不阻断卵巢动脉。5 d后观察各组大鼠子宫内膜组织病理学变化、微血管密度表达、单位内膜面积中波形蛋白及角蛋白的面积。结果 与对照组比较,模型1组和2组子宫内膜萎缩变薄(P<0.05),内膜腺体数量减少、排列稀疏且发育迟缓,微血管密度表达较低(P<0.05)、角蛋白及波形蛋白的面积减少(P<0.05)。但模型组间以上指标比较,差异无统计学意义(P>0.05)。结论 通过阻断卵巢动脉20 min即可建立“缺血性损伤”薄型子宫内膜动物模型,该方法重复性好,更符合建立简便、快速、最接近人体病理状态动物模型的需求。
薄型子宫内膜;缺血性损伤;动物模型;卵巢动脉;大鼠
适合厚度的子宫内膜能为胚泡植入提供黏附的场所和营养来源,是良好妊娠结局的保证。过薄的子宫内膜可导致胚胎种植率明显降低。近年来我们发现薄型子宫内膜已经成为部分体外受精及胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)患者取消周期、种植失败的原因,也是部分潜在不孕症患者的症状之一。因此,如何有效地改善薄型子宫内膜的功能已经成为妇科内分泌领域面临的一个问题。目前对薄型子宫内膜确切的发生机制尚不清楚,也无合适的动物模型用于这种疾病的研究。国外研究发现,薄型子宫内膜常表现为内膜腺上皮增生差、血管生长不良及再生减少等一系列病理学特征[1]。临床中我们曾尝试使用增加子宫内膜血流的药物治疗薄型子宫内膜患者,发现其能够增加部分患者的内膜厚度,因此,推测薄型子宫内膜的发生可能与子宫内膜缺血有关。本实验旨在通过阻断子宫血供构建子宫内膜缺血动物模型,同时观察模型后子宫内膜病理学变化,以此评价该模型作为薄型子宫内膜动物模型的科学性、可行性和实用性。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康雌性6~8周龄SD大鼠,体重180~200 g,由西安交通大学医学院实验动物中心提供,合格证号:SCXK(陕)2012-003。1.1.2 主要试剂和仪器:苏木素-伊红(hematoxylin and eosin,HE)染色液购自碧云天生物技术研究所;4%多聚甲醛、1% HCl-75%乙醇、碱液、80%乙醇、95%乙醇、无水乙醇、二甲苯、丙三醇、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、抗原修复液(柠檬酸三钠缓冲液)、4%多聚甲醛、3% H2O2/PBS、0.01%聚乙二醇辛基苯基醚(Triton-X)、10% 胎牛血清(fetal bovine serum,FBS)、湿盒购自中国国药集团;鼠抗CD34单克隆抗体、鼠抗波形蛋白单克隆抗体、鼠抗单克隆角蛋白抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、辣根过氧化物酶(horseradish peroxidase,HRP)购自BioWorld公司。冷冻切片机(Leica公司,型号CM3050S),倒置显微镜(Leica公司,型号IX71)。注射用青霉素G钠粉针购自哈药集团制药厂,批号H23021439。
1.2 方法
1.2.1 实验分组及模型建立:将30只SD大鼠,适应性喂养1周后,按照随机数字表法分为对照组、模型1组和模型2组各10只。参照颜耀华等[2]的建模方法,运用10%水合氯醛按0.3 ml/100 g的剂量腹腔注射以麻醉大鼠,腹部常规消毒后,打开腹腔,暴露子宫,对照组在开腹探查后暴露20 min,随后腹腔内洒少量青霉素G钠针粉,0号丝线逐层关闭腹腔。模型1组,用微动脉夹阻断双侧卵巢动脉血供20 min,模型2组阻断双侧卵巢动脉血供30 min,随后均恢复血流,逐层关腹。术后普通饲料喂养,5 d后处死大鼠。
1.2.2 HE染色观察各组大鼠子宫内膜组织学变化特点:将大鼠断颈处死,75%乙醇中浸泡消毒5~10 min。无菌条件下,小心剖取大鼠子宫,-20℃保存。将大鼠子宫包裹于包埋剂后,于冷冻切片机上进行冷冻切片,设置切片厚度为5 μm。选取平整的切片进行HE染色。将切片于4%多聚甲醛中固定10~30 s,水洗。染苏木素3~5 min,水洗。1% HCl-75%乙醇分化5~10 s,水洗。用碱水促蓝20 s,水洗。伊红染色30~60 s,水洗。80%乙醇洗3~5 s,95%乙醇洗3~5 s,无水乙醇洗3~5 s,丙三醇封片。倒置显微镜下观察。子宫内膜厚度采用Leica Qwin Plus图像处理软件对HE染色后的切片进行测量。
1.2.3 免疫组化法检测大鼠子宫内膜微血管密度(microvessel density,MVD):获得的子宫组织经PBS漂洗3次后,4%多聚甲醛固定10 min。3% H2O2/PBS室温孵育10 min,PBS漂洗5 min/次×3次。将切片浸入抗原修复液中,96℃ 5 min。用1 ml移液器在切片表面加2 ml PBS洗涤,5 min/次×3次。10% FBS封闭,室温15 min。加入CD34抗体,4℃孵育过夜。洗片:用1 ml移液枪在切片表面加2 ml PBS洗涤,5 min/次×3次。加入二抗羊抗鼠IgG-FITC、羊抗鼠HRP至切片上,每片1滴。37℃孵育30 min。PBS漂洗,5 min/次×3次。封片,荧光显微镜下观察。用Image-Pro Plus 6.0图像分析系统对图片进行分析。
1.2.4 免疫组化法检测大鼠子宫内膜角蛋白、波形蛋白表达:获得的子宫组织经PBS漂洗3次后,4%多聚甲醛固定10 min。3% H2O2/PBS室温孵育10 min,PBS漂洗5 min/次×3次。将切片浸入抗原修复液中,96℃ 5 min。用1 ml移液器在切片表面加2 ml PBS洗涤,5 min×3。10%FBS封闭,室温15 min。加入波形蛋白、角蛋白抗体,4℃孵育过夜。洗片:用1 ml移液枪在切片表面加2 ml PBS洗涤,5 min/次×3次。加入二抗羊抗鼠HRP至切片上,每片1滴。37℃孵育30 min。PBS漂洗,5 min/次×3次。封片,荧光显微镜下观察。用Image-Pro Plus 6.0图像分析系统对图片进行分析。
1.3 统计学分析 采用SPSS 17.0软件进行统计分析。计量资料以(x±s)表示,多组均数比较用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠子宫内膜组织学变化特点 与对照组比较,各模型组子宫内膜萎缩变薄(P<0.05),腺体数量减少、排列稀疏发育迟缓,腺上皮细胞完整,呈单层立方上皮,间质致密、细胞变少、变小;但模型组间子宫内膜厚度比较,差异无统计学意义(P>0.05)。见表1及图1。

表1 对照组与模型组大鼠 子宫内膜厚度、MVD比较(x±s)
注:与对照组比较,*P<0.05。

对照组 模型组1 模型组2
图1 3组子宫内膜组织学变化情况(HE染色,×100)
2.2 各组大鼠子宫内膜MVD比较 对照组子宫内膜组织中微血管丰富,MVD明显高于各模型组(P<0.05)。模型组之间MVD表达比较,差异无统计学意义(P>0.05)。见表1及图2。

对照组 模型组1 模型组2
图2 3组子宫内膜组织MVD(免疫组化染色,×100)
2.3 各组大鼠子宫内膜波形蛋白及角蛋白表达 (1)角蛋白表达于子宫内膜腺上皮细胞的胞浆中,以此评估上皮生长情况。对照组单位内膜面积中细胞角蛋白的面积均大于各模型组(P<0.05),而模型组间比较,差异无统计学意义(P>0.05),见表2及图3。(2)波形蛋白主要表达于间质细胞和少量内皮细胞的胞浆中,以此评估间质中细胞生长情况。各模型组子宫内膜单位面积内波形蛋白的面积均低于对照组(P<0.05),而模型组之间相比较,差异无统计学意义(P>0.05),见表2及图4。

表2 对照组和模型组子宫内膜 角蛋白及波形蛋白面积比较(x±s,%)
注:与对照组比较,*P<0.05。
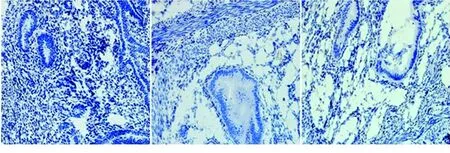
对照组 模型组1 模型组2
图3 3组子宫内膜组织角蛋白表达情况(免疫组化染色,×200)

对照组 模型组1 模型组2
图4 3组子宫内膜组织波形蛋白表达情况(免疫组化染色,×200)
3 讨 论
子宫内膜厚度与妊娠结局密切相关,适宜的子宫内膜厚度(8~14 mm)是胚胎植入的必要条件[3],也是决定生育的重要因素[4]。随着辅助生殖技术的发展,薄型子宫内膜已经成为临床医生面临的又一挑战。由于其病因复杂,涉及多种因素,确切机制尚不清楚,近年来有关薄型子宫内膜的研究重点集中在试图增加内膜厚度的治疗方法及药物,治疗方案从药物刺激子宫内膜增生、改善内膜血流到子宫内膜搔刮术、宫腔局部注射粒细胞集落刺激因子、生物电刺激等[5-9],而基础研究并未得到同步发展,目前尚无合适的动物模型用于这种疾病研究。因此建立简便、快速的实验动物模型对于薄型子宫内膜的机制研究具有重要意义。
相关组织病理学和分子生物学检测已经证实了薄型子宫内膜存在血管发育不良、再生减少的现象[1],因此子宫内膜慢性缺血是必然结局。国外学者已肯定了子宫内膜慢性缺血及薄型子宫内膜间存在关联[1,10]。随后国内实验室通过结扎SD雌性大鼠双侧子宫动脉,造成子宫内膜慢性缺血状态,观察子宫内膜组织病理学特征,发现大鼠子宫内膜变薄、腺体减少、血管发育不良及腺上皮细胞受损[4,11]。这些病理特征与临床上薄型子宫内膜的病理改变基本一致,再一次通过动物实验证实了子宫内膜慢性缺血与薄型子宫内膜之间的联系。但此研究方法存在一定的弊端:模型建造周期长,历时3个月之久,可操作性不强;其次,由于大鼠子宫动脉纤细、分支多的生理特点,结扎的程度较难掌握,对手术技术要求高。因此该方法难于被广泛应用。
由于子宫动脉是卵巢动脉的一个分支,阻断卵巢动脉可有效减少子宫动脉的血液供应,使子宫内膜处于低流量灌注的状态。因此本研究借鉴子宫动脉结扎法的部分机制,以缺血再灌注后的低灌流现象为基础,采用短时阻断卵巢动脉的方法,建立子宫内膜缺血模型。为确定阻断子宫血流供应的最佳时间,我们参考相关文献报告[2],分别对卵巢动脉阻断了20 min和30 min。观察1个动情周期后子宫内膜组织学变化、MVD及相关蛋白表达的变化。结果显示,阻断卵巢动脉20 min和30 min后均能够达到使子宫内膜变薄的目的,且与对照组比较,在子宫内膜血供不足的情况下,MVD也同步降低,角蛋白和波形蛋白面积减小(P<0.05),提示血管形成不良,上皮细胞和间质细胞的再生长受限。这些变化与临床上薄型子宫内膜的病理改变相似。本研究结果亦显示,模型1组与模型2组的子宫内膜厚度、MVD、子宫内膜角蛋白面积及波形蛋白面积比较,差异均无统计学意义(P>0.05),提示阻断20 min的子宫内膜变化与30 min比较并无差异。相比之下,阻断20 min不仅能建立薄型子宫内膜动物模型,而且手术时间短,所需麻醉药量少,对动物干扰相对较少,且术后苏醒快,更符合简便、快速、最接近人体病理状态的薄型子宫内膜实验动物模型的需求。
综上所述,通过阻断卵巢动脉20 min即能建立“缺血性损伤”薄型子宫内膜动物模型,该方法重复性好且简便。
[1] Miwa I,Tamura H,Takasaki A,et al.Pathophysiologic features of "thin" endometrium[J].Fertil Steril,2009,91(4):998-1 004.
[2] 颜耀华,李 力,俞丽丽,等.阻断子宫动脉建立FGR大鼠模型的研究[J].中国实验动物学报研究,2007,15(1):43-46.
[3] Strowitzki T,Germeyer A,Popovici R,et al.The human endometrium as a fertility-determining factor [J].Hum Reprod Update,2006,12(5):617-630.
[4] Momeni M,Rahbar MH,Kovanci E A meta-analysis of the relationship between endometrial thickness and outcome in vitro fertilization cycles[J].J Hum Reprod Sci,2011,4(3):130-137.
[5] Shen MS,Wang CW,Chen CH,et al.New horizon on successful management for a women with repeated implantation failure due to unresponsive thin endomentium:use of extended estrogen supplementation[J].J Obstet Gynaecol Res,2013,39(5):1 092-1 094.
[6] Dehghani Firouzabadi R,Davar R,Hojjat F,et al.Effect of sildenafil citrate on endometrial preparation and outcome of frozen-thawed embryo transfer cycles:a randomized clinical trial[J].Iran J Reprod Med,2013,1(2):151-158.
[7] 王 瑶,冯 云,牛志宏,等.子宫内膜轻创对着床相关因子及 IVF 妊娠结局影响的研究[J].生殖与避孕,2007,27(7):454-462.
[8] Gleicher N,Vidli A,Barad DH.Successful treatment of unresponsive thin endometrium[J].Fertil steril,2011,95(6):2123.e13-17.
[9] Bodombossou-Djobo MM,Zheng C,Chen S,et al.Neuromuscular electrical stimulation and biofeedback therapy thin endometrium during froze-thawed embryo transfer:a preliminary report[J].Reprod Biol Endocrinol,2011,9:122.
[10]Takasaki A,Tamura H,Miwa I,et al.Endometrial growth and uterine blood flow:a pilot study for improving endometrial thickness in the patients with a thin endometrium[J].Fertil Steril,2009.93(6):1 851-1 858.
[11]胡建国.端粒酶和c-kit在大鼠慢性子宫内膜缺血性损伤中表达的研究[D].重庆:重庆医科大学,2011.
Animal modeling of thin endometrium caused by ischemic injury
LINan,CHENMei,LIXiao-ning,SUNKang
(DepartmentofGynaecolog,AffiliatedHospitalofShaanxiUniversityofChineseMedicine,Xianyang712000,China)
Objective To establish the animal model of thin endometrium based on ischemic injury.Methods Thirty SD rats were divided into control group,model Ⅰ group and model Ⅱ group,with 10 rats in each group.The bilateral arteriae ovarica occlusion was performed in the model Ⅰ group and model Ⅱ group for 20 and 30 minutes respectively,and then the blood flow reperfused.The arteriae ovarica occlusion was not performed in the control group.After 5 days,the pathological changes of endometrial tissues,expression of endometrial microvessel density(MVD),areas of vimentin and keratin in unit endometrial areas were observed in three groups.Results Compared to control group,model Ⅰ group and model Ⅱ group had thinner endometrial thickness(P<0.05),less endometrial glands which appeared sparse arrangement and developmental delay,lower expression of MVD,and less areas of vimentin and keratin(P<0.05).There were no significant differences in the indices mentioned above between two model groups(P>0.05).Conclusion The ischemic injury-induced animal model of thin endometrium can be established by a 20-minute arteriae ovarica occlusion.This model has good repeatability,and accorded with the requirement of establishing an animal model simply and rapidly which is more similar to human pathological state.
Thin endometrium,Ischemic injury,Animal model,Arteriae ovarica,Rat
陕西省科技厅自然科学基础研究项目(2013JQ4010)
李楠(1980~),女,博士,副主任医师,研究方向:中医药治疗女性生殖内分泌。
R 711.74
A
0253-4304(2016)01-0010-04
10.11675/j.issn.0253-4304.2016.01.03
2015-10-27
2016-01-02)
——MIYOTA薄型GL/N/M系列机心

