荣昌猪电子耳蜗植入方法建立及听功能初步观察
陈伟刘日渊张亮冀飞郭维维任丽丽李佳楠袁硕龙张悦陈磊杨仕明*中国人民解放军总医院,耳鼻咽喉头颈外科(北京0085)2中国人民解放军空军总医院,耳鼻咽喉头颈外科(北京0006)重庆市畜牧科学院(重庆402460)
荣昌猪电子耳蜗植入方法建立及听功能初步观察
陈伟1,2刘日渊1张亮3冀飞1郭维维1任丽丽1李佳楠1袁硕龙1张悦1陈磊3杨仕明*1
1中国人民解放军总医院,耳鼻咽喉头颈外科(北京100853)
2中国人民解放军空军总医院,耳鼻咽喉头颈外科(北京100036)
3重庆市畜牧科学院(重庆402460)
【摘要】目的建立在大型哺乳动物-猪体内植入电子耳蜗的方法,观察电子耳蜗植入前后听功能变化。方法荣昌猪6只,雌雄不限,40-45日龄,体重8~12Kg,均选自重庆畜牧科学院养猪研究所。分为听力正常组(Mitf+/+),与突变耳聋组(Mitf -/-),每组3只。在全麻下进行电子耳蜗植入术。于手术前,手术后即刻以及手术后1周记录听性脑干反应(Auditory Brainstem Response,ABR),和电刺激脑干诱发电位(Electrical Auditory Brainstem Response,EABR);头颅X片观察电极植入位置。结果6只动物电子耳蜗植入手术成功,耳蜗电极位置正确,在耳蜗内盘绕1.5~1.75圈。电子耳蜗植入即刻,手术侧(右耳)各频率ABR阈值在120 dB SPL无法引出;手术后7天,手术侧(右耳),低频ABR阈值在100dB SPL左右,高频在120 dB SPL仍无法引出。听力正常荣昌猪组(Mitf+/+),电子耳蜗植入手术即刻及一周后EABR阈值在90 CL左右,明显低于突变耳聋荣昌猪组(Mitf -/-)的190 CL。结论本研究建立的荣昌猪电子耳蜗植入方法确实可行,通过植入电极进行EABR测试方法设计合理。为更加直接地研究电子耳蜗植入设备在体内的工作状态和各项数据,研究电极植入后耳蜗的生理病理改变创造了条件。
【关键词】耳蜗植入;荣昌猪;ABR;EABR
Financial funds:This work was supported by grants from the National Basic Research Program of China (973 Program) (# 2012CB967900;2011CBA01000),the National Natural Science Foundation of China (NSFC #81271082).Special Cultivating and Developing Program of Beijing Science and Technology Innovation Base.Competing Interests:The authors have declared that no competing interests exist.
据国内相关统计,目前我国听力言语残疾者达2800万之多,并仍以每年3万聋儿的速度在增长。其中,感音神经性耳聋占绝大多数,目前最佳的治疗手段为电子耳蜗植入。自1984年美国FDA正式批准多导电子耳蜗在成人应用至今,全世界已有30万聋人通过植入电子耳蜗而重新获得听力。这其中包括10万先天性耳聋的儿童,他们得益于此技术而回到有声世界,并开启了与正常儿童同样精彩的人生。但是,电子耳蜗并不能解决所有耳聋患者的苦恼,如感染造成的双侧耳聋,常因耳蜗骨化、纤维化造成电极插入困难;听神经病患者,其电子耳蜗植入后的效果难以预料。与此同时,植入电子耳蜗的耳聋患者,也还有众多疑问不能解答。如植入电极位置与残余听力保存间的关系;言语识别能力与植入电极的位置、长度、通道数量的关系仍不清楚。这都需要大量的实验研究,来获得宝贵的数据,不断改进和更新电子耳蜗的植入电极及相应装置;也需要将新设计的电子耳蜗电极、植入体等,在动物模型上进行有效性、安全性的评价和调试。
但目前用来进行电子耳蜗植入研究的动物模型都是小动物模型,包括猫、豚鼠、大鼠等。这些小动物的内耳解剖、发育和体积与人类相差甚远(1)。研究时使用的植入体和电极,包括新型植入电极均需进行特殊改制,才能植入到这些小动物的耳蜗内。由此产生的实验数据不能完全反映应用于临床的植入电极的真实情况,而且还需要额外耗费资金和技术力量投入。因此,开发并建立大型哺乳动物的电子耳蜗植入实验平台迫在眉睫。
本研究在课题组前期对荣昌猪、小型猪的中耳、内耳解剖结构的大量研究及听觉功能数据库建立的基础上。建立了规范的电子耳蜗植入手术流程,并对电子耳蜗植入前后的听功能变化进行了观察和初步总结。
1 材料与方法
1.1动物及分组
荣昌猪由重庆畜牧科学院提供,分为听力正常荣昌猪组(Mitf+/+),与突变耳聋荣昌猪组(Mitf -/-),各3只,雌雄不限。40-45日龄,体重8~12Kg。提取猪耳廓组织,经PCR和凝胶电泳进一步确定猪的基因类型无误。
1.2电子耳蜗的选择和相关数据
使用的是国产诺尔康的Nurotron CS-10A型电子耳蜗。包括放入体内的植入体(图1.)和体外的言语处理器以及电池盒(图2.)。

图1 Nurotron CS-10A型电子耳蜗植入体Figure 1 Nurotron CS-10A-cochlear implants
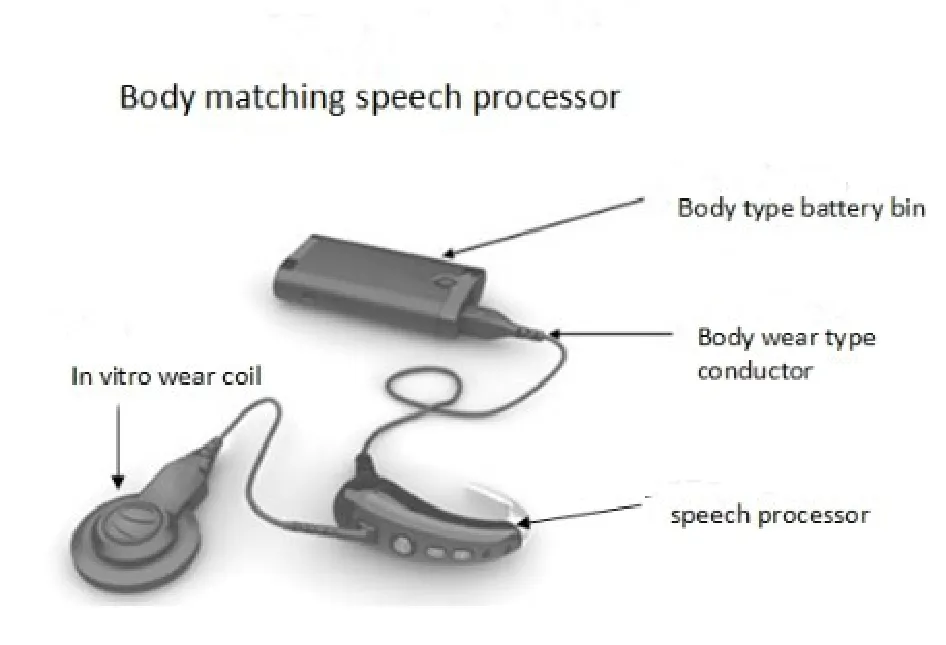
图2 Nurotron CS-10A型电子耳蜗体外机Figure 2 Nurotron CS-10Aelectronic cochlea in vitro
为了设计体内植入体的固定及放置位置,以及体外机(包括体外线圈、言语处理器和电池盒)的固定、放置位置。我们测量了Nurotron CS-10A型电子耳蜗各部件的相关大小,具体数据如表1.所示。
1.3麻醉
手术前禁食12小时,手术当天禁水。速眠新Ⅱ(1.5 mL/支,吉林某兽药研发中心生产,批号0005013),以0.5ml对动物进行颈后肌肉注射行麻醉诱导,10分钟后连接呼吸机吸入异氟烷0.2ml/分钟行全身麻醉。

表1 Nurotron CS–10A型电子耳蜗各部件测量值Table 1 The data of Components of Nurotron CS-10A
1.4手术步骤
所有动物都选择右耳为电子耳蜗植入侧。
①体位摆放:荣昌猪右侧卧位,右耳朝上,左耳后海绵垫垫衬固定。
②消毒、铺单:碘伏消毒右侧耳周及颅顶部,常规铺无菌单(图3.)。
③右耳后切口:右侧耳后,沿耳廓附着缘切口,长约5cm,上自耳廓上端,下至下颌角。切开皮肤、皮下组织,显露颌下腺,颈部肌群。沿腺体与肌肉间分离,直至乳突骨面。切断部分肌腱,分离显露外耳道后壁骨面。紧贴颌下腺,在外耳道后壁用电钻磨开一个3*3mm的骨窗。可见外耳道后壁的软组织,推开后,显露出鼓膜以及面神经,鼓索神经,磨除部分外耳道后上壁骨质,显露出砧骨及镫骨头。
④显露耳蜗圆窗:磨除部分面神经表面骨质,游离面神经并向下移位。即可显露圆窗。
⑤磨制电子耳蜗植入体骨槽:用明胶海绵暂时封闭外耳道后壁骨窗。延长耳后切口上端至颅顶部,切开皮肤、皮下组织、肌肉层,直至颅骨骨面。游离颅顶部软组织,直至植入体模型置入良好。磨除头颅顶骨与枕骨及颞骨交界处部分骨质,显露出硬脑膜,但注意不能损伤硬脑膜。
⑥植入体置入、固定:将Nurotron CS-10A型电子耳蜗植入体放入磨好的颅顶部骨槽内。尼龙线缝合固定。
⑦电子耳蜗电极植入:划开圆窗膜,将电极用专用电极钳夹持好,通过圆窗缓慢插入耳蜗鼓阶。(图4)
⑧缝合固定体外机:将体外机线圈与植入体的线圈磁铁对应好,缝合固定于头皮。并将电池盒与言语处理器放入专用保护背心内固定于动物背部。
⑨切口:逐层缝合切口,手术结束。

图3 荣昌猪电子耳蜗植入手术体位Figure 3 The position of Rongchang pig cochlear implant

图4 耳蜗电极通过耳蜗圆窗路径插入鼓阶Figure 4 The cochlea electrode through the round window implant into the scala tympani
1.5听性脑干反应(auditorybrainstemresponse ABR)
动物麻醉后,37℃保温板保温。记录电极插入颅顶正中,参考电极插入双耳廓软组织内,地极插入鼻尖。在隔声屏蔽室内以短声(Click)及短纯音(tone burst,4kHz,8kHz,16kHz,20kHz)作为刺激音。以能分辨出可重复的ABR波形的最低刺激强度确定阈值[2]。
1.6电刺激脑干诱发电位(Electrical Auditory Brain⁃stem Response,EABR)
通过Nurotron耳蜗公司提供的EABR测试软件,连接体内机。调试成功后(各电极阻抗通过检测),选择2#,6#,10#,16#,22#电极分别记录EABR。刺激强度由200CL开始,每次下降10CL,直至无法引出可以重复的EABR波形,然后以5CL幅度提高刺激强度,以能分辨出可重复的EABR波形的最低刺激强度确定阈值,并重复三次,取其平均值做为阈值。
2 结果
2.1术后动物整体状况观察
6只动物电子耳蜗植入手术顺利,手术时间120分钟左右,术后30分钟左右动物苏醒。术后无站立及行走不稳,术后进食正常,恢复良好。切口愈合良好,无感染、无皮肤破损,植入体无移位,无外露。颅顶部保护罩及防护外衣固定良好。(图5B、C)
2.2电子耳蜗植入术后影像学
术后3天行头颅X片照射检查,显示耳蜗植入体位于颅顶部,耳蜗电极插入位置正确,在耳蜗内盘绕1.5~1.75圈。(图5A)

图5 A.电子耳蜗植入术后,X片显示电极植入位置正确,位于猪耳蜗第一、二转的鼓阶内;B.颅顶保护罩与防护外衣组合;C.颅顶线圈固定方法及保护罩佩戴方法。Figure 5 A.After surgery,X-ray showed that the electrode is inserted correctly,which located within the pig cochlea first to second turn of scala tympani.B.Combination of vertex protective cover and protective coat.C.Vertex coil fixed method and protective casing wear method
2.3听功能检测
ABR阈值测试:听力正常荣昌猪组(Mitf+/+)动物在手术前的ABR阈值在各频率相差不大,平均在45~50 dB SPL。电子耳蜗植入手术即刻,手术侧(右耳)各频率ABR阈值在120 dB SPL无法引出,对侧耳(左耳)各频率ABR阈值稍有升高,平均在65 dB SPL,但个体差异较大。手术后7天,手术侧(右耳),低频ABR阈值部分可以引出,阈值在100dB SPL左右,高频在120 dB SPL仍无法引出;对侧耳(左耳)各频率ABR阈值基本恢复至手术前水平(表2.)。
EABR阈值测试:听力正常荣昌猪组(Mitf+/+)动物,电子耳蜗植入手术即刻,不同电极(2#,6#,10#,16#,22#)刺激所得EABR阈值中,22#电极的阈值较高,在140 CL,其余电极在90 CL左右;植入手术后一周,各个电极刺激所得EABR阈值无明显变化。突变耳聋荣昌猪组(Mitf -/-)动物,电子耳蜗植入手术即刻,不同电极(2#,6#,10#,16#,22#)刺激所得EABR阈值较高,在190 CL左右;植入手术后一周,各个电极刺激所得EABR阈值无明显变化(表3.)。
3 讨论
既往对各物种耳蜗鼓阶长度测量研究显示,小鼠为4.55mm,大鼠为7.24mm,沙鼠为9.20mm,与人类的28.46mm相差甚远[3]。课题组前期研究显示猪耳蜗与人更为接近,长度为39.47mm,转数为3圈半,较人类耳蜗多出一圈[4,5]。本研究显示猪耳蜗完全可以容纳临床实际应用的电子耳蜗电极,无需额外改造电极,可以完全再现耳蜗电极在体内工作时的各种参数,得到宝贵的一手数据。本研究中所有动物的电极都可以完全植入到耳蜗内,为进一步研究各个电极刺激、输出以及联合刺激模式提供了条件。
以往有文献报道[6]电子耳蜗电极植入对残余听力的损伤一般是中、高频区受损严重,低频区受损相对较轻。本研究中,在听力正常动物实行电子耳蜗植入即刻,ABR测试结果显示,低、中、高频都受损严重。这可能是由于:
①猪的耳蜗为3圈半,在同等的电极长度下,电极插入猪耳蜗时较人要多一次大角度的转弯,并且电极前端到达的区域,猪耳蜗鼓阶的高度较人类更狭小,会导致耳蜗更大的损伤;②电极植入时扰动了内、外淋巴液动力学平衡,带来的机械振动类似于强噪声的损伤,而猪对噪声损伤可能较人类更为敏感。这与前期研究中发现猪耳蜗顶转毛细胞纤毛过长的结构基础是相符合的[2];③本研究应用的国产电极,其电极长度及结构设计的差异,以及手术方法、熟练程度和电极植入深度不同等都可能导致内耳伤害程度不一样,从而导致听力损害不同。本研究中观察到在术后一周时,植入耳蜗电极侧的低频ABR部分有所恢复,达到100 dB SPL左右,但高频部分在120 dB SPL仍无法引出(表2.)。分析其原因可能为:①低频听力部分对应的区域在耳蜗尖部,植入的电极并没有到达和直接损伤该区域。在电极植入一周后,内、外淋巴液动力学再次达到平衡,低频的听力得以部分恢复;②但由于手术创伤以及植入电极引发的炎性反应会波及到低频区域,因此仍有不可逆的听力损害。目前在临床中,局部使用糖皮质激素减轻炎性反应,可以帮助术者实现保存残余听力的目的。
本研究中,植入电极耳的对侧听力也有一过性的损害(表2.)。可能是因为猪的颞骨乳突部分为板障型,磨骨时的减震效果较人类差,导致噪声性听力损害,表现为暂时性阈移。这也提示研究人员,在临床中如果行单侧聋患者的耳蜗植入时,要注意对侧耳的听力保护。
本组6只动物EABR测试中,设计了5个不同位置的电极作为测试点,其中2#为电极头端,对应于低频区域,6#,10#,16#,22#依次排列直至圆窗位置。听力正常组的各个电极EABR阈值均较相应的耳聋组低,分析是由于耳聋动物耳蜗内的螺旋神经节数量减少导致。前期研究中发现突变耳聋荣昌猪组(Mitf -/-)的螺旋神经节数量在出生后30天减少至正常的70%[7]。本研究中使用的动物是出生后40 天-45天,耳蜗内螺旋神经节细胞数量已经有明显的减少,导致EABR的阈值增高。研究结果还显示2组内的EABR阈值,靠近圆窗处的22#电极阈值高于其他电极的阈值。既往动物实验结果与本研究类似,刺激电极从蜗尖移至蜗底时,EABR的Ⅰ波和Ⅲ波潜伏期逐渐延长,反应阈值亦增高[8,9]。其原因主要考虑与EABR刺激电流的性质、刺激电极位置、电极与螺旋神经节及耳蜗神经的距离等条件有关。从本研究的结果分析,靠近圆窗的22#电极距离螺旋神经节较远,也符合EABR测试的结果。并且,电极周围的纤维化反应也可能增加电阻,进一步使EABR阈值增高。
本研究运用荣昌猪,一种大型哺乳动物,成功建立了临床常规使用的电子耳蜗设备的耳蜗植入研究平台。但目前的样本量较少,仅有6只动物,并且只做了急性期的研究观察,尚缺乏大样本和长期的研究数据,所得数据还不能建立具有统计学意义的数据库,还有待进一步完善和深入研究。

表2 听力正常(Mitf+/+)动物电子耳蜗植入前后ABR阈值Table 2 ARB threshold of normal animals(Mitf+/+)before and after cochlear implantation

表3 听力正常(Mitf+/+)与突变耳聋猪(Mitf-/-)电子耳蜗植入前后EABR阈值(CL)Table 3 EABR threshold of normal hearing pigs (Mitf +/+),and the mutation deafness pigs (Mitf -/-) before and after cochlear implantation
参考文献
1徐延军,杨仕明,胡吟燕et al.C57BL/6小鼠内耳形态学和年龄相关性听力损失的研究.中华耳科学杂志,2008,6(4):398-402.XU Yan-jun,YANG Shi-ming,HU Yin-yan,et al.Age-related hearing loss and inner ear morphological changes.[J].Chinese Jour⁃nal of Otology,2008,6(4):398-402.
2WEIWEI GUO,HAIJIN YI,LILI REN,et al.The Morphology and Electrophysiology of the Cochlea of the Miniature Pig.The Anatomi⁃cal Record,2015.298(3):494-500.
3Thorne M,Salt AN,DeMott JE,et al.Cochlear fluid space dimen⁃sions for six species derived from reconstructions of three-dimen⁃sional magnetic resonance images.Laryngoscope.1999,109:1661–1668.
4Yi,H.,et al.,The temporal bone microdissection of miniature pigs as a useful large animal model for otologic research.Acta oto-laryngo⁃logica,2014.134(1):26-33.
5侯赟,郭维维,杨仕明et al.小型猪内耳发育形态学观察.中华耳科学杂志,2012.10(4):p.485-488.HOU Yun,GUO Wei-Wei,YANG Shi-ming,et al,Developmental of Inner Ear in Miniature pigs.2013.10(4):485-488.
6Rizer FM,Arkis PN,Lippy WH,et al.A postoperative audiometric eval⁃uation of cochlear implant patients.Otolaryngol Head Neck Surg,1998,98:203.
7任丽丽、杨仕明.白化荣昌猪耳聋的分子病理机制研究.[D] 2013.Ren Lili,YANG Shiming.Probing the molecular pathological mech⁃anism underlying the deafness in albino Rongchang swine.
8Guiraud J,Gallego S,Arnold L,et al.Effects of auditory pathway anatomy and deafness characteristics? On elec⁃trically evoked audi⁃tory brainstem responses.Hearing research 2007;223:48-60.
9Shepherd RK,Hatsushika S,Clark GM.Electrical stimulation of the auditory nerve:the effect of electrode position on neural excitation.Hearing research 1993;66:108-20.
·听觉研究新模型专辑·
Establish the standard method of Rongchang pig cochlear implant and preliminary observation of hearing function
CHEN Wei1,2,LIU Riyuan1,ZHAGN Liang3,JI Fei1,GUO Weiwei1,REN Lili1,LI Jianan1,YUAN Shuolong1,ZHANG Yue1,CHEN Lei3,YANG Shiming*1
1 Department of Otolaryngology,Head & Neck Surgery,Chinese PLA General Hospital,Beijing 100853,China.2 Department of Otolaryngology,Head & Neck Surgery,Chinsese PLA Air Force General Hospital,Beijing 100036,China.3 Key Laboratory of Pig Industry Sciences (Ministry of Agriculture),Chongqing Academy of Animal Science,Chongqing 402460,China.
Corresponding author:YANG ShimingEmail:yangsm301@263.com
【Abstract】Objective Establish the standard method of cochlear implant on large mammals–pigs,and observed the changes of ABR & EABR before and after cochlear implants.Methods Six Rongchang pigs,male and female unlimited,40-45 days,8 ~ 12 kg,were selected from Key Laboratory of Pig Industry Sciences (Ministry of Agriculture),Chongqing Academy of Animal Science.Divided into the normal hearing group (Mitf +/+),and the mutation deafness group (Mitf -/-),each group of three.Cochlear implantation were operated in general anesthesia.ABR & EABR were recorded prior to surgery,immediately finish surgery and 1 week after.Observed the position of electrodes by Skull X-ray.Results Cochlear implant is succeed in six animals,electrode position is good,within the cochlea coiling 1.5 ~ 1.75 turns.Cochlear implants immediately,operation side (right),waveform of ABR can’t be recorded.Seven days after the operation,operation side (right),ABR threshold is 100 dB SPL at low frequency,but waveform of ABR can’t bebook=16,ebook=25recorded at high frequency still.Cochlear implants immediately and a week later,EABR threshold is 90 CL at normal hearing group (Mitf +/+).It was lower than 190 CL of group of mutation deafness(Mitf -/-).Conclusion Our study show that the methods of cochlear implant at Rongchang pig is really practical,and the EABR test via electrodes implanted is convenient and feasible.Our study provide the basis for more directly research on cochlear implants in vivo and the physiological or pathological changes of cochlear after cochlear implanted.
【Key words】Cochlear implant,Rongchang pig,ABR,EABR
收稿日期:2016-02-03
通讯作者:杨仕明,Email:yangsm301@263.com
作者简介:陈伟,博士在读,副主任医师,研究方向:电子耳蜗植入相关研究,内耳基因及干细胞治疗相关听觉医学研究
基金项目:国家973计划重大科学研究计划干细胞项目(2012CB967900);国家973计划重大科学问题导向项目(2011CBA01000);国家自然科学基金面上项目(81271082);国家自然科学基金青年项目(81400472);北京科技创新基地培育与发展专项;重庆市基本科研业务费项目(11611,14440);空军总医院课题(KZ2015005)。
DOI:10.3969/j.issn.1672-2922.2016.01.004
【中图分类号】R764
【文献标识码】A
【文章编号】1672-2922(2016)01-15-6

