小型猪与大鼠不同记录部位诱发VEMP的比较
李亚袁硕龙张悦潘红梅任丽丽张亮时晰乔月华,3徐州医学院听力中心中国人民解放军总医院耳鼻咽喉头颈外科北京008533徐州医学院附属医院临床听力中心重庆市畜牧科学院
小型猪与大鼠不同记录部位诱发VEMP的比较
李亚1*袁硕龙2*张悦2潘红梅4任丽丽2张亮4时晰1乔月华1,3
1徐州医学院听力中心
2中国人民解放军总医院耳鼻咽喉头颈外科北京100853
3徐州医学院附属医院临床听力中心4重庆市畜牧科学院
【摘要】目的分析正常小型猪不同记录部位(颈部伸肌、咬肌)的前庭诱发肌源性电位(vestibular evoked myogenic potential,VEMP)波形图,并与大鼠的VEMP波形图进行比较;方法各选取12只前庭功能正常的大鼠和小型猪,进行麻醉之后,用自制装置进行固定,1000Hz强短声诱发颈部伸肌、咬肌肌源性电位,并记录其波形;结果大鼠颈部伸肌诱发的肌源性电位,第一个正向波P的潜伏期为6.45±0.23ms,振幅约1.45±0.49uv,80dB SPL引出率为58%;咬肌诱发肌源性电位,第一个正向波P的潜伏期为6.38±0.34ms,振幅约1.57±0.35uv,阈值80dB SPL引出率为50%。小型猪颈部伸肌诱发肌源性电位,第一个正向波P的潜伏期7.65±0.64ms,振幅1.66±0.34uv,80dBSPL的引出率为58%;咬肌诱发肌源性电位,第一个正向波P的潜伏期7.60±0.78ms,振幅1.31±0.28uv,80dBSPL的引出率为50%。结论小型猪和大鼠不同部位记录得到的VEMP,只有振幅和引出率的差异,而潜伏期没有统计学意义;从波形的重复性、波幅的大小、引出率以及潜伏期的综合考虑,小型猪咬肌部位记录的VEMP波形优于颈部伸肌,大鼠颈部伸肌记录得到的VEMP波形优于咬肌;在相同部位记录到VEMP第一个正向P波的潜伏期时间、波幅的大小方面小型猪较大鼠的稍高。
【关键词】前庭诱发肌源性电位;小型猪;大鼠;颈部伸肌肌源性电位;咬肌肌源性电位
李亚和袁硕龙为并列第一作者
Fund project :The national 973 Plan major scientific research project of stem cell project (2012CB967900).The national 973 Plan major scientific issues oriented project (2011CBA01000).National Natural Science Foundation of China(81400472).The fundamental research funds for the project in Chongqing city (11611,14440).National Natural Science Foundation of China(81470684).Jiangsu province clinical medical science and technology special b12014032.The peak of six talents in Jiangsu Province 2014-WSN-043,China Postdoctoral Science Foundation 2015M571818,Student innovation and entrepreneurship training program of higher education of Jiangsu province 201510313003Z.Declaration of interest:The authors report no conflicts of interest.
前庭诱发性肌源性电位(Vestibular-evoked myo⁃genic potential,VEMP),是过强音刺激球囊并在紧张的骨骼肌上记录到的肌源性电位,来反映人和动物前庭丘脑通路完整性的一种客观、无创的电生理检查方法,对于前庭系统及其相关疾病的诊断具有重要的临床参考价值[1,2]。进行VEMP检查时需要胸锁乳突肌保持一定的张力,部分年老者及颈椎疾病患者进行VEMP检测较为困难,Deriu等[3,4]通过声、电刺激正常人的前庭,在咬肌记录到肌源性电位;谢溯江等[5]建立强短声诱发的咬肌肌源性电位的鼠的模型,并探讨了该电位的起源。
小型猪已在生物医学领域中得到广泛应用,在耳科研究中,小型猪在解剖、生理上等方面与人类极为相似,尤其前庭的形态结构和相对位置与人的更为接近[6],正逐步成为研究人类耳科疾病的重要实验动物[7,8];小型猪的咬肌,较为粗壮发达,近似正方形,起自颧骨,止于下颌支,该肌肉表面有面皮肌和面神经,深面主要覆盖下颌支[9];位置表浅、肌肉粗大、易操作;大鼠咬肌发达、皮下脂肪少、易定位;在临床上,颈部伸肌(胸锁乳突肌)作为VEMP的记录部位已得到广泛的应用,已成为评价前庭功能的常用检测方法之一;因此本实验选取颈部伸肌和咬肌分别作为VEMP的记录部位,在小型猪和大鼠上进行观察。本研究选取的广西巴马小香猪和大鼠作为研究对象,分析其在颈部伸肌、咬肌部位记录到的VEMP波形图的特点,两者进行比较。
2 材料方法
2.1实验动物及分组
12头正常的雌性小型巴马香猪(由中科院北方大动物研究基地提供),出生后6个月,体重约25kg,检查外耳道有无异常分泌物,观察有无步态异常、头部左右摇晃、躯干卷曲、强迫环行运动(转圈)等平衡功能异常表现,12只成年雌性大鼠(军事科学院实验动物中心),体重300g左右观察耳廓反射是否灵敏、有无四肢外展或无力、平衡障碍等行为异常;分别在小型猪与大鼠进行VEMP测试。
2.2麻醉
为了减少清醒状态下脑电活动、头部运动及四肢肌肉的运动干扰,在测试前对实验动物进行麻醉,麻醉前禁食12h;以3%戊巴比妥钠(1ml/kg,北京普博斯生物公司)+速眠新Ⅱ(0.1ml/kg,吉林华牧动物保健品有限公司)给予小型猪肌肉注射麻醉;3min-5min即出现小型猪头部下耷、活动减少、步态不稳、喜卧等表现,大鼠给予1%戊巴比妥钠(北京普博斯生物公司)0.4ml/100g进行腹腔缓慢注射,以角膜反射、疼痛消失为标志表示麻醉成功。
2.3VEMP测试
将针式记录电极插入大鼠右侧咬肌下1/3表层,参考电极插入鼻尖,接地电极插入头顶部皮下。在大鼠上下门齿之间衔一自制塑料球,使其上下颌骨尽可能张大,人为的使咬肌紧张性增强,使大鼠咬肌保持一定的张力,以便VEMP的记录;大鼠颈部伸肌肌源性电位检测的麻醉方法同咬肌,记录电极置于颈部伸肌的中点,参考电极放置于颅顶,地线接于鼻尖;用自制固定瓶,将大鼠身体放入其中,头部裸露在外,用自制固定带固定其头部,使其头部转向一侧,确保颈部伸肌保持一定程度的张力;用Smart EP诱发电位仪(美国智听公司)记录咬肌电位,疏波短声0.1ms,短声刺激叠加次数128次,频率1000Hz;由插入外耳道内的ER3A耳机(型号MO15300)给声,肌电图信号放大100 k,带通滤波30~3 000Hz,刺激重复率5 Hz,扫描时间50ms,叠加128次。刺激强度从100 dB SPL开始,每次下降10dB SPL,直到波形消失;在阈值强度进行连续2次记录,以验证其重复性和稳定性。
小型猪的咬肌近似正方形,位置表浅,肌纤维粗壮发达,起自颧骨,止于下颌支,该肌肉表面内有面皮肌和面神经走行,深面主要覆盖下颌支[9]。小型猪颈部在解剖结构上与人的有所差异,其脂肪组织较厚,椎间隙较窄,限制其头部的活动范围;其颈部伸肌在解剖结构和生理上与人的胸锁乳突肌类似,位于其颈部两侧,其起于肱骨嵴,止于枕骨和岩颞骨,其表面被较厚的脂肪组织所覆盖,不易触及,是颈部最为重要的肌肉,主要支配头部的旋转、抬头颈部伸肌;用Smart EP诱发电位仪(美国智听公司)记录咬肌和颈部伸肌诱发电位。使用开放声场记录。
3 结果
大鼠颈部伸肌的肌源性电位,第一个正向波P的潜伏期为6.45±0.23ms,振幅约1.64±0.49uv,100dB SPL、90dB SPL、80dB SPL引出率分别为100%、75%、58.3%,阈值为80dB SPL;咬肌肌源性电位,第一个正向波P的潜伏期为6.42±0.34ms,振幅约1.47±0.35uv,100dB SPL、90dB SPL、80dB SPL引出率分别为100%、66%、50%,阈值80dB SPL;小型猪颈部伸肌肌源性电位,第一个正向波P的潜伏期7.65±0.64ms,振幅1.66±0.34uv,100dB SPL、90dB SPL、80dB SPL引出率分别为100%、83%、58%,阈值80dB SPL;咬肌肌源性电位,第一个正向波P的潜伏期7.60±0.78ms,振幅1.31±0.28uv,100dB SPL、90dB SPL、80dB SPL引出率分别为100%、75%、50%,阈值80dB SPL。

图1 A/B分别为小型猪、大鼠的ABR波形Fig.1 The normal ABR waveform (SPLdB) was detected in the mini pig and rat ,the threshold value was 25dB SPL

图2 A为6月龄雌性小型猪从颈部伸肌部位记录到的肌源性电位,第一个正向波P的潜伏期的时间约7.52ms,振幅约1.50uv左右,阈值约75dB SPL,第二个负向波N波的潜伏期的时间约为9.87ms;B为6月龄雌性小型猪咬肌的肌源性电位,第一个正向波P的潜伏期大约7.63ms,振幅约1.33uv,阈值约75dB SPL,第二个负向波N的潜伏期为11.63ms左右,从图可以看出,咬肌部位记录到的波形基线较为平稳,重复性较好。Fig.2 A:neck extensor muscle evoked myogenic potential in female mini pigs of 6 months,The first forward wave Pof the latency is about 7.52ms,the amplitude is about 1.50uv,the threshold is about75dBSPL,thefirstnegativewave Nofthelatencyis9.87ms; B:masseter muscle evoked myogenic potential in female mini pigs of 6 months,The first forward wave P of the latency is about 7.63ms,the amplitude is about 1.60uv,the threshold is about 75dBSPL,thefirstnegativewave Nofthelatencyis11.63ms.

图3 A是成年雌性大鼠颈部伸肌的肌源性电位,第一个正向波P的潜伏期约6.45ms,振幅约1.50uv,阈值80dBSPL;B是雌性大鼠咬肌部位的肌源性电位,第一个正向波P的潜伏期约6.52ms,振幅约1.77uv,阈值80dBSPL。Fig.3 A:The neck extensor muscle evoked myogenic potentials in adult female rats,The first forward wave P latency is about 6.45ms,the amplitude is about 1.50uv,the threshold value is 80dBSPL; B:Female rats masseter muscle sites evoked myogenic potentials,the first positive P wave latency period is approximately 6.52ms,amplitude is about 1.77uv,threshold is 80dBSPL.
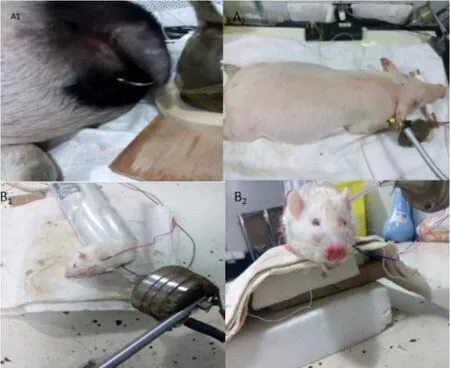
图4 A1/A2为小型猪颈部伸肌及咬肌部位记录VEMP时的摆放位置;B1/B2为在大鼠进行颈部伸肌及咬肌部位记录VEMP时的摆放位置。Fig.4 A1/A2 Pose of mini pigs when recording VEMP in the neck extensor and masseter muscle B1/B2 Pose of rats when recording VEMP in the neck extensor and masseter muscle
5 讨论
临床上,VEMP常用于评价一些神经耳科学疾病,如听神经瘤、梅尼埃病、前庭神经炎、上半规管裂综合征、多发性硬化症、良性阵发性位置性眩晕、前庭性偏头痛以及其它外周或中枢性前庭疾病;VEMP的振幅是评价前庭功能的一个重要指标,但是其易受其他因素的干扰如:刺激声的频率与能量、年龄、肌力、表皮厚度甚至性别等[11,12,13],所以采用同性、体重相等的实验动物,以消除自身差异对VEMP的影响;周娜[14]等同样发现个体间的振幅差异较大,而潜伏期无明显差异,振幅是VEMP在临床应用上的一个比较重要的指标,但受到两侧肌力差异的影响,进而影响波幅准确性的判断[15,16]。虽然在临床检查过程中,使用表面肌电图检测胸锁乳突肌肌张力的大小,并遵循国外学者[17]建议将表面肌电图的靶向水平控制在30uv-50uv,但是迄今为止还没有能够完全建立一个标准方法来缩小这种差异[18,19]。在动物实验过程中尽可能增加咬肌及颈部伸肌的肌张力,以有利于VEMP波形的记录,但不可避免的造成振幅相关指标的灵敏度和客观性的降低。VEMP的振幅与检测部位肌肉的表面肌电图平均水平有明显的正相关关系,检测部位的肌张力直接影响VEMP的振幅的强弱[15,17];在咬肌部位所记录的振幅,小型猪的波幅低于大鼠,其原因可能有1)、小型猪受生理状态的影响,一些前庭神经纤维衰退及咬肌肌肉生理性萎缩,使神经传导速度变慢及肌肉的张力降低;2)、在小型猪整个测试过程较大鼠耗时长,长时间、高强度咬肌紧张较容易使咬肌肌肉产生疲劳,影响肌肉收缩,影响振幅的幅度。3)、大鼠为啮齿杂食类动物,单位面积咬肌肌纤维密度大、数量多且单个肌纤维较粗;4)、在测试过程中,所使用的使咬肌肌张力增加的工具是我们自制的,存在人为的因素使小型猪咬肌肌张力降低;通过此实验,发现无论是经颈部伸肌或咬肌部位所诱发VEMP均需要使背景肌肉高度紧张,由于动物背景肌的解剖结构与功能与人类有所差异,还没有找到合适的方法使颈部伸肌高度紧张而颈部其他肌肉组织松弛,因此,这种方法记录到的波形易受动物自身状态的影响,造成基线不稳、杂波干扰以及振幅变化较大,在实验过程中应尽力避免这种干扰,以确保波形良好的重复性和稳定性;由于小型猪颈部肌肉组织解剖复杂,皮表被较厚的脂肪组织覆盖,因此,测试过程中易引起颈部伸肌张力性不足,记录电极放置定位不清,造成记录数据的差异较大,长时间的颈部背伸,还易造成实验动物气道的通气不畅,引起打鼾、气道分泌物增多甚至窒息;咬肌记录VEMP时,动物的躯干及颈部俯卧于检测台上,始终处于休息松弛状态,避免了一些肌电的干扰,得出的波形重复性较好、基线较为平稳;本研究认为,尽管从咬肌部位引出VEMP的振幅及部分刺激强度的引出率低于颈部伸肌,但从动物自身的安全性、图形的重复性和稳定性以及实验操作简易程度上来讲,以小型猪咬肌作为VEMP的记录部位所引出的波形优于颈部伸肌。然而,从波形的重复性、波幅的大小、引出率以及潜伏期的综合评比,我们在大鼠颈部伸肌记录到的VEMP波形优于咬肌,与一些学者的研究表述基本一致,究其原因我们推测可能与其记录部位背景肌肉本身的解剖结构及生理功能有关,也有可能与本研究的记录方式有关,需要在以后的研究中进一步探讨。对于不同动物模型VEMP的振幅,由于记录条件的限制,现阶段没有有效的方法去监测其背景肌肉的肌电活动水平,为了使结果更可靠及客观,应同步记录背景肌肉的张力水平;怎样检测背景肌肉的张力是咬肌肌源性诱发电位能否推广应用的关键所在。目前认为波幅的绝对值的差异可能只是因为肌肉张力的影响,而与前庭功能是否正常无关;仅研究波幅绝对值的变化,在目前条件下是没有意义的[4]。

表1 小型猪与大鼠不同部位引出的潜伏期、振幅之间的比较Table 1 Comparison between the latency and amplitude of the different parts of the mini pig and rat.*Compare among groups P<0.05.
VEMP的潜伏期是评价前庭功能的一个重要指标,在VEMP的动物模型中,第一个正向波所引出频率最高(100dB/SPL,约100%引出)[11,12],应用意义也最大,故本实验只关注该正向波。在强短声诱发的小型猪不同部位(咬肌、颈部伸肌)肌源性电位的第一个正向波潜伏期范围为7-9ms,与本研究在小型猪的颈部伸肌(臂头肌)上诱发的肌源性电位的潜伏期范围是一致的。大鼠在咬肌部位及颈部伸肌部位记录到的第一个正向波的潜伏期为6-8ms。两种实验动物在咬肌部位及颈部伸肌部位记录到的第一个正向波的潜伏期,没有统计学差异。两种实验动物在80dBSPL的引出率上颈部伸肌部位的引出率高于咬肌。通过两种实验动物之间的比较发现,在小型猪咬肌部位记录到的VEMP的潜伏期与人的较为接近,小型猪VEMP的潜伏期低于人的,而高于大鼠的,这与其神经通路的长短及神经纤维的直径有关,在强短声诱发的小型猪VEMP的第一个正向波潜伏期范围为7-9ms,大鼠VEMP的记录到的第一个正向波的潜伏期约为6-8ms,潜伏期代表由外周-脑干-咬肌运动神经核各受体激活的时间[20],小型猪和人的潜伏期较长可能与球囊信号向中枢神经传递过程所消耗的时间较多有关,在临床上潜伏期增加可能是外周前庭功能减退所致及有髓神经纤维衰老变性后的低传导率有关;根据Cazals和Didier等[21.22]的研究,声刺激大鼠前庭神经的潜伏期为1 ms,前庭核团的潜伏期为3ms,如果咬肌肌源性电位来自前庭,那么其正波潜伏期应至少大于4 ms,而小于人体数据的11 ms[4,23]。本研究中记录的大鼠颈部伸肌和咬肌肌源性电位的潜伏期就正好位于6-8ms内。
尽管VEMP能客观的评价前庭功能的状态,现已广泛应用于临床中,但是仍存在许多问题需要进一步探究;首先,现已证实VEMP来源于球囊,但是与其它前庭器官的关系究竟如何,目前还不是十分的清楚;其次,尚缺乏特异性球囊功能障碍的动物模型,在动物实验方面受到一定的限制;再次,目前动物实验还没对VEMP检查规范化形成统一的认识。因此,VEMP的检查(尤其是动物VEMP的检查),我们还有相当多的工作要做。
参考文献
1K Shimizu,T Murofushi,M Sakurai.Vestibular evoked myogenic po⁃tentials inmultiple sclerosis [J].Neurol Neurosurg Psychiatry,2000,69:276一277.
2Taylor RL,Bradshaw AP,Halmagyi GM,Welgampola MS.Tuning characteristics of ocular and cervical vestibular evoked myogenic po⁃tentials in intact and dehiscent ears [J].Audiol Neurootol 2012;17:207–18.
3Deriu F,Podda MV,Chessa G,et al.Trigeminal integration of vestib⁃ular and forelimb nerve inputs [J].Arch Ital Biol.1999,137(1):63-73.
4Murofushi T.Vestibular evoked myogenic potential [J].World J Oto⁃rhinolar-yngol 2014;4:6–11
5谢溯江.博士.中国人民解放军军医进修学院(2007)Dr.Xie Sujiang.Chinese PLA postgraduate medical school(2007).
6任丽丽.博士,中国人民解放军医学院(2013).Dr.Ren Lili,the Chinese people's Liberation Army Medical College (2013).
7 Hsu Q K.Pig model for biomedical research.Taiwan [M].Pig Re search Institute,1982.3一10.
8魏泓.小型猪.医学实验动物学[M],1997,206~211 Hong Wei.Pigs.Medical Laboratory Animal Science
9朱星红等版纳微型猪近交系解剖组织学.高等教育出版社[M]。2004.40-46 Hongxing Zhu,Bingyin Su,Dajun Ying.Anatohistology of Banna Minipig Inbred-lines[M].Higher Education Press.2004.40-46
10左艳芳,张天飞,张集建.戊巴比妥钠在实验小型猪麻醉中的应用[J].药物研究,2002,11(8):33.Yanfang Zuo,Tianfei Zhang,Jijain Zhang.Pentobarbital sodium was applied in experimental miniature pigs anesthesia [J].drug research,2002,11(8):33.
11 Lopez-Escamez JA,Carey J,Chung WH,Goebel JA,Magnusson M,Mandala M,et al.Diagnostic criteria for Meniere’s disease[J].J Vestib Res 2015;25:1–7..
12 Taylor RL,Bradshaw AP,Halmagyi GM,Welgampola MS.Tuning characteristics of ocular and cervical vestibular evoked myogenic potentials in intact and dehiscent ears[J].Audiol Neurootol 2012;17:207–18.
13王博琛.颈部前庭诱发肌源性电位的影响因素[ J],中华耳科学杂志,2010,10:541-544.Boshen Wang.Influence factors of cervical vestibular evoked poten⁃tial[ J],Chinese Journal of Otology.2010,10:541-544.
14周娜,吴子明,张素珍等.不同刺激模式前庭诱发肌源性电位的反应特性[J].中华耳鼻咽喉科杂志,2004 39:483-485.Na Zhou,Ziming Wu,Suzhen Zhang,et al.Response characteristics of vestibular evoked potentials in different stimulation modes [J].Chi⁃nese Journal of Otology.2004 39:483-485.
15Zhang AS,Govender S,Colebatch JG.Tuning of the ocular vestibu⁃lar evoked myogenic potential (oVEMP) to air- and bone-conducted sound stimulation in superior canal dehiscence [J].Exp Brain Res 2012;223:51–64.
16Papathanasiou ES,Murofushi T,Akin FW,Colebatch JG.Interna⁃tional guide-lines for the clinical application of cervical vestibular evoked myogenic potentials:an expert consensus report [J].Clin Neurophysiol 2014;125:658–66.
17孙伟,王锦玲,邱建华,等.单侧及双侧短纯音刺激前庭诱发肌源性电位观察[J].听力学及言语疾病杂志.2005,13:149-151.Wei Sun,Jingling Wang,Jianhua Qiu,et ai.Vestibular evoked myogen⁃ic potentials of unilateral and bilateral short tone stimulus Observa⁃tion [J].Journal of Audiology and Speech Pathology.2005,13:149-151.
18 Akin FW,Murnane OD,Panus PC,et al.The influence of voluntary tonic EMG level on the vestibular-evoked myogenic potential [J].J Rehabil Res Dev.2004,41:473-480
19 Westin M,Brantberg K.Mastoid and vertex low-frequency vibra⁃tion-inducedoVEMP in relation to medially directed acceleration of the labyrinth [J].Clin Neurophysiol 2014;125:615–20.
20王博琛.硕士.南方医科大学.2010.Ma.Wang Boshen .Southern Medical University.2010.
21吴子明,张素珍,杨伟炎,等.前庭诱发的肌源性电位原理与应用[J].中华耳科学杂志,2004,2:70-72,47.Ziming Wu,Suzhen Zhang,Weiyan Yang,et ai.Principle and applica⁃tion of vestibular evoked potentials[J].Chinese Journal of Otolo⁃gy.2004,2:70-72,47.
22Cazals Y,Erre JP,Aurousseau C.Eighth nerve auditory evoked re⁃sponsesrecorded at the base of the vestibular nucleus in the guinea pig [J].Hear Res.1987 31(1):93-97.
23Didier A,Cazals Y.Acoustic responses recorded from the saccular bundleon the eighth nerve of the guinea pig [J].Hearg Res.1989 37 (2):123-127
·听觉研究新模型专辑·
Vestibular-evoked myogenic potentials recorded from miniature pigs and rats
LI Ya1*,YUAN Shuolong2*,ZHANG Yue2,PAN Hongmei4,REN Lili2,ZHANG Liang4,SHI Xi1,QIAO Yuehua3
1Xuzhou Medical College listening Center 2Department of Otolaryngology,Head & Neck Surgery,Institute of Otolaryngology,Chinese PLA General Hospital,Beijing 100853,China.3Clinical hearing center of Affiliated Hospital of Xuzhou Medical College 4Key Laboratory of Pig Industry Sciences (Ministry of Agriculture),Chongqing Academy of Animal Science
Corresponding author:QIAO YuehuaEmail:oto8558@163.com
【Abstract】Objective To report vestibular evoked myogenic potentials from different recording sites (neck extensor muscle and masseter muscle) in mini pigs and rats.Methods Potentials were recorded from neck extensor muscles or masseter muscles in normal adult Bama mini pigs and rats anesthetized with 3% pentobarbital sodium and Sumianxin II using 1000 Hz tone bursts.Results At 80 dB SPL,the latency,amplitude and response rate of the first positive wave P was 6.45± 0.23 ms,1.45±0.49 uv and 58%,respectively,from rat neck extensor muscles; 6.38±0.34 ms,1.57±0.35 uv and 50% from rat masseter muscles; 7.65±0.64 ms,1.66±0.34 uv and 58% from mini pig neck extensor muscles; and 7.65±0.64 ms,.31± 0.28 uv and 50% from mini pig masseter muscles.Conclusion VEMP can be recorded from neck extensor and masseter muscles in mini pigs and rats.Within a given species,VEMP amplitude and response rate are dependent on the site of recording,while latency is not.Analysis of the responses suggests that the optimal VEMP recording site is the masseter muscle in mini pigs but cervical extensor muscles in rats.At the same recording site,the latency and amplitude of VEMP are slightlybook=28,ebook=37greater in mini pigs than in rats.
【Keywords】vestibular evoked myogenic potentials; mini pig; rat; masseter muscle myogenic potential;
收稿日期:(2016-01-26)
通讯作者:乔月华,Email:oto8558@163.com
作者简介:李亚,硕士,研究方向:耳科学基础研究
基金项目:国家973计划重大科学研究计划干细胞项目(2012CB967900);国家973计划重大科学问题导向项目(2011CBA01000);国家自然科学基金青年项目(81400472);重庆市基本科研业务费项目(11611、14440);江苏省六大人才高峰2014-WSN-043;中国博士后基金2015M571818;江苏省高等学校大生创新创业训练计划201510313003Z,
DOI:10.3969/j.issn.1672-2922.2016.01.006
【中图分类号】R339.16
【文献标识码】A
【文章编号】1672-2922(2016)01-27-5

