模拟失重和噪声对大鼠听功能及耳蜗Corti器损伤的协同作用*
吴玮 陈娜 韩浩伦 王刚 王鸿南 周丽斌 李保卫 丁瑞英
·实验研究·
模拟失重和噪声对大鼠听功能及耳蜗Corti器损伤的协同作用*
吴玮1陈娜1韩浩伦1王刚1王鸿南1周丽斌1李保卫1丁瑞英1
【摘要】目的探讨模拟失重和噪声对大鼠听功能及耳蜗Corti器损伤的协同作用。 方法48只大鼠随机分为空白组、失重组、噪声组和失重+噪声组,每组12只。失重组以Morey-Holton法模拟失重环境,噪声组暴露的噪声环境为模拟航天载人飞船内复合噪声,包括72±2 dB SPL的持续稳态噪声和160 dB SPL的脉冲噪声,失重+噪声组则同时暴露于上述失重及噪声环境中,空白组常规饲养,不做任何处理。分别于暴露1周和2周后,每组随机选出6只大鼠行ABR阈值检测后取材行HE染色、免疫荧光(DAPI)染色及扫描电镜观察耳蜗的形态学变化。结果暴露2周后大鼠ABR阈值较暴露1周时升高,失重+噪声组ABR阈值最高(P<0.01),其次为噪声组。HE染色示暴露1周和2周后除空白组外各组大鼠耳蜗Corti器均有不同程度的损伤,失重+噪声组最严重。免疫荧光染色示暴露1周后大鼠耳蜗毛细胞死亡方式以肿胀坏死为主,失重+噪声组最严重(肿胀率10%),其次为噪声组(肿胀率3.33%);暴露2周后大鼠耳蜗外毛细胞以核缺失为主,失重+噪声组缺失率最高(缺失率13.6%),其次为噪声组(缺失率12.7%),失重组毛细胞缺失以内毛细胞为主。 扫描电镜示,失重+噪声组毛细胞静纤毛损伤最严重,其次为噪声组,再次为失重组。结论模拟失重和噪声环境对大鼠听功能的影响有协同作用,且这种协同作用对耳蜗Corti器有显著的损伤作用。
【关键词】模拟失重;噪声;Corti器;听性脑干反应
研究发现,飞行器内噪声是一个比较突出的危险因素,可以造成飞行人员永久性的听力损伤[1,2]。在载人航天飞船中,不仅存在噪声,失重也是很重要的一种持续存在的特殊状态。失重也可以引起动物听觉系统的损害,并且其与噪声同时存在时,对听觉的影响更为明显[3,4],但损伤是由于两者的协同还是简单的叠加作用尚不明确。为此本实验拟通过ABR阈值检测、耳蜗形态学和毛细胞的免疫荧光、扫描电镜观察等,研究模拟失重和噪声对大鼠听功能的影响及其对耳蜗Corti器的损伤,报告如下。
1材料与方法
1.1实验动物及分组 选取健康雄性SD大鼠48只,体重190±10 g,由北京市兴隆实验动物养殖场提供,耳廓反射灵敏,鼓膜标志清晰,无强噪声暴露及耳毒性药物应用史。实验前所有大鼠进行听性脑干反应 (ABR) 阈值测试无明显差异。随机分为空白组、失重组、噪声组和失重+噪声组,每组12只(24耳)。失重组以持续头低位尾吊Morey-Holton法[5]模拟失重环境,噪声组暴露于模拟航天载人飞船内复合噪声环境,包括72±2 dB SPL的稳定噪声和160 dB SPL的脉冲噪声,失重+噪声组同时暴露于以上两种环境,空白组不做任何处理。分别在暴露1周和2周后,每组随机选取6只大鼠行ABR阈值,然后取耳蜗HE染色、免疫荧光染色、电镜检测观察耳蜗的形态学变化。
1.2模拟失重方法 采用目前国际通用的头低位模拟失重法(Morey-Holton法)[5],尾部用胶带缠于悬吊的铁丝上,保持大鼠头低位,后肢完全离地,前肢承担部分身体重量,身体纵轴与水平面呈30o夹角,悬吊1周或者2周。悬吊期间保证动物可以自由活动与进食。
1.3噪声暴露方法 采用稳态噪声与脉冲噪声的复合环境,稳态噪声由白噪声信号发生器(UZ-3型),经均衡器(MEQ),功率放大器(PA-1000)传到扬声器(YZ20-7),将扬声器放置于大鼠笼前部。稳态噪声声强用BK2250手持式分析仪测量,测得其声压级为72±2 dB SPL,每天持续暴露8小时,暴露1周或2周后给予脉冲噪声;脉冲噪声由气动激波管产生传到传声器(BK4136),峰值声压级为160 dB SPL,有效持续时间为30 ms,3次,每次间隔为1 min。脉冲噪声声级由BK2209精密脉冲声级计测量,用TDS2022数字示波器记录波形。
1.4ABR阈值测试 所有大鼠在实验前进行ABR阈值检测,各组大鼠持续暴露于相应环境1到2周后进行ABR阈值测试,空白组大鼠常规饲养1周或2周后行ABR测试。大鼠给予咪唑安定(80 mg/kg)和盐酸赛拉嗪注射液(200 mg/kg)进行肌肉注射麻醉,应用听性脑干反应仪在隔声静电屏蔽室内检测双耳短声诱发的ABR反应阈值,颅顶为记录电极,测试耳为参考电极,鼻尖处为地线。刺激强度为5~97 dB SPL,间隔5 dB(滤波带宽80~3 000 Hz,叠加次数1 024 次,扫描10 ms),以重复性好、比较稳定的波Ⅲ判断反应阈值。测试及麻醉复苏过程中保持环境温度在38℃左右并用热水瓶保持大鼠体温恒定。
1.5动物取材大鼠ABR阈值检测完后随即断头取其耳蜗,每组每个时间点分别随机选取2只(4耳)行HE染色,2只(4耳)行DAPI染色,2只(4耳)行电镜观察。
1.6HE染色 将耳蜗置于4%多聚甲醛液中,在解剖显微镜下摘除镫骨,灌流4%多聚甲醛固定,4℃冰箱过夜后用10%EDTA脱钙2周,物理法测定脱钙终点。耳蜗石蜡包埋,包埋时蜗轴与切面平行,连续切片,片厚3~5 μm,行HE染色。
1.7基底膜铺片及DAPI染色 取出4%多聚甲醛液中固定的耳蜗,于PBS溶液中在解剖显微镜下用游丝镊剥除盖膜、螺旋韧带等部位,取出基底膜。将分离好的基底膜置于EP管中,PBS 漂洗、5%BSA 溶液常温下封闭30分钟, PBS 溶液漂洗后放入 4℃冰箱过夜。第二天取出标本,所有操作均在避光条件下进行,PBS 溶液漂洗后加入DAPI溶液反应10分钟,以PBS溶液漂洗3 次,每次5分钟;将基底膜取出,平铺于洁净的载玻片上,滴加两滴甘油,盖上盖玻片,将玻片置于共聚焦显微镜(Zeiss LSM 880)下,在60倍下观察,DAPI激发波长为405 nm,410~490 nm接收。实验中对所观察区域的毛细胞进行序列扫描,扫描层距设定为2.0 μm。
1.8扫描电镜检查 大鼠处死即刻取耳蜗,用2.5%戊二醛固定液进行离体耳蜗灌注。固定4 h后,采用硬剥法暴露出基底膜。处理后的内耳标本进行脱水、干燥、镀金等处理。置于扫描电镜(Hitachi S4800)下观察,拍照。
1.9统计学方法 数据采用SPSS 19.0统计学软件处理,各组ABR阈值比较采用单因素方差分析和Post-Hoe方法联合应用,P<0.05为差异有统计学意义。
2结果
2.1ABR阈值各组实验前ABR反应阈值无统计学差异(P>0.05)。暴露1周大鼠的ABR反应阈值较同等环境下暴露2周的大鼠低。暴露1周和2周后,空白组与噪声组、失重+噪声组,失重组与噪声组、失重+噪声组,噪声组与失重+噪声组之间均有显著的统计学差异(P<0.01),噪声组、失重+噪声组比空白组和失重组ABR阈值高(P<0.01),失重+噪声组比噪声组ABR阈值高(P<0.01)(表1)。

(n=12耳)
注:*与空白组和失重组比较,P<0.01;△与噪声组比较,P<0.01
2.2耳蜗HE染色观察结果空白组大鼠耳蜗Corti器清晰,外毛细胞排列整齐且无明显缺失(图1a、1e);暴露后各组大鼠均有不同程度的毛细胞缺失:失重组内毛细胞缺失,螺旋器形状改变(图1b、1f);噪声组螺旋器萎缩,外毛细胞位置错乱,排列不齐,前庭膜向前庭阶略突出(图1c、1g);失重+噪声组螺旋器萎缩,外毛细胞排列不齐(图1d),暴露2周组大鼠耳蜗鼓阶内可见血性物(图1h)。
2.3毛细胞核DAPI染色结果
2.3.1暴露1周后空白组内外毛细胞排列整齐,无核异常(图2a);失重组内毛细胞排列略杂乱但无明显核异常(图2b);噪声组内外毛细胞排列杂乱,外毛细胞存在较多肿胀,肿胀率为3.33%,尤以最外层外毛细胞为重(图2c);失重+噪声组外毛细胞排列紊乱,存在更多核肿胀,肿胀率为10%(图2d)。噪声组大鼠外毛细胞肿胀率明显高于失重组和空白组(P<0.01),失重+噪声组大鼠外毛细胞肿胀率明显高于其余三组(P<0.01)。
2.3.2暴露2周后空白组内外毛细胞排列整齐,无核异常(图3a);失重组内毛细胞存在核缺失,外毛细胞排列整齐且无明显核异常(图3b);噪声组毛细胞排列杂乱,外毛细胞存在核缺失,缺失率约为12.7%,尤以最外层外毛细胞为重(图3c);失重+噪声组外毛细胞排列紊乱,存在更多核缺失,缺失率为13.6%,最外层毛细胞缺失最严重(图3d)。噪声组大鼠外毛细胞缺失率明显高于失重组和空白组(P<0.01),失重+噪声组大鼠外毛细胞缺失率高于其余三组(P<0.05)。
2.4电镜观察结果空白组大鼠基底膜底回毛细胞纤毛呈V型排列整齐,完整清晰(图4a、4e);失重组大鼠基底膜底回静纤毛轻度散乱,偶有融合现象,内毛细胞纤毛倒伏伴有缺失,内层外毛细胞偶有缺失,暴露2周时比暴露1周时损伤大(图4b、4f);噪声组静纤毛明显散乱,内毛细胞纤毛倒伏明显,最外层外毛细胞部分缺失(图4c、4g);失重+噪声组静纤毛散乱且有倒伏,外毛细胞静纤毛大片缺失,以最外层最为明显,暴露2周时比暴露1周时损伤明显(图4d、4h)。
3讨论
Roller[1]、Buckey[6]等认为,噪声是造成宇航员听损伤的主要原因,载人航天器中都持续存在高强度噪声,严重影响着工作人员的身体健康,其中以听觉功能损伤最为严重。长时间暴露于噪声中可能导致缓慢的进行性听损伤,其损伤程度与噪声强度、持续时间等因素有关[7]。失重作为飞行过程中同样持续存在的环境,对听力的损伤作用也不容忽视[8,9]。因此研究模拟失重和复合噪声环境因素对听损伤的作用有重要的现实意义。
本研究通过检测ABR反应阈值判断模拟失重和复合噪声对大鼠听功能的影响,结果发现,噪声组、失重+噪声组比空白组和失重组ABR阈值高(P<0.01),失重+噪声组比噪声组ABR阈值高(P<0.01)。空白组与噪声组、失重+噪声组,失重组与噪声组、失重+噪声组,噪声组与失重+噪声组之间ABR反应阈均有显著的统计学差异(P<0.01)。可见,单独的模拟失重和单独的复合噪声对大鼠的听力均有影响,其中复合噪声影响较大。而综合模拟失重和复合噪声双重因素的失重+噪声组ABR阈值变化更大(P<0.01),且失重+噪声组的ABR阈值并不是失重组和噪声组ABR阈值的简单叠加,因此综合因素对听力造成的影响不是失重和噪声两种因素的简单叠加,可能是两种因素的协同作用。
Corti器是耳蜗的听觉感受器,位于基底膜上,由毛细胞和支持细胞组成。本研究形态学实验结果表明,模拟失重和复合噪声对大鼠耳蜗毛细胞均有一定程度的损伤作用,主要表现在Corti器上。HE染色结果示暴露于失重和噪声因素使得Corti器发生萎缩、紊乱。DAPI是一种特异性染料,能与DNA强力结合并区分凋亡和坏死细胞,凋亡细胞发生染色质浓缩或核碎裂,染色后共聚焦显微镜下表现为胞核致密浓染或缺失,而坏死细胞表现为核肿胀,荧光颜色变淡。从文中毛细胞核的DAPI染色结果看,在复合噪声环境下,外毛细胞较内毛细胞更易受到损伤,损伤多发生于外毛细胞的最外层;而在单纯的失重环境下,内毛细胞更易发生缺失,与之前本课题组对豚鼠耳蜗的研究相符[4]。扫描电镜观察结果也支持以上结论:噪声首先损伤Corti器的外毛细胞,可进一步累及内毛细胞,暴露1周后的大鼠耳蜗毛细胞损伤以肿胀为主,暴露2周后毛细胞损伤以核缺失为主,可见,暴露于失重+噪声复合环境下毛细胞存在坏死和凋亡两种死亡方式,而暴露1周后毛细胞死亡以肿胀坏死为主,此时可能存在核凋亡但未超过生理过程中的正常凋亡水平;暴露于失重+噪声复合环境2周后出现明显的毛细胞核缺失,此时核缺失为毛细胞的非正常死亡,可能是由于高于生理过程中正常的凋亡水平造成的,也可能与强噪声暴露后核的直接崩解坏死有关。国外有研究证实噪声性(105~115 dB SPL)听损伤与毛细胞的缺失密切相关,实验中受损的毛细胞可能直接崩解死亡[10],本文结果与此相符。本实验中的形态学检查与ABR阈值检测结果相一致,因此,失重和噪声均能造成毛细胞的非正常死亡,表现为核的肿胀或缺失。推测本研究中毛细胞的损伤主要由噪声造成,失重使这种损伤更加严重,但毛细胞核的异常具体是由于凋亡还是坏死引起及凋亡的详尽机制还有待进一步研究。
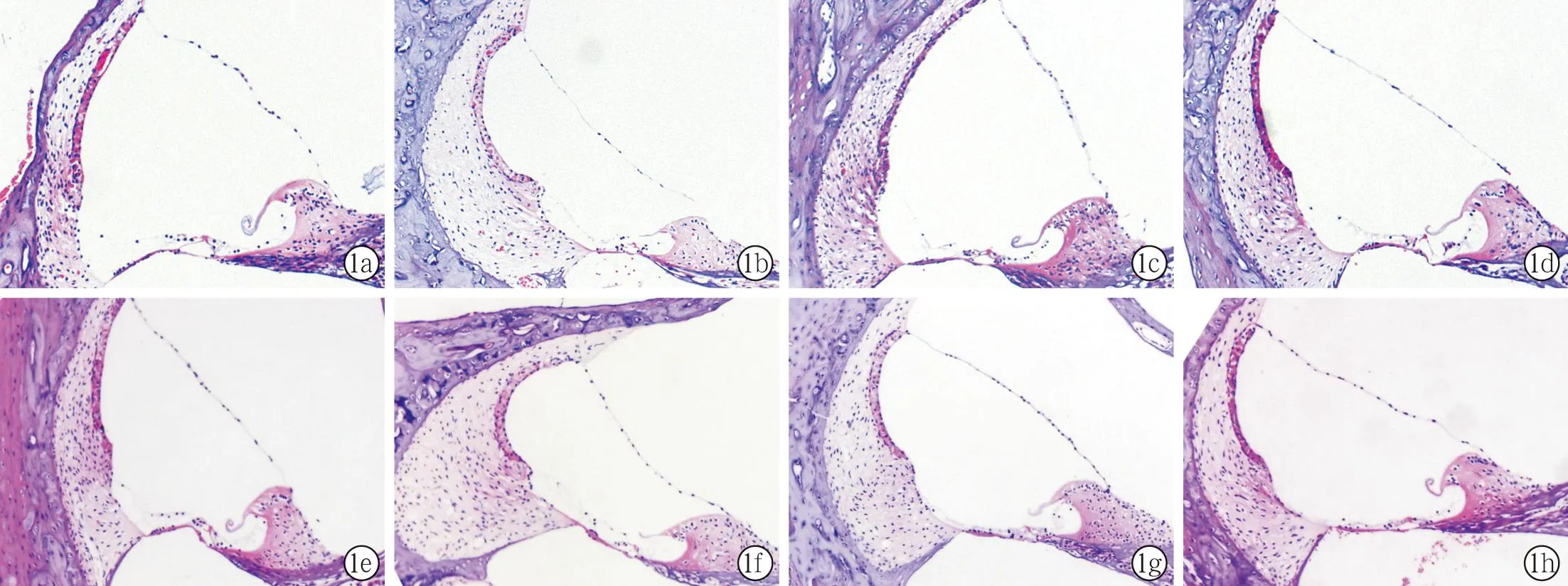
图1 各组大鼠暴露1周和2周后耳蜗HE染色图片(HE×100)
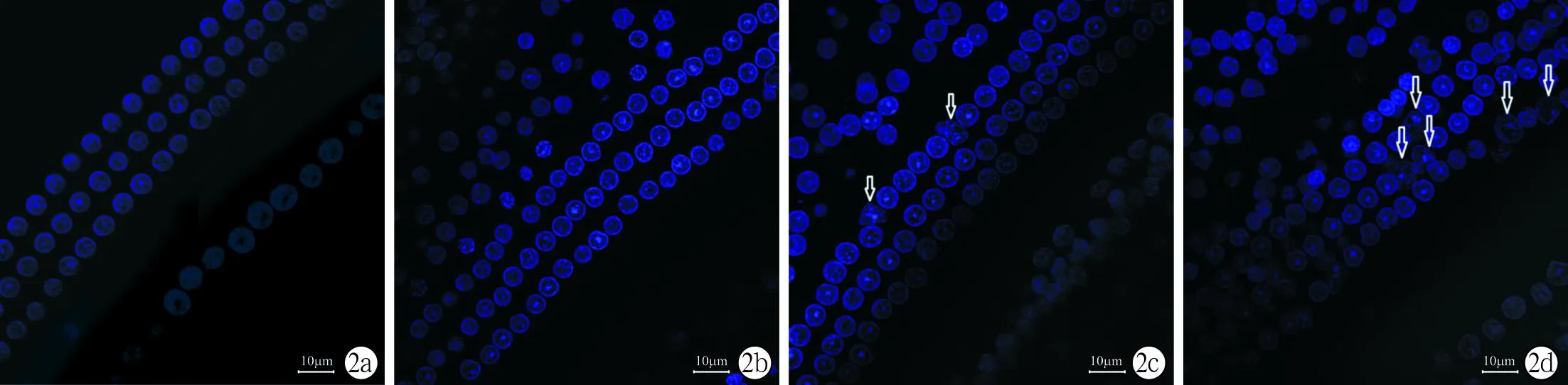
图2 各组大鼠暴露1周后毛细胞核的免疫荧光染色图片(DAPI×60) ↓示毛细胞肿胀

图3 各组大鼠暴露2周后毛细胞核的免疫荧光染色图片(DAPI×60)↓示毛细胞缺失

图4 各组大鼠Corti器底回电镜结果
a~d分别为暴露1周的空白组、失重组、噪声组和失重+噪声组;e~h分别为暴露2周的空白组、失重组、噪声组和失重+噪声组
4参考文献
1Roller CA, Clark JB. Short-duration space flight and hearing loss[J]. Otolaryngol Head Neck Surg, 2003, 129: 98.
2程浩, 徐怡萍, 李宏. 噪声对飞行人员听觉系统影响的调查分析[J]. 中国疗养医学, 2011,20:6.
3吴玮, 韩浩伦,王鸿南,等. 模拟失重条件下飞船内噪声对豚鼠耳蜗与功能的影响[J].中华耳科学杂志,2010,8:95.
4杨光华, 温秀兰, 王宝珍,等. 模拟失重 (HDT-30°) 和噪声复合因素对大鼠神经-内分泌-免疫功能的影响[J]. 空间科学学报, 1994,14:210.
5Morey-Holton ER, Globus RK. The hindlimb unloading rodentmodel: technical aspects[J]. J Appl Physiol, 2002,92:1367.
6Buckey JC, Musiek FE, Kline-Schoder R, et al. Hearing loss in space[J]. Aviat Space Environ Med,2001,72: 1121.
7杨建,刘博,韩德民. 航天性听损伤及其机制探讨[J].国外医学耳鼻咽喉科学分册, 2004, 28:374.
8阎露,钱维权,李道德.噪声、模拟失重复合作用对豚鼠脑干听觉诱发电位的影响(英)[J]. 航天医学与医学工程, 1994, 7(增刊):s52.
9Sandler H, Vernikos J, Wegmann HM, et al. Introduction to counter measures:extended manned space flight[J].Acta Astronaut,1995,35:247.
10Chen GD,Fechter LD. The relationship between noise-induced hearing loss and hair cell loss in rats[J].Hear Res,2003,177:81.
(2015-07-17收稿)
(本文编辑周涛)
The Synergistic Effects of Simulated Microgravity and Noise Exposure on Damage of Auditory Function and Corti Organs in Rat
Wu Wei, Chen Na, Han Haolun, Wang Gang, Wang Hongnan,Zhou Libin, Li Baowei, Ding Ruiying
(Department of Otolaryngology-Head and Neck Surgery, 306thHospital of PLA, Beijing, 100010, China)
【Abstract】ObjectiveTo investigate the synergistic effects of simulated microgravity and noise on the auditory functions and corti organs in rats. MethodsA total of 48 healthy rats were randomly divided into 4 groups (n=12):control group (Group A), microgravity only group (Group B), noise only group (Group C) and microgravity+noise group (Group D). The microgravity environment was simulated by suspending the posterior limb using Morey-Holton method. The noise exposure was the simulation of the noise environment in spaceship including steady-state noise (72±2) dB SPL and impulse noise up to 160 dB SPL. The control group was kept in normal conditions without any exposure. Auditory brainstem responses (ABRs) , HE stainings, immunofluorescence stainings and scanning electron microscopes (SEMs) were tested after 1week and 2 weeks exposure respectively (n=6). ResultsThe average of ABR threshold shifts of 2 weeks exposure were higher than those of 1 week in each group. Group D showed the highest ABRs (P<0.01).The HE stainings showed different degrees of injury in corti organs in all experimental groups; which Group D being the most serious, followed by Group C.The results of immunefluorescence in hair cells showed that swelling necrosis was the main damage of cochlear hair cell after 1 week's exposure.The swelling rate of Group D was the highest, followed by Group C.Nucleus missing in hair cells was observed after 2 weeks' exposure. Group D had the highest missing rate and the main missing of Group B happened in the inner hair cells.SEM showed that the most serious damage of stereociliums in Group D,followed by Group C, then Group B.ConclusionThe synergistic effects of simulated microgravity and noise lead to significant damage of the auditory function and cochlea Corti organs in rat.
【Key words】Simulated microgravity;Noise;Corti organ;Auditory Brainstem Response (ABR)
【中图分类号】R764.43+3
【文献标识码】A
【文章编号】1006-7299(2016)02-0163-05
DOI:10.3969/j.issn.1006-7299.2016.02.013
作者简介:吴玮,女,山东人,博士,主任医师,研究方向为特种耳科学及临床。
网络出版时间:2016-2-116:18
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160201.1618.008.html
*全军十二五重大课题子课题(AWS11J003)资助
1解放军306医院耳鼻咽喉头颈外科(北京100101)

