芍药苷对大鼠背根神经元细胞内Ca2+的影响
黄鹤飞,陈颖,蔡维艳,李玉洁,杨庆,李琦,隋峰,刘思思,朱晓新*,陈涛*
(1. 三峡大学医学院,湖北 宜昌 443002; 2.中国中医科学院中药研究所,北京 100700;3.首都医科大学中医药学院,北京 100069)
研究报告
芍药苷对大鼠背根神经元细胞内Ca2+的影响
黄鹤飞1,陈颖2,蔡维艳2,李玉洁2,杨庆2,李琦2,隋峰2,刘思思3,朱晓新2*,陈涛1*
(1. 三峡大学医学院,湖北 宜昌443002; 2.中国中医科学院中药研究所,北京100700;3.首都医科大学中医药学院,北京100069)
【摘要】目的建立一种评价芍药苷对大鼠背根神经节神经元细胞内游离Ca2+浓度影响的方法。方法显微解剖获取大鼠背根神经节(DRG),通过胰蛋白酶消化,过筛,用DF-12和抗有丝分裂培养液交替培养纯化,获得原代大鼠DRG神经元细胞,并采用细胞免疫荧光技术测定DRG神经元细胞纯度;采用激光共聚焦显微成像技术,观察细胞内Ca2+荧光强度的变化,并对Ca2+荧光强度变化率进行分析,探讨芍药苷对DRG细胞内游离钙离子浓度及辣椒素受体的影响。结果采用上述方法分离得到的DRG细胞纯度可高达95%以上,辣椒平可通过阻断辣椒素激活的瞬时受体电位通道的作用而抑制细胞内Ca2+的增加。芍药苷表现出与辣椒平类似的作用,可以阻断细胞外Ca2+内流。结论芍药苷可能是通过作用于TRPV1通道,而抑制DRG细胞内Ca2+大量增加,本方法可以用于评价药物对大鼠DRG细胞内Ca2+浓度的影响。
【关键词】背根神经节;神经元;Ca2+;芍药苷;辣椒素受体;大鼠;疼痛
背根神经节(dorsal root ganglion,DRG)作为初级传入神经元胞体所在的部位,其神经元是躯体及内脏感觉信息传导的通路,在神经病理性疼痛的发生和维持中起着重要的作用。DRG神经元由大小不同、电生理特征各异的大、中和小神经元组成,体外原代培养的DRG神经元与活体DRG神经元十分相似,不仅能分泌传递感觉信息的神经调质和递质,可被低浓度辣椒素(capsaicin,CAP)和缓酶肽刺激兴奋[1],被前列腺素E2敏感化[2],还含有突触前调质的相关受体以及大量离子通路[3],可以广泛应用于离子通道、感觉生理学和疼痛相关机理研究。
对于肠易激综合征(irritable bowel syndrome,IBS)病人的继发性痛敏,CAP可通过增强DRG瞬时受体电位通道(transient receptor potential vanilloid 1,TRPV1)的作用加剧对温度的痛觉过敏[4]。TRPV1由6个跨膜蛋白(S1~S6)组成[6],S5和S6之间有一孔道区域,激活开放后,主要是大量的Ca2+内流,伴有极少量的Mg2+、Na+、K+、Cs+[5]。多种介质如内源性大麻素类物质、前列腺素、缓激肽都参与了TRPV1的激活,导致局部感觉神经递质的释放,并进一步激活效应细胞受体。TRPV1拮抗剂辣椒平(capsazepine,CPZ)可使痛觉过敏减弱,表明TRPV1的上调和敏感化在疼痛感觉的产生中有重要作用[6]。因此,DRG细胞内游离钙Ca2+与神经兴奋性及突触间信号传递密切关联。外界各种刺激会导致胞质Ca2+浓度的变化,胞内Ca2+水平高低直接影响着疼痛阈值[7]。神经元细胞内Ca2+参与疼痛信息的调控[8]。Ca2+通道在损伤区及神经节胞体的异常分布是导致各类神经纤维产生异位点活动的主要因素,应用合适的Ca2+通道阻滞剂,可有效阻止神经损伤后慢性痛的产生和抑制慢性痛[9]。
白芍是一味常用中药,具治胸腹胁肋疼痛,泻痢腹痛等功效。芍药苷(paeoniflorin,PF)为白芍中一种单萜类糖苷的主要成分,有抑制细胞内钙超载和抗神经毒性等活性[10]。PF对大鼠离体肠管和体胃运动亦呈抑制作用,并对抗毛果芸香碱所致离体肠管痉挛及催产素引起的子宫收缩,具有解痉、抗炎、镇静止痛等功效[11]。研究表明,PF可能是在临床上用于减轻IBS患者内脏疼痛的一种潜在的药物[12],对内脏痛觉过敏大鼠表现出镇痛作用。但是PF有关钙信号转导与病理性疼痛的关系尚不清楚,PF对DRG细胞内游离Ca2+的影响及作用机制尚未见报道。
近年来,激光共聚焦显微镜因为具有不损伤细胞同时对活组织、活细胞进行观察和测量[13]的优势,在医学和生物学研究方面的应用越来越广泛。本研究采用原代分离纯化的DRG神经元细胞,利用细胞免疫荧光技术对DRG神经元细胞进行了鉴定,选用新一代钙离子荧光探针试剂Fluo 4-AM,采用激光共聚焦显微成像技术,观察药物对细胞内Ca2+荧光强度的变化,并对Ca2+荧光强度变化率进行分析,探讨PF对DRG细胞内游离钙离子浓度及CPZ受体的作用。
1材料与方法
1.1材料
1.1.1动物
4周龄SPF级SD雄性大鼠10只,体重90~110 g,来源于中国食品药品检定研究院【SCXK(京)2014-0013】。在中国中医科学院中药研究所动物室屏障环境【SYXK(京)2010-0034】进行实验,实验过程按实验动物使用的3R原则给予人道的关怀,并通过中国中医科学院中药研究所动物实验伦理审查(编号20150410-01)。
1.1.2仪器
SW-CJ-2FD型双人单面净化工作台(苏州净化设备有限公司),MCO-20AC细胞培养箱(日本Sanyo公司),HZQ-X100恒温振荡培养箱(太仓市实验设备厂),FV1000型激光共聚焦显微镜(日本Olympus)。
1.1.3试剂
芍药苷(中国食品药品检定研究院)、辣椒平(MedChemExpress)、辣椒素(MedChemExpress)、Fluo 4-AM(DonjinDo)、ionomycin(碧云天)、EGTA(DonjinDo)、Leibovitz L-15 medium培养基(Thermo Scientific HyClone)、Neurobasal(Gibco)、B-27(Gibco)、神经生长因子(NGF,Sigma)、L-glutamine(Gibco)、胰蛋白酶(trypsin,HyClone)、5-氟-2-脱氧尿嘧啶核苷(Sigma)、尿苷(Sigma)、I型鼠尾胶原(Solarbio)、HBSS(Solarbio)、封闭用正常山羊血清工作液(康为世纪)、兔神经生长相关蛋白(GAP)-43多克隆抗体(abcam)、山羊抗兔IgG/FITC标记(中杉)。
1.2方法
1.2.1大鼠背根神经节(DRG)神经元细胞的培养与鉴定
取90~110g雄性SD大鼠,麻醉后取出胸腰段脊柱,并于体视显微镜下由椎管内侧逐个取出神经节及相连的神经根(前、后)根,置于4℃的L-15培养液中剪碎。然后将DRGs转移到青霉素瓶,加入0. 25%的胰蛋白酶在振荡培养箱中消化45 min(37℃,50 r/min),用FBS终止消化,吹打细胞悬液,70目细胞筛过滤,收集滤液,然后1000 r/min离心5 min,用常规培养基(含Neurobasal培养基、2% B-27,100 μg/LNGF, 2 mmol/L的谷氨酰胺)重悬细胞,以5×105个/mL密度接种于包被I型鼠尾胶原的激光共聚焦小皿中,放入37℃,5%CO2培养箱中培养。用常规培养基培养24h后,更换抗有丝分裂培养液(在常规培养基的基础上加入10-5mol/L的5-氟-2-脱氧尿嘧啶核苷酸和10-5mol/L的尿苷)培养3d,再次更换常规培养基培养。
取培养5 d的DRGn,吸除培养液,PBS清洗2次,多聚甲醛(40 g/L)室温下固定1 h,用PBS洗3次,换入山羊血清(40 ml/L)室温孵育30 min;然后吸除血清,加入抗GAP-43兔多克隆抗体(1∶300)孵育,4℃过夜后,PBS冲洗3次;滴加山羊抗兔IgG/FITC荧光二抗,37℃避光孵育1 h,PBS洗3次;滴加DAPI避光孵育1~2 min,PBS洗1遍;于激光共聚焦显微镜下观察。放大200倍下随机选取5个视野,计数细胞总数和DRG神经元数量,最后算出DRG神经元纯度(纯度=DRG神经元细胞总数/细胞总数)。
1.2.2激光共聚焦显微成像法检测DRG内Ca2+浓度
取培养5~6 d的DRG神经元细胞用于实验,吸除培养基,使用HBSS溶液洗涤细胞3次。然后用5 μmol/Lfluo 4-AM染色。放培养箱中孵育30 min。
随后用HBSS漂洗3遍。然后加入1 mL无钙镁HBSS溶液,保存在37℃培养箱中待测量。用激光共聚焦显微镜(吸收波长488 nm,发射波长526 nm),扫描细胞内Ca2+的荧光强度的变化。
在没有加任何药物刺激的情况下直接成像,记录荧光强度值F0。在测定F0值后,直接在共聚焦皿中加入20 μL Ca2+载体ionomycin(2 μg/mL),作用10 min使细胞内尚未与Ca2+结合的Fluo 4被Ca2+完全饱和。然后对同一视场成像,并实时观察以测量出其最大荧光强度Fmax。在测定值后,加入20 μL Ca2+螯合剂EGTA(2 μg/mL)作用10 min使Fluo 4完全游离。然后对同一个视场成像,并实时观察以测量出其最小荧光强度Fmin。
1.2.3DRG细胞Ca2+浓度的定量分析
单波长荧光检测技术测定神经元胞内游离态Ca2+浓度[Ca2+]i[14],其定量关系式如下,
(1)
其中,Kd为Fluo 4-AM与Ca2+反应的解离常数,生理条件下为360 nmol/L。F是DRG神经元仅加载Fluo 4-AM染料的荧光信号。Fmax是 Fluo4全部与Ca2+结合时的荧光强度(可以在终溶液中加入适量的Ca2+载体使胞内Ca2+饱和),Fmin是Fluo4完全未结合Ca2+时的荧光强度。
1.2.4PF及CPZ对DRG神经元细胞Ca2+浓度的影响
用培养5~6 d的DRGn细胞进行扫描,单次循环扫描时间为40 s,扫描次数为60 次。点击XY Repeat按钮开始多点扫描。培养皿内含有900 μL的细胞外液,在第三次扫描结束时加入100 μL的药物,继续扫描,扫描结束后选择对同一个视场成像,一般同时选择一个视野内5个形态完整,大小基本一致的DRGn细胞单独测定其荧光亮度的变化,记录各细胞内荧光强度数值。每皿内只加一次药物溶液,加药时间及位置保持一致。所加CPZ和CAP使药物终浓度依次为20、1 μmol/L,PF终浓度依次为1、5 μmol/L。
1.2.5CPZ和PF对CAP诱导的大鼠DRG细胞内游离钙离子增加的抑制作用
用20 μmol/L的CPZ或PF预孵育30 min后,加入5 μmol/Lfluo 4-AM孵育30 min;用HBSS漂洗3遍后加入0.9 mL无钙镁HBSS溶液,按照1.2.4项下方法用LSCM进行扫描,在第三次扫描结束时加入0.1 mLCAP,扫描结束后选择对同一个视场成像,同时选择一个视野内3个形态完整,大小基本一致的DRGn细胞单独测定其荧光亮度的变化,记录各细胞内荧光强度数值
2结果
2.1免疫细胞化学染色鉴定DRG神经元及纯度测定
如图1所示,原代培养获得的DRG神经元大小基本一致,纯度可达到95%以上,结果重现性良好。
2.2Ca2+的激光共聚焦显微成像分析
在没有加任何药物刺激的情况下直接成像,发现5 μmol/LFluo 4负载DRG神经元的相对荧光强度可呈现整个神经元细胞轮廓(图2),得到荧光强度F0。加入Ca2+载体ionomycin作用10 min后,发现同一细胞的相对荧光值明显增强,得最大荧光强度Fmax。再加入Ca2+螯合剂EGTA作用10 min后,可以看到DRG神经元的相对荧光强度比加入Ca2+载体时明显减弱,并且比未加药剂前的Ca2+荧光强度相对降低,测量出其最小荧光强度Fmin。根据公式(1)获得DRG神经元细胞中游离态Ca2+浓度为(152.19±20)nmol/L。所采用的激光共聚焦显微成像与定量分析方法实现了对DRG细胞内Ca2+浓度的定量测量。
2.3PF及CPZ对DRG神经元细胞Ca2+浓度的影响
根据DRG细胞荧光信号的激光显微扫描数值,采用F/F0比值的方法表示单个DRG细胞内钙离子荧光强度的变化,其中:F为加入药品溶液后胞内荧光强度的峰值,F0为加药前胞内荧光强度均值。每组在同一视野至少选择5个结构完整、大小合适的DRG细胞统计荧光强度。实验数据统计以平均值±标准差(mean±SEM)表示,实验数据用Olympus FV10-ASW 2.0 Viewer软件进行分析。对各组数据分别进行t检验,以P<0.05作为差异有显著性的检验标准。n表示测试细胞数。从大鼠DRG细胞内荧光强度变化率结果可发现:给予1 μmol/L CAP后,DRG细胞内Ca2+浓度显著增加;而加入20 μmol/L CPZ和1 μmol/L和5 μmol/L的PF后DRG细胞内Ca2+浓度有显著降低的趋势。
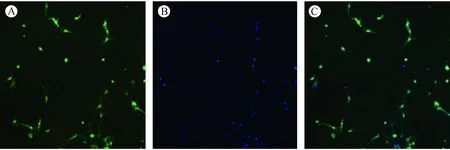
注A: 山羊抗兔IgG/FITC荧光二抗显色;B: DIPI染核;C:A+B。图1 免疫细胞化学染色鉴定DRG神经元细胞(×200)Note.A: Staining using goat anti-rabbit IgG / FITC fluorescent secondary antibodies;B: DIPI stained cell nucli;C:A+B.Fig.1 Immunocytochemical identification of the rat DRG neurons(×200)
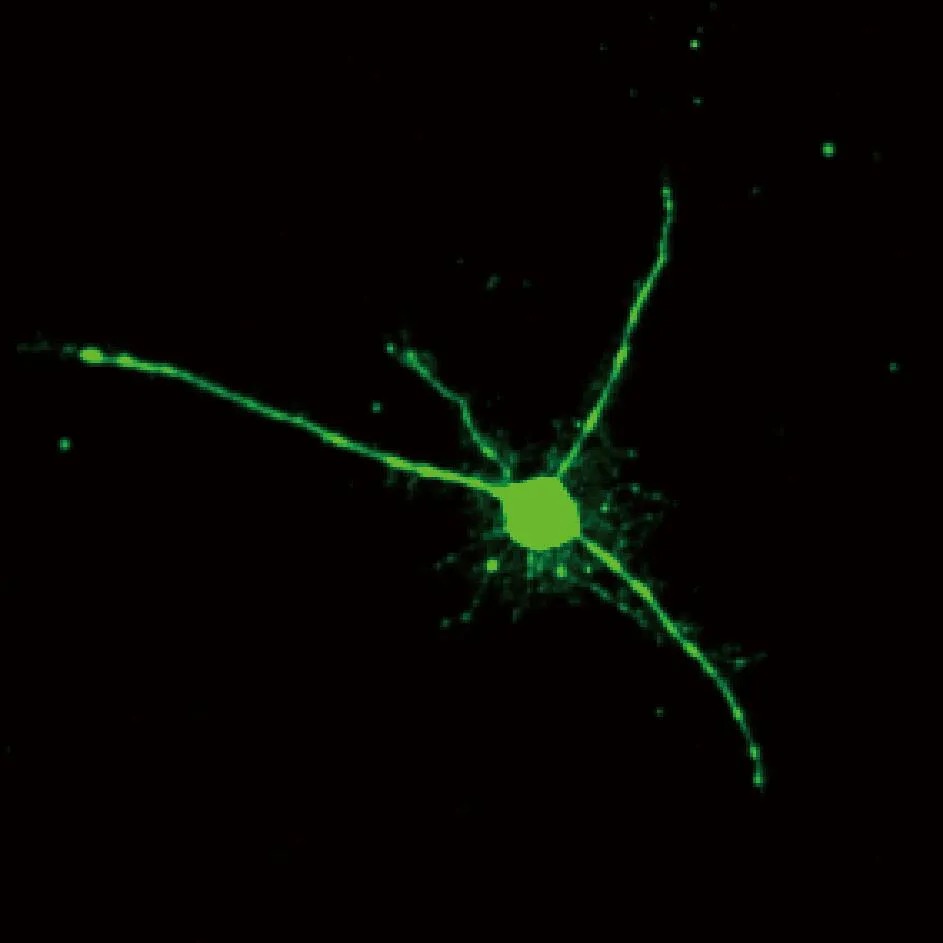
图2 大鼠DRG神经元细胞中Ca2+的激光共聚焦显微图像(×400)Fig.2 Confocal imaging of Ca2+ in a rat DRG cell(×400)

注:**与不加入药物的对照组比较P<0.01。n=5。图3 药物对DRG神经元细胞Ca2+浓度的影响Note.**Compared with the control group without addition of drug,P<0.01, n=5.Fig.3 Effect of drugs on the concentration of Ca2+ in the rat DRG neurons
2.4CPZ和PF对CAP诱导的大鼠DRG细胞内游离钙离子增加的抑制作用
用空白或含药物的HBSS培养液预孵育后,再加TRPV1激动剂CAP,比较了同一视野下3个细胞结构完整、大小均一,初始荧光强度在100~300a.u.范围内的DRG细胞内Ca2+荧光强度的变化结果可发现:与直接加入的CAP后DRG细胞内游离钙离子浓度明显升高(图4A)相比,在预孵育CPZ后再加入CAP,细胞内游离钙离子浓度没有变化(图4B);用PF预孵育后再加入CAP也表现出类似的趋势(图4C)。
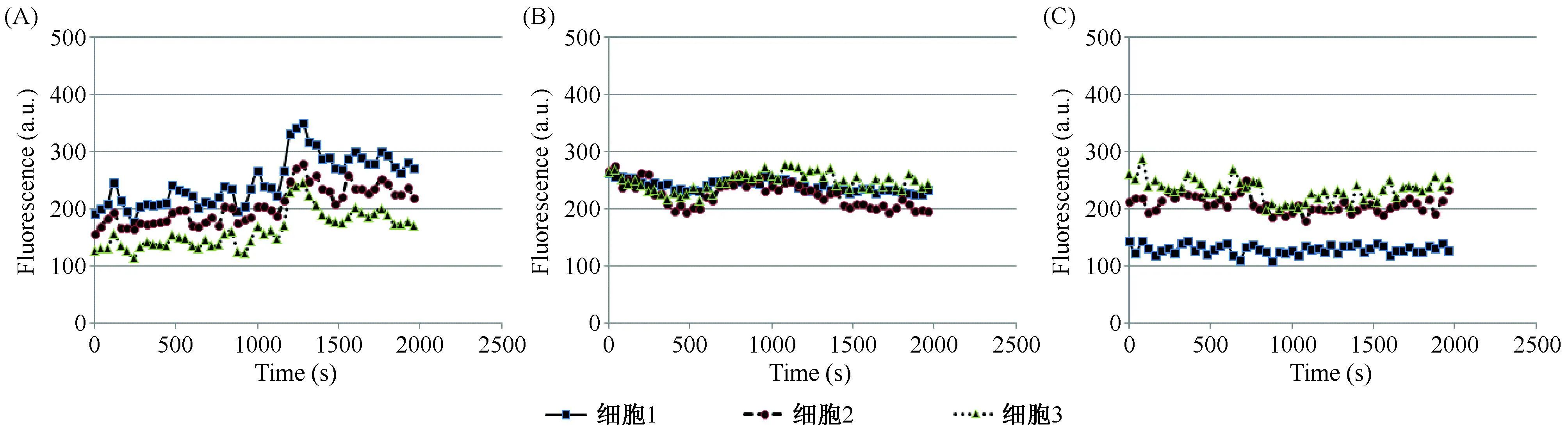
注:A:对照组;B:辣椒平给药组;C:芍药苷给药组。图4 药物预孵育对CAP诱导的大鼠DRG细胞内游离钙离子增加的抑制作用Note. A: Control;B: CPZ;C: PF.Fig.4 Effect of drugs on CPZ-induced intracellular Ca2+increase in the rat DRG neurons
3讨论
细胞内Ca2+在中枢神经系统功能及疼痛机制中起着重要作用,参与神经信号的传递和神经递质的释放。PF是毛茛科植物芍药中的主要活性成分之一,有解痉阵痛、抗炎等作用,其作用机制尚未明确,有研究显示其可能主要通过作用于Ca2+通道等发挥神经保护作用[15]。对肠易激综合征这种以腹痛、腹泻以及排便习惯改变为主要特征的疾病的研究认为,胃肠道动力异常和内脏痛觉高敏感是主要的病理生理学基础[16]。存在于背根神经节和三叉神经节,感受并传递伤害性冲动的伤害性感受器可将伤害性信息传递给中枢,产生痛觉及不适感。而TRPV1就是机体一个重要的伤害感受分子,广泛存在于这些感受器上参与中枢和外周水平疼痛的形成。因此,TRPV1有可能成为IBS内脏伤害性疼痛调节中极具前景的治疗靶点,TRPV1拮抗剂的体外筛选可有助于选择减低大鼠内脏敏感性的药物。因此,我们在本研究中采用PF为示范性活性成分,通过探索药物对DRG细胞内游离钙离子浓度的影响,以及对TRPV1通道激动剂CAP诱导的DRG细胞内Ca2+浓度增加的抑制作用,建立一种体外的从中药活性成分中筛选TRPV1拮抗剂的方法,为治疗IBS的中药的物质基础研究提供参考。外界的各种刺激会导致DRG细胞内Ca2+浓度及其空间分布发生变化,本研究中5 μmol/L Fluo 4负载DRG神经元后,其相对荧光强度可清晰的呈现整个神经元细胞轮廓,计算得到的静息状态的DRG细胞内Ca2+浓度为(152.19±20)nmol/L,与文献采用Fluo 2测量得到的100~125 nmol/L,从Fluo 3测量得到的(129.7±21)nmol/L基本接近。
由于低浓度CAP(ED50<1×10-7mol/L)可激活DRG神经元表达的TRPV1受体而导致Ca2+内流,而高浓度的CAP(3×10-5~1×10-4mol/L)可对感觉神经元产生毒性作用[17]。在本体外模型中,采用了1 μmol/L的CAP作为TRPV1激动剂,在给药后DRG细胞内Ca2+逐渐增高,到20~25 min达到峰值;而20 μmol/L的TRPV1拮抗剂CPZ能在给药后40 min内显著起到抑制作用。在本模型中选择筛选的中药活性成分的浓度范围限制在0.1~5 μmol/L。
综上所述,PF可能通过影响神经元细胞内TRPV1通道,起Ca2+通道阻滞剂样作用,降低IBS患者神经病理性疼痛。本研究建立的评价药物对大鼠DRG细胞内Ca2+浓度的影响方法可能成为一种治疗肠易激综合征的药物筛选方法。
参考文献
[1]杨向东, 刘花香, 刘真, 等.辣椒素对背根神经节神经元钙离子浓度和线粒体膜电位的影响[J]. 山东大学学报(医学版), 2008, 46(3): 264-267.
[2]St-Jacques B, Ma WY. Peripheral prostaglandin E2 prolongs the sensitization of nociceptive dorsal root ganglion neurons possibly by facilitating the synthesis and anterograde axonal trafficking of EP4 receptors[J]. Exp Neurol, 2014, 261(0): 354-366.
[4]Albin KC,Carstens MI, Carstens E. Modulation of oral heat and cold pain by irritant chemicals[J]. Chem Senses, 2008, 33(1): 3-15.
[5]Cortright DN, Szallasi A. Biochemical pharmacology of the vanilloid receptor TRPV1[J]. Eur J Biochem, 2004, 271(10): 1814-1819.
[6]Ro JY, Lee JS, Zhang Y. Activation of TRPV1 and TRPA1 leads to muscle nociception and mechanical hyperalgesia[J]. Pain, 2009, 144(3): 270-277.
[7]Ghosh A, Greenberg ME. Calcium signaling in neurons: molecular mechanisms and cellular consequences[J]. Science, 1995, 268(5208): 239-247.
[8]陈蓓蕾, 于布为.钙离子在疼痛和抗伤害性感受中的作用[J]. 国际麻醉学与复苏杂志, 2006, 27(3): 170-173.
[9]谢益宽.慢性病的发病机理[J]. 医学研究通讯, 1999, 28(2): 1-32.
[10]郑世存, 李晓宇, 欧阳兵, 等.芍药苷药理作用研究新进展[J]. 中国药物警戒, 2012, 9(2): 100-103.
[11]韩连凤.中药白芍的止痛作用[J]. 黑龙江医药, 2006, 19(3): 219.
[12]ZhangXJ, LiZ, LeungWM, et al. The analgesic effect of paeoniflorin on neonatal maternal separation-induced visceral hyperalgesia in rats[J]. J Pain, 2008, 9(6): 497-505.
[13]吴莹, 陈向阳, 玄子男, 等. HPLC、HPLC-MS在经方成分分析及Co-IP、激光共聚焦在经方药理机制研究中的应用[J]. 世界中医药, 2015, 10(1): 7-12.
[14]张小玲,鲍霞,贾宏瑛,等.细胞Ca2+测定研究进展[J]. 咸阳师范学院学报, 2002, 17(6): 19-26.
[15]胡增峣.芍药苷作用于神经系统的研究进展[J]. 中国中药杂志, 2013, 38(3): 297-301.
[16]樊江波, 畅洪昇, 董世芬,等. 慢性应激致肠易激综合征大鼠模型的建立与评价 [J]. 中国实验动物学报, 2010, 18(2): 91-95.
[17]Chard PS, Bleakman D, Savidge JR, et al. Capsaicin-induced neurotoxicity in cultured dorsal root ganglion neurons: Involvement of calcium-activated proteases[J]. Neuroscience, 1995, 65(4): 1099-1108.
科技工作者科学道德规范(二)
学术不端行为
第十八条 学术不端行为是指,在科学研究和学术活动中的各种造假、抄袭、剽窃和其他违背科学共同体惯例的行为。
第十九条 故意做出错误的陈述,捏造数据或结果,破坏原始数据的完整性,篡改实验记录和图片,在项目申请、成果申报、求职和提职申请中做虚假的陈述,提供虚假获奖证书、论文发表证明、文献引用证明等。
第二十条 侵犯或损害他人著作权,故意省略参考他人出版物,抄袭他人作品,篡改他人作品的内容;未经授权,利用被自己审阅的手稿或资助申请中的信息,将他人未公开的作品或研究计划发表或透露给他人或为己所用;把成就归功于对研究没有贡献的人,将对研究工作做出实质性贡献的人排除在作者名单之外,僭越或无理要求著者或合著者身份。
第二十一条 成果发表时一稿多投。
第二十二条 采用不正当手段干扰和妨碍他人研究活动,包括故意毁坏或扣压他人研究活动中必需的仪器设备、文献资料,以及其它与科研有关的财物;故意拖延对他人项目或成果的审查、评价时间,或提出无法证明的论断;对竞争项目或结果的审查设置障碍。
第二十三条 参与或与他人合谋隐匿学术劣迹,包括参与他人的学术造假,与他人合谋隐藏其不端行为,监察失职,以及对投诉人打击报复。
第二十四条 参加与自己专业无关的评审及审稿工作;在各类项目评审、机构评估、出版物或研究报告审阅、奖项评定时,出于直接、间接或潜在的利益冲突而作出违背客观、准确、公正的评价;绕过评审组织机构与评议对象直接接触,收取评审对象的馈赠。
第二十五条 以学术团体、专家的名义参与商业广告宣传。
(待续)
Effect of paeoniflorin on the calcium concentration in rat dorsal root ganglion neurons
HUANG He-fei1,CHEN Ying2,CAI Wei-yan2,LI Yu-jie2,YANG Qing2,LI Qi2,SUI Feng2,LIU Si-si3,ZHU Xiao-xin2,CHEN Tao1
(1. School of Medicine, China Three Gorges University, Yichang 443002, China;
2. Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences, Beijing 100700;
3. School of Traditional Chinese Medicine, Capital Medical University,Beijing 100069)
【Abstract】ObjectiveTo establish a method to evaluate the effect of paeoniflorin (PF)on free calcium (Ca2+)concentration in dorsal root ganglion (DRG)neurons in rats. MethodsDRGs were obtained by microdissection, then were digested by trypsin and sieved.The dissociated neurons were alternately cultured and purified with DF-12 and anti-mitotic culture medium to obtain primary rat DRG neurons, and the purity of DRG neurons was measured by immunofluorescence technique. The fluorescence intensity of Ca2+in DRGs was observed by laser confocal microscopy (LSCM)imaging, and the changes of fluorescence intensity were analyzed to explore the effects of PF on DRG intracellular free calcium concentration and capsaicin receptor. ResultsThe purity of DRG cells isolated by the above mentioned method was up to 95%.Capsazepine(CAP)inhibited the increase of intracellular Ca2+by blocking the capsaicin-activated transient receptor potential vanilloid 1 (TRPV1). PF exhibited the influx of extracellular Ca2+. ConclusionsWe would hypothesize that PF probably inhibits the significant increase of Ca2+in DRG cells by acting on TRPV1 channel, and the method established in this study can be used to evaluate the effects of drugs on Ca2+concentration in rat dorsal root ganflion neurons.
【Key words】Dorsal root ganglion;Neurons; Ca2+; Paeoniflorin;Capsaicin receptor; Pain; Rat
[收稿日期]2015-08-04
Corresponding author:ZHU Xiao-xin, E-mail:zhuxiaoxin@icmm.ac.cn;CHEN Tao,E-mail:chentao@ctgu.edu.cn
Doi:10.3969/j.issn.1005-4847.2016.01.005
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016) 01-0025-06
[作者简介]黄鹤飞(1989-),女,硕士研究生,专业:药理学。Email: hhflying7@163.com[通讯作者]朱晓新(1959-),男,研究员,研究方向:中药药理学和中药药代动力学,Tel:010-64056154,E-mail: zhuxiaoxin@icmm.ac.cn;陈涛(1962-),男,教授,研究方向:中药药理学以及恶性肿瘤的中医基础理论和防治机理研究,Tel:0717-6397378,E-mail: chentao@ctgu.edu.cn。
[基金项目]国家自然基金青年基金(编号:81403171);中国中医科学院中药研究所自选课题(编号:zz2014024、zz2014068、QZPT001)。

