CYP3A4*1G依赖的CYP3A4内含子10启动的真核表达载体的构建*
赵云龙,杨卫红,闫 良,魏璐嫚,王 沛, 张 卫,曾昭书#,张莉蓉#
1)郑州大学基础医学院法医学教研室 郑州 450001 2)郑州大学基础医学院药理学教研室 郑州 450001 3)郑州大学药学院药理学系 郑州 450001 4)郑州大学第一附属医院麻醉科 郑州 450052
CYP3A4*1G依赖的CYP3A4内含子10启动的真核表达载体的构建*
赵云龙1),杨卫红1),闫良2),魏璐嫚2),王沛3), 张卫4),曾昭书1)#,张莉蓉2)#
1)郑州大学基础医学院法医学教研室 郑州 4500012)郑州大学基础医学院药理学教研室 郑州 4500013)郑州大学药学院药理学系 郑州 4500014)郑州大学第一附属医院麻醉科 郑州 450052
关键词CYP3A4;真核表达载体;启动子;内含子
摘要目的:构建CYP3A4*1G依赖的CYP3A4内含子10启动的真核表达载体,研究CYP3A4*1G依赖的CYP3A4内含子10的启动子功能。方法:以质粒pGEM-CYP3A4为模板扩增出CYP3A4 cDNA,PCR产物经EcoRV、XbaⅠ双酶切后插入到pcDNA3.1/Hygro(+)的EcoRV、XbaⅠ双酶切位点之间,构建pcDNA3.1-3A4。分别以人基因组DNA和pGEM-CYP3A4质粒DNA为模板,扩增出CYP3A4启动子和CYP3A4内含子10全长(野生型和突变型)序列,插入到pcDNA3.1-3A4的MluⅠ、NheⅠ双酶切位点之间,取代原有的CMV启动子,构建pcDNA3.1-P3A4、pcDNA3.1-W3A4(野生型)和pcDNA3.1-M3A4(突变型)。将质粒转染入HepG2细胞,检测CYP3A4 mRNA表达水平。结果:构建的重组质粒经酶切验证与测序鉴定,插入片段的序列和方向与预期完全一致。与转染pcDNA3.1/Hygro(+)的HepG2细胞比较,pcDNA3.1-P3A4、pcDNA3.1-W3A4、pcDNA3.1-M3A4转染组细胞CYP3A4 mRNA表达水平均提高(P<0.05),但pcDNA3.1-M3A4组表达水平低于pcDNA3.1-P3A4和pcDNA3.1-W3A4组(P<0.05)。结论:成功构建了CYP3A4*1G依赖的CYP3A4内含子10启动的真核表达载体;CYP3A4内含子10能够启动CYP3A4基因的表达,且存在CYP3A4*1G等位基因依赖性。
Construction of eukaryotic expression vector of CYP3A4 intron 10 promoter regulated by CYP3A4*1G
ZHAOYunlong1),YANGWeihong1),YANLiang2),WEILuman2),WANGPei3),ZHANGWei4),ZENGZhaoshu1),ZHANGLirong2)
1)DepartmentofForensicMedicine,SchoolofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou4500012)DepartmentofPharmacology,SchoolofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou4500013)DepartmentofPharmacology,SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou4500014)DepartmentofAnesthesiology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsCYP3A4;eukaryotic expression vector;promoter;intron
AbstractAim: To construct CYP3A4 eukaryotic expression vector which promoted by CYP3A4 intron 10 regulated by CYP3A4*1G.Methods: The segment of CYP3A4 cDNA was amplified from plasmid pGEM-CYP3A4 by PCR,and the PCR product was digested withEcoRV andXbaⅠ and ligated into pcDNA3.1/Hygro(+) to obtain vector pcDNA3.1-3A4. The segment of CYP3A4 promoter and that of the full-length of CYP3A4 intron 10 with CYP3A4*1G allele were amplified from human genome DNA and pGEM-CYP3A4,respectively,then were ligated into pcDNA3.1-3A4 between the sites of restriction enzymeMluⅠ andNheⅠ replacing the CMV promoter,to obtain pcDNA-P3A4,pcDNA3.1-W3A4 and pcDNA3.1-M3A4. The vectors were transfected into HepG2, respectively,and the levels of CYP3A4 mRNA were detected by quantitative real-time PCR. Results: These insertion sequences and their directions were exactly correct. The CYP3A4 mRNA level of CYP3A4 promoter transfection group, intron 10 (GG) group, intron 10 (AA) transfection group were all higher compared with empty plasmid transfection group. The CYP3A4 mRNA level of intron 10 (AA) group was lower than those of CYP3A4 promoter group and intron 10 (GG) group (P<0.05).Conclusion: CYP3A4 eukaryotic expression vector promoted by CYP3A4 intron 10 regulated by CYP3A4*1G has been constructed successfully. CYP3A4 intron 10 could promote CYP3A4 mRNA expression, which is regulated by CYP3A4*1G allele.
CYP3A4是CYP3A亚家族中最主要的成员,占P450酶系总量的30%~40%,主要分布在肝脏和肠道。它参与了许多药物和外源性毒物的氧化代谢,可代谢约50%的临床常用药物。研究[1-2]表明,人肝脏中CYP3A4的表达及其活性存在着明显的个体差异,并且这种差异90%与遗传多态性有关。CYP3A4*1G(rs2242480)是CYP3A4内含子10中的一个单核苷酸多态性(SNP),其等位基因频率在亚洲和南非人群中超过20%[3-5]。研究[5-10]表明CYP3A4*1G与阿托伐他汀、环孢霉素、他克莫司、芬太尼等药物的剂量、疗效及药代动力学改变有关。前期体外研究[11]发现,在HepG2细胞中CYP3A4内含子10具有启动子活性,并被CYP3A4*1G等位基因依赖性调控,但CYP3A4*1G调控的CYP3A4内含子10与CYP3A4基因表达之间的关系尚不清楚。该研究分别构建了由CYP3A4启动子和CYP3A4*1G依赖的CYP3A4内含子10启动的CYP3A4真核表达载体,并将其转染入HepG2细胞,检测CYP3A4 mRNA的表达情况。
1材料与方法
1.1材料pcDNA3.1/Hygro(+)空质粒、pGEM-CYP3A4为浙江大学药学院药物分析与药物代谢研究室曾苏教授惠赠。携带CYP3A4*1G(GG/AA)的基因组DNA来自河南汉族健康志愿者,由郑州大学基础医学院药理教研室保存。质粒小提试剂盒(Axygen公司),胶回收试剂盒(天根生化科技有限公司),限制性内切酶(NEB公司),T4 DNA连接酶(TaKaRa公司),PrimeSTAR®Max DNA 聚合酶、感受态DH5α和反转录试剂;TriPure Isolation试剂(罗氏公司);SYBR SELECT MASTER MIX(Life公司)、Invitrogen lip2000。PCR引物由宝生物工程(大连)有限公司合成。仪器设备主要有超净工作台、PCR扩增仪、NanoDrop 2000c分光光度计、37 ℃摇床、离心机、水平电泳仪、ABI 7500Fast实时荧光定量PCR仪等。
1.2质粒扩增将pcDNA3.1/Hygro(+)空质粒、pGEM-CYP3A4质粒分别转化到DH5α感受态细胞内,使其随细胞的繁殖而复制扩增,然后用质粒小提试剂盒提取质粒并测定浓度备用。
1.3目的片段的扩增、纯化及回收根据NCBI数据库中CYP3A4 cDNA(NM_017460.5)设计引物,在上、下游引物的5’端分别加上EcoRV和XbaⅠ酶切位点和保护碱基。根据NCBI数据库中CYP3A4基因(AF280107)5’端上游启动子区序列设计引物,在上、下游引物的5’端分别加上MluⅠ和NheⅠ酶切位点和保护碱基。根据CYP3A4基因(AF280107)内含子10全长序列设计引物,在上、下游引物的5’端分别加上MluⅠ和NheⅠ酶切位点和保护碱基。PCR引物序列见表1。扩增CYP3A4 cDNA所用模板为pGEM-CYP3A4质粒DNA,扩增 CYP3A4启动子、CYP3A4内含子10所用模板为人类基因组DNA。PCR反应体系:PrimeSTAR®Max DNA聚合酶(2×) 25 μL,上、下游引物各3 μL,模板DNA 4 μL,超纯水补至50 μL。反应条件为98 ℃10 s,65 ℃15 s,72 ℃2 min,30个循环。PCR产物经10 g/L琼脂糖凝胶电泳后,按胶回收试剂盒说明书操作,回收目的片段并测浓度。
1.4pcDNA3.1-3A4重组质粒的构建用EcoRV和XbaⅠ双酶切空质粒pcDNA3.1/Hygro(+)、PCR产物CYP3A4 cDNA片段,纯化回收后测DNA浓度,16 ℃连接过夜。连接产物转化到DH5α感受态细胞,涂在含氨苄青霉素 (100 mg/L) 的LB固体培养基上,根据培养板菌落生长情况挑取单克隆,提取质粒DNA,用BamHⅠ进行酶切验证。阳性质粒pcDNA3.1-3A4送立菲生物技术有限公司测序。
1.5CYP3A4启动子及CYP3A4*1G依赖的CYP3A4内含子10启动的真核表达载体的构建用MluⅠ和NheⅠ双酶切重组质粒pcDNA3.1-3A4、PCR产物CYP3A4启动子及内含子10 DNA片段,纯化回收测DNA浓度,16 ℃连接过夜。然后转化、筛选、提取质粒,质粒DNA用MluⅠ和NheⅠ双酶切验证。阳性质粒pcDNA3.1-P3A4(CYP3A4启动子重组质粒)、pcDNA3.1-W3A4(CYP3A4内含子10野生型重组质粒)和pcDNA3.1-M3A4(CYP3A4内含子10突变型重组质粒)送立菲生物技术有限公司测序,测序结果用DNAMAN软件与预期序列比对。载体构建示意图见图1。

表1 扩增目的片段所用引物
F表示上游引物,R表示下游引物,下划线表示酶切位点。

图1 载体构建流程
1.6重组质粒转染细胞中CYP3A4 mRNA的检测
将按1.5方法构建的3种质粒及空质粒pcDNA3.1/Hygro(+)分别转染入HepG2细胞,48 h后收集细胞,采用实时荧光定量PCR检测CYP3A4 mRNA的表达水平。以GAPDH为内参,用ΔΔCT法计算CYP3A4 mRNA表达水平。
1.7统计学处理应用SPSS 21.0对数据进行分析,4组间CYP3A4 mRNA表达水平的比较采用单因素方差分析和LSD-t检验,检验水准α=0.05。
2结果
2.1构建的重组质粒的鉴定重组质粒pcDNA3.1-3A4的BamHⅠ酶切结果见图2,目的条带介于500 bp与750 bp之间。重组质粒pcDNA3.1-P3A4、pcDNA3.1-W3A4、pcDNA3.1-M3A4的MluⅠ和NheⅠ双酶切结果见图3,目的条带介于1 000 bp与2 000 bp之间。酶切结果均与预期片段长度相符。测序结果显示均正确。

M:marker;1~3:pcDNA3.1-3A4。图2 pcDNA3.1-3A4酶切结果

M:marker;1:pcDNA3.1-P3A4;2:pcDNA3.1-W3A4;3:pcDNA3.1-M3A4。图3 pcDNA3.1-P3A4、pcDNA3.1-W3A4、pcDNA3.1-M3A4的双酶切结果
2.2转染细胞中CYP3A4 mRNA表达水平的比较
4种重组质粒转染的HepG2细胞中CYP3A4 mRNA表达水平测定结果见表2。
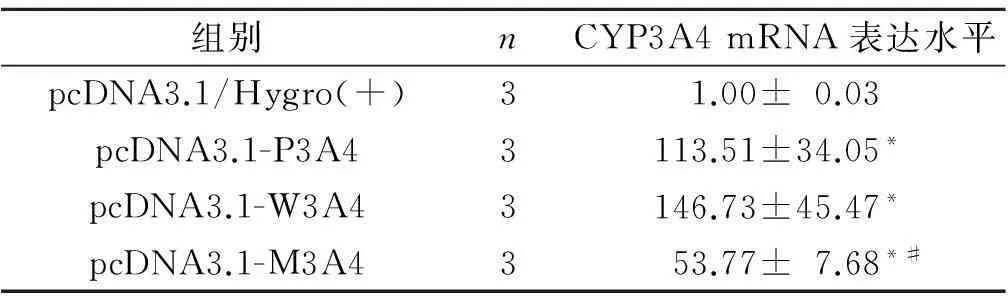
表2 4组细胞中CYP3A4 mRNA表达水平
4组比较,F=15.218,P=0.001;*:与pcDNA3.1/Hygro(+)组相比,P<0.05;#:与pcDNA3.1-P3A4和pcDNA3.1-W3A4组相比,P<0.05。
3讨论
启动子一般位于基因的上游,能够与RNA聚合酶特异性结合从而启动转录。研究[12]发现,一个基因的表达可以同时受多个启动子调控,且不同的启动子转录效率不同。有研究[13-14]报道一些内含子具有启动子活性,可调控基因的表达。该课题组前期通过双荧光素酶报告基因研究发现,与药物代谢密切相关的CYP3A4基因,除了5’端启动子外,其内含子10也具有启动子功能,并具有CYP3A4*1G等位基因依赖性[11]。基因的表达往往受多方面因素的影响,构建cDNA重组质粒并用于细胞转染可以排除其他调控序列对目的基因表达的干扰,从而有效地验证某一DNA片段或SNP对目的基因表达的影响。有文献[15]报道将内含子嵌入真核表达载体,可通过测定外源基因的表达研究其功能。为验证CYP3A4内含子10是否对CYP3A4基因表达有影响,该研究构建了一系列真核表达载体。
重组质粒中的目的片段是否正确连入载体,需要经过测序验证。在测序之前往往先进行菌液PCR或酶切初步验证。菌液PCR在初筛过程中比较方便而且更为经济,但可能存在非特异性扩增,导致假阳性,不如酶切结果可靠。该研究采用酶切验证。值得注意的是,由于pcDNA3.1-3A4重组质粒构建完成后,XbaⅠ酶切位点前方5’端插入了两个碱基GA,形成了GATC序列,该序列能够被Dam甲基化酶识别,在腺嘌呤N6位置引入甲基,从而导致酶切受阻形成假阴性。为此,实验中进行BamHⅠ单酶切验证。由于pcDNA3.1/Hygro(+)空质粒与CYP3A4 cDNA各有一个BamHⅠ酶切位点,CYP3A4 cDNA插入EcoRV-XbaⅠ处后,二者相距686 bp,用BamHⅠ酶切后电泳图上显示酶切结果介于500 bp与750 bp之间者为阳性。
细胞转染实验结果表明,CYP3A4内含子10能够有效地启动CYP3A4基因的表达,并存在CYP3A4*1G等位基因依赖性,CYP3A4*1G突变型(AA)启动子活性低于野生型(GG)。
总之,该研究成功构建了由CYP3A4启动子及CYP3A4*1G依赖的CYP3A4内含子10启动的CYP3A4真核表达载体,并从细胞水平进一步证实了CYP3A4*1G依赖的内含子10可启动CYP3A4 mRNA的表达,为CYP3A4内含子10及CYP3A4*1G的功能与机制研究奠定了基础,为从内含子基因调控角度阐明CYP3A4酶活性的个体差异提供了新的理论依据。
参考文献
[1]RAHMIOGLU N,HEATON J,CLEMENT G,et al.Genetic epidemiology of induced CYP3A4 activity[J].Pharmacogenet Genomics,2011,21(10):642
[2]OZDEMIR V,KALOW W,TANG BK,et al.Evaluation of the genetic component of variability in CYP3A4 activity: a repeated drug administration method[J].Pharmacogenetics,2000,10(5):373
[3]FUKUSHIMA-UESAKA H,SAITO Y,WATANABE H,et al.Haplotypes of CYP3A4 and their close linkage with CYP3A5 haplotypes in a Japanese population[J].Hum Mutat,2004,23(1):100
[4]DRÖGEMÖLLER B,PLUMMER M,KORKIE L,et al.Characterization of the genetic variation present in CYP3A4 in three South African populations[J].Front Genet,2013,4:17
[5]GAO Y,ZHANG LR,FU Q.CYP3A4*1G polymorphism is associated with lipid-lowering efficacy of atorvastatin but not of simvastatin[J].Eur J Clin Pharmacol,2008,64(9):877
[6]ZHANG W,CHANG YZ,KAN QC,et al.CYP3A4*1G genetic polymorphism influences CYP3A activity and response to fentanyl in Chinese gynecologic patients[J].Eur J Clin Pharmacol,2010,66(1):61
[7]HE BX,SHI L,QIU J,et al.The effect of CYP3A4*1G allele on the pharmacokinetics of atorvastatin in Chinese Han patients with coronary heart disease[J].J Clin Pharmacol,2014,54(4):462
[8]HU YF,TU JH,TAN ZR,et al.Association of CYP3A4*18B polymorphisms with the pharmacokinetics of cyclosporine in healthy subjects[J].Xenobiotica,2007,37(3):315
[9]MIURA M,SATOH S,KAGAYA H,et al.Impact of the CYP3A4*1G polymorphism and its combination with CYP3A5 genotypes on tacrolimus pharmacokinetics in renal transplant patients[J].Pharmacogenomics,2011,12(7):977
[10]石伟龙,唐惠林,翟所迪.CYP3A4* 1G基因多态性对肾移植受者他克莫司给药剂量及血药浓度影响的系统评价[J].中国临床药理学杂志,2015,31(4):292
[11]YANG W,ZHAO D,HAN S,et al.CYP3A4*1G regulates CYP3A4 intron 10 enhancer and promoter activity in an allelicdependent manner[J].Int J Clin Pharmacol Ther,2015,53(8):647
[12]CHEN J,HAYES P,ROY K,et al.Two promoters regulate transcription of the mouse folylpolyglutamate synthetase gene-three tightly clustered Sp1 sites within the first intron markedly enhance activity of promoter B[J].Gene,2000,242(1/2):257
[13]DONG ZL,LI H,CHEN QX,et al.Characterization of the promoter and 5’-UTR intron of oleic acid desaturase(FAD2)gene inBrassicanapus[J].Gene,2014,545(1):45
[14]MOHAPATRA C,BARMAN HK.Identification of promoter within the first intron of Plzf gene expressed in carp spermatogonial stem cells[J].Mol Biol Rep,2014,41(10):6433
[15]KIM SY,LEE JH,SHIN HS,et al.The human elongation factor 1 alpha(EF-1 alpha) first intron highly enhances expression of foreign genes from the murine cytomegalovirus promoter[J].J Biotechnol,2002,93(2):183
中图分类号R394.6;Q756
#通信作者:张莉蓉,女,1964年10月生,博士,教授,博士研究生导师,研究方向:药物基因组学,E-mail:zhanglirongzzu@126.com;曾昭书,男,1973年5月生,博士,教授,硕士研究生导师,研究方向:法医遗传学,E-mail:zzs@zzu.edu.cn
doi:10.13705/j.issn.1671-6825.2016.02.004
*国家自然科学基金项目81173127,81171060;河南省杰出青年基金项目074100510020;河南省教育厅基础研究项目13A310663;河南省
科技厅基础与前沿技术研究计划项目142300410206

