黄芪甲苷对过氧化氢诱导损伤的人脐静脉内皮细胞的保护作用
马海涛,王 辉
1)河南中医学院第一附属医院周围血管科 郑州 450000 2)河南中医学院药学院中药教研室 郑州 450000
△男,1969年6月生,本科,副主任医师,研究方向:中西医结合治疗周围血管疾病,E-mail:mahaitao6968@126.com
黄芪甲苷对过氧化氢诱导损伤的人脐静脉内皮细胞的保护作用
马海涛1)△,王辉2)
1)河南中医学院第一附属医院周围血管科 郑州 4500002)河南中医学院药学院中药教研室 郑州 450000
△男,1969年6月生,本科,副主任医师,研究方向:中西医结合治疗周围血管疾病,E-mail:mahaitao6968@126.com
关键词下肢缺血;血管内皮细胞;DNA损伤;黄芪甲苷;Wnt/β-catenin信号通路
摘要目的:探讨黄芪甲苷对过氧化氢诱导损伤的人脐静脉内皮细胞(HUVECs)的保护作用,并初步探讨其作用机制。方法:实验Ⅰ中取HUVECs后分为5组,其中4组分别给予不同质量浓度的黄芪甲苷预处理后,用过氧化氢诱导建立HUVECs损伤模型,对照组不处理。实验Ⅱ中另取HUVECs分为4组,即对照组、LiCl组、黄芪甲苷组及LiCl+黄芪甲苷组,后3组按分组处理后均同上用过氧化氢诱导。采用MTT法检测上述各组细胞存活情况,流式细胞术检测细胞凋亡,Western blot分析γ-H2AX、β-catenin蛋白的表达。结果:过氧化氢可抑制HUVECs存活,诱导其凋亡,而黄芪甲苷可改善上述情况(P<0.05)。Wnt通路激动剂LiCl预处理后,黄芪甲苷对损伤HUVECs的保护作用减弱,同时DNA损伤标记分子γ-H2AX以及β-catenin蛋白的表达水平升高(P<0.05)。结论:黄芪甲苷可缓解氧化应激诱导的HUVECs损伤,其机制可能与抑制Wnt/β-catenin信号通路有关。
Protective effects of astragaloside on injured human umbilical vein endothelial cells induced by H2O2
MAHaitao1),WANGHui2)
1)DepartmentofPeripheralVascular,theFirstAffiliatedHospital,HenanUniversityofTraditionalChineseMedicine,Zhengzhou4500002)DepartmentofTraditionalChineseMedicine,CollegeofPharmacy,HenanUniversityofTraditionalChineseMedicine,Zhengzhou450000
Key wordshindlimb ischemia;vascular endothelial cell;DNA injury;astragaloside;Wnt/β-catenin signaling pathway
AbstractAim: To study the effect and the underlying mechanism of astragaloside on injured human umbilical vein endothelial cells(HUVECs) induced by H2O2. Methods: In experiment Ⅰ, HUVECs were allocated into 5 groups,among which, 4 groups were pretreated by astragaloside at different doses and then treated by H2O2,and the control group was not treated. In experiment Ⅱ, HUVECs were allocated into 4 groups as control group, LiCl group, astragaloside group, and LiCl+astragaloside group and treated accordingly,and then they were treated by H2O2,and the control group was not treated.MTT assay was used to assess the survival of HUVECs, and cell apoptosis was analyzed by flow cytometry. Furthermore, the expression levels of γ-H2AX and β-catenin protein were detected by Western blot. Results: Astragaloside attenuated the inhibitory effect of H2O2on cell survival and down-regulated the apoptosis rate of HUVECs induced by H2O2. Further mechanism analysis showed that pretreatment with LiCl attenuated the protecting effect of astragaloside on HUVECs with an obvious increase in the expression levels of γ-H2AX and β-catenin protein(P<0.05). Conclusion: Astragaloside could protect the HUVECs from oxidative stress mainly by regulating the Wnt/β-catenin signaling pathway.
下肢缺血性疾病在周围血管疾病(peripheral artery disease,PAD)中最为常见,部分甚至可发展成严重肢体缺血,患者最后不得不承受截肢的痛苦,严重影响患者的生活质量[1]。目前临床上治疗下肢缺血的方法主要有药物治疗和手术治疗等,但效果并不理想。研究[2]证实,血管阻塞后大量的氧自由基诱发的内皮细胞DNA损伤是影响下肢缺血病理进程的重要因素。黄芪甲苷是黄芪的主要活性成分,是一种相对分子质量较小的皂苷,有保护血管、抗衰老、抗氧化等作用[3-4]。近年研究[5-6]表明,中药黄芪可有效恢复3,4苯并芘诱导的内皮祖细胞功能损伤,并参与糖尿病血管重构等多种疾病的病理进程,对由内皮功能障碍引起的一些心血管疾病的防治具有重要作用。该研究中作者建立了过氧化氢诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)氧化应激损伤细胞模型,模拟血管阻塞后氧自由基诱发的HUVECs损伤,观察不同质量浓度的黄芪甲苷预处理对HUVECs的保护作用,并进一步探讨其可能的作用机制。
1材料与方法
1.1材料HUVEC细胞株(中科院上海细胞库),DMEM高糖培养液(Gibco公司),胎牛血清(杭州四季青公司),兔抗人γ-H2AX、β-catenin抗体(北京博奥森生物技术有限公司),鼠抗人β-actin抗体(CST公司),黄芪甲苷(上海融禾公司),AnnexinⅤ-FITC细胞凋亡检测试剂盒、荧光染料碘化丙啶(PI)(Invitrogen公司),MTT、Wnt通路激动剂LiCl(Sigma公司),过氧化氢(国药化学试剂公司)。
1.2HUVECs的复苏及培养采用快速融化法复苏细胞,用含体积分数10%胎牛血清、100 U/mL青霉素、100 g/L链霉素的高糖DMEM完全培养液将细胞配成2×106mL-1的悬浮液,置于6孔板中,每孔2 mL,于37 ℃、体积分数5% CO2条件下常规培养。取对数生长期的HUVECs接种于96孔板,每孔200 μL。实验Ⅰ分组如下:对照组(不加任何干预因素),模型组(在细胞培养体系中加入终质量浓度为100 μmol/L的过氧化氢作用0.5 h),低、中、高剂量黄芪甲苷组(加入终质量浓度分别为2、10和50 mg/L的黄芪甲苷预处理24 h后再同上加入过氧化氢作用0.5 h)。实验Ⅱ分组如下:对照组(不加任何干预因素)、黄芪甲苷组(加入终质量浓度为50 mg/L的黄芪甲苷预处理24 h后再加入过氧化氢作用0.5 h)、LiCl组(加入终质量浓度为10 mmol/L的LiCl作用24 h后再加入过氧化氢作用0.5 h)和黄芪甲苷+LiCl组(同时加入终质量浓度为50 mg/L的黄芪甲苷和10 mmol/L的LiCl共同作用24 h后同上加入过氧化氢作用0.5 h)。
1.3各组细胞存活情况检测采用MTT法。细胞按实验Ⅰ分组处理后加入10 μL 5 g/L MTT溶液,孵育4 h,弃上清,按每孔100 μL加入DMSO,振荡10 min,酶标仪490 nm处读取吸光度(A)值。每组设6个复孔。另取细胞,按实验Ⅱ分组处理后同上检测,每组设3个复孔。
1.4各组细胞凋亡率检测采用流式细胞术。细胞分别按实验Ⅰ、实验Ⅱ分组处理后用胰蛋白酶消化,制成细胞悬液,立即加入10 μL AnnexinⅤ-FITC和5 μL PI,振荡混匀,避光,室温孵育15 min后与300 μL结合缓冲液混合,加入流式细胞仪检测细胞凋亡,计算细胞凋亡率。重复检测3次。
1.5各组细胞γ-H2AX、β-catenin蛋白表达的检测

1.6统计学处理应用SPSS 13.0处理数据。采用单因素方差分析比较实验Ⅰ中各组HUVECs的存活情况(A值)、细胞凋亡率、γ-H2AX及β-catenin蛋白的表达水平,组间两两比较采用LSD-t检验;采用析因设计的方差分析比较实验Ⅱ中各组HUVECs的存活情况(A值)、细胞凋亡率以及γ-H2AX、β-catenin蛋白的表达水平,检验水准α=0.05。
2结果
2.1不同剂量黄芪甲苷对HUVECs存活、细胞凋亡及γ-H2AX、β-catenin蛋白表达的影响见表1。由表1可知,过氧化氢刺激可抑制HUVECs存活,促进HUVECs凋亡,而黄芪甲苷可呈剂量依赖性地改善上述情况;此外,黄芪甲苷可抑制DNA损伤标记分子γ-H2AX和Wnt通路下游关键靶分子β-catenin蛋白表达水平的升高。
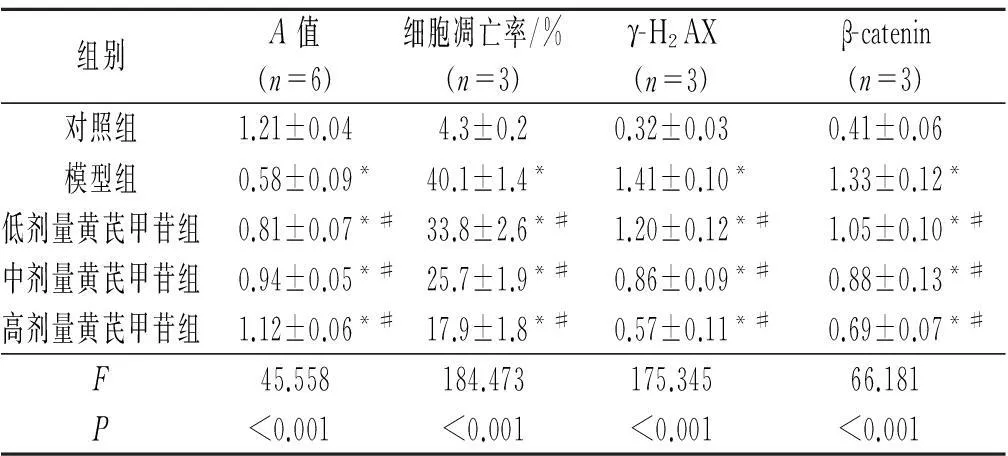
表1 实验Ⅰ中5组细胞存活情况、
*:与对照组相比,P<0.05;#:与模型组相比,P<0.05。
2.2黄芪甲苷及LiCl对HUVECs存活、凋亡及γ-H2AX和β-catenin蛋白表达的影响见图1、表2。由表2可知,LiCl与黄芪甲苷共同孵育细胞24 h后,黄芪甲苷对HUVECs的保护作用被削弱。

1、2、3、4:分别为对照组、黄芪甲苷组、LiCl组和黄芪甲苷+LiCl组。图1 实验Ⅱ中4组HUVECs中γ-H2AX和β-catenin蛋白的表达

组别nA值细胞凋亡率/%γ-H2AXβ-catenin对照组31.22±0.074.4±0.20.29±0.040.38±0.07黄芪甲苷组31.03±0.0918.8±2.30.52±0.070.61±0.09LiCl组30.42±0.1142.2±3.01.74±0.131.58±0.11黄芪甲苷+LiCl组30.61±0.1234.6±2.01.31±0.121.29±0.12F黄芪甲苷(P)<0.001(>0.999)7.575(0.025)3.175(0.113)0.275(0.615)FLiCl(P)113.043(<0.001)470.131(<0.001)398.222(<0.001)268.435(<0.001)F交互(P)10.967(0.011)79.188(<0.001)34.571(<0.001)20.537(0.002)
3讨论
PAD严重威胁人类的健康,血管阻塞后致下肢发生缺血、缺氧性改变,最终导致血管内皮细胞的损伤[7]。研究[8]表明,血管内皮的损伤可导致炎性细胞浸润,血管平滑肌细胞增殖,造成血管粥样硬化以及再狭窄,是血管损伤后不能很好修复的主要原因之一。因此,修复血管内皮损伤和保护内皮功能成为近年来PAD防治的关键。
近年来,中医学在防治血管内皮损伤及其功能障碍等方面取得了一定进展。有学者[9]从中药有效成分入手进行了大量研究,结果表明,皂苷类作为一些益气药的主要活性成分,具有血管保护作用。黄芪甲苷是传统的补气药黄芪的主要成分之一。该实验结果表明,黄芪甲苷可增强氧化应激条件(过氧化氢处理)下HUVECs的增殖,抑制其凋亡。在PAD的病理过程中,氧自由基扮演着十分重要的角色,大量氧自由基的产生导致DNA损伤的发生,使下肢发生不可逆性损伤[10]。DNA双链断裂是机体DNA损伤的类型之一,而γ-H2AX的形成就是DNA双链断裂的一个标志[11]。该研究结果显示黄芪甲苷预处理可降低过氧化氢诱导的γ-H2AX蛋白的表达,对抗氧化应激导致的HUVECs DNA损伤。
Wnt信号通路在血管再生的生理和病理过程中扮演着十分重要的角色,Wnt配体、受体在血管内皮细胞中均有表达[12]。研究[13-14]表明,下肢缺血损伤发生时,在体内、体外应用Wnt信号通路阻滞剂DKK1可有效促进缺血区血管再生;而Wnt通路的另一阻滞剂sFRP-1在肢体缺血后能作为血管再生因子发挥作用。由此可见,抑制Wnt信号通路可在缺血、缺氧引起的损伤中对细胞起到保护作用[15]。β-catenin作为经典Wnt信号通路的下游分子在血管生理进程中起着关键作用。研究[16]发现,Wnt因子可能通过调控β-catenin的表达来调节内皮细胞的信号传导。该研究结果表明氧化应激条件下,HUVECs中β-catenin表达升高,而黄芪甲苷预处理可抑制β-catenin的表达,提示黄芪甲苷可能是通过抑制β-catenin的活性发挥对氧化应激造成的细胞损伤的保护作用;当用Wnt通路激动剂LiCl预处理后,黄芪甲苷对β-catenin的抑制作用减弱;此外,LiCl可减弱黄芪甲苷预处理对过氧化氢作用下细胞的保护作用,表明黄芪甲苷可能主要通过抑制Wnt/β-catenin信号通路来保护氧化应激下损伤的HUVECs。
综上所述,黄芪甲苷可缓解氧化应激条件下HUVECs的损伤,其作用机制可能与抑制Wnt/β-catenin信号通路有关。
参考文献
[1]舒畅,何昊.下肢缺血性疾病的诊治进展[J].中国普通外科杂志,2008,17(6):523
[2]彭锦辉.IGFBP-4保护下肢缺血性损伤的实验研究[D].上海:第二军医大学,2013.
[3]刘晓丹,邓常清.黄芪甲苷和三七总皂苷中主要有效成分抗PC12细胞氧化损伤的配伍研究[J].湖南中医药大学学报,2012,32(1):8
[4]熊平,蒋灵芝,廖秀清.黄芪甲苷保护大鼠肺缺血再灌注肺损伤的形态学研究[J].南方医科大学学报,2010,30(8):1864
[5]贺爽,郭浩,徐砚通,等.中药促进内皮祖细胞功能治疗血管损伤性疾病的研究进展[J].中华中医药杂志,2013,28(12):3612
[6]杨长春,韩盈.黄芪、当归对血管再狭窄大鼠超声血流动力学的影响[J].解放军医学杂志,2010,35(8):976
[7]史洪涛,申东彦,邢桃红.膝下动脉腔内成形术治疗重症下肢缺血86例[J].郑州大学学报(医学版),2010,45(4):690
[8]STORM T,WULF K,TESKE M,et al.Chemical activation and changes in surface morphology of poly(ε-caprolactone) modulate VEGF responsiveness of human endothelial cells[J].J Mater Sci Mater Med,2014,25(8):2003
[9]刘斌,王新宇,孙晓雪,等.参芎化瘀胶囊预处理对大鼠脑缺血再灌注损伤后血管内皮生长因子表达的影响[J].中国实验方剂学杂志,2013,19(9):284
[10]KALGHATGI S,KELLY CM,CERCHAR E,et al.Effects of non-thermal plasma on mammalian cells[J].PLoS One,2011,6(1):e16270
[11]刘静.氧化应激损伤在赭曲霉毒素A诱导细胞周期阻滞中的作用及其可能机制的研究[D].石家庄:河北医科大学,2012.
[12]DEJANA E.The role of wnt signaling in physiological and pathological angiogenesis[J].Circ Res,2010,107(8):943
[13]SMADJA DM,D'AUDIGIER C,WEISWALD LB,et al.The Wnt antagonist Dickkopf-1 increases endothelial progenitor cell angiogenic potential[J].Arterioscler Thromb Vasc Biol,2010,30(12):2544
[14]DUFOURCQ P,LEROUX L,EZAN J,et al.Regulation of endothelial cell cytoskeletal reorganization by a secreted frizzled-related protein-1 and frizzled 4- and frizzled 7-dependent pathway: role in neovessel formation[J].Am J Pathol,2008,172(1):37
[15]SHRUSTER A,BEN-ZUR T,MELAMED E,et al.Wnt signaling enhances neurogenesis and improves neurological function after focal ischemic injury[J].PLoS One,2012,7(7):e40843
中图分类号R285.5
doi:10.13705/j.issn.1671-6825.2016.02.027

