生物活性玻璃对体外脱矿釉质再矿化的影响
方 谦,穆 玉,周 雪,瞿亚男,彭 伟
华北理工大学口腔医学院 唐山 063000
△女,1988年11月生,硕士,医师,研究方向:口腔内科学,E-mail:416385376@qq.com
生物活性玻璃对体外脱矿釉质再矿化的影响
方谦△,穆玉,周雪,瞿亚男,彭伟
华北理工大学口腔医学院 唐山 063000
△女,1988年11月生,硕士,医师,研究方向:口腔内科学,E-mail:416385376@qq.com
关键词生物活性玻璃;再矿化;显微硬度;脱矿釉质
摘要目的:观察生物活性玻璃对早期脱矿釉质再矿化的作用。方法:将40块牛牙釉质块建立人工龋模型后随机分为4组:生物活性玻璃组(用质量分数6%生物活性玻璃进行再矿化处理)、GC护牙素组、NaF组(用质量分数2%NaF进行再矿化处理)和去离子水组。采用pH循环法进行再矿化处理,2次/d,5 min/次,循环15 d。用显微硬度仪测量脱矿前、再矿化前及再矿化后牙釉质表面的显微硬度,荧光显微镜观察早期釉质龋表层下的荧光带厚度,测定脱矿深度。结果:生物活性玻璃组、GC护牙素组、NaF组再矿化后显微硬度均较再矿化前增加,且生物活性玻璃组提高幅度最大(P<0.05)。4组再矿化区荧光带厚度均较脱矿区降低(P<0.05),其中生物活性玻璃组、GC护牙素组、NaF组均大于去离子水组(P<0.05)。结论:质量分数6%生物活性玻璃溶液促进脱矿釉质再矿化的疗效较好。
Effect of bioactive glass on demineralization enamel remineralization in vitro
FANGQian,MUYu,ZHOUXue,QUYanan,PENGWei
CollegeofStomatology,NorthChinaUniversityofScienceandTechnology,Tangshan063000
Key wordsbioactive glass;remineralization;microhardness;demineralization enamel
AbstractAim: To observe the effect of bioactive glass on the remineralization of demineralization enamel. Methods: Forty bovine teeth were subjected to establish demineralization enamel model, and then were allocated into four groups randomly(10 in each group) and treated with 6% bioactive glass, casein phosphopeptide amorphous calcium phosphate(CPP-ACP),2% sodium fluoride(NaF) and deionized water,respectively.Then they were subjected to the pH-cycling,two times a day and 5 minutes each time, cycling for 15 days for remineralization. The surface microhardness(SMH)of the enamel before demineralization,before and after remineralization were measured by microhardness detector. Thickness of fluorescence beneath the surface of early enamel caries in the demineralization area and the remineralization area were detected by fluorescence microscopy.Results: The SMH after remineralization in bioactive glass,CPP-ACP and NaF groups was higher than those before remineralization, and the change of bioactive glass group was the highest(P<0.05). The thickness of fluorescence in the remineralization area was lower than that in the demineralization area in the four groups(P<0.05), and the demineralization depth of bioactive glass,CPP-ACP and NaF groups was higher than the deionized water group(P<0.05).Conclusion: 6% bioactive glass solution had better effect on remineralization of demineralization enamel.
早期釉质龋是指釉质表面病变区失去光泽,呈片块状白垩色改变而无实质性缺损。它的治疗一般采取非手术治疗,即采用药物或再矿化等保守方法使龋病病变终止或消除。常用的材料有氟化物、酪蛋白磷酸肽-无定形磷酸钙(CPP-ACP)、生物活性玻璃及渗透树脂等,其中氟化物的使用占主导地位,但其安全性仍存在一定的争议[1]。作者前期已对生物活性玻璃促进早期釉质龋再矿化的最适浓度进行了研究,发现质量分数6%的生物活性玻璃溶液再矿化效果较好[2-3]。该实验进一步比较了质量分数2%NaF溶液、质量分数6%生物活性玻璃溶液及GC护牙素(含CPP-ACP)对早期脱矿釉质再矿化的效果,为临床合理用药提供理论依据。
1材料与方法
1.1主要材料和仪器质量分数6%生物活性玻璃溶液(45S5)购于北京大清生物技术有限公司,质量分数2%NaF溶液(分析纯)购于天津市永大化学试剂有限公司,GC护牙素(含CPP-ACP)购于日本GC株式会社。人工脱矿液配方:2.2 mmol/L硝酸钙,2.2 mmol/L磷酸二氢钾,50 mmol/L冰醋酸,pH值4.5。人工唾液配方(按ISO/TR10271标准):氯化钠0.4 g,氯化钾0.4 g,无水氯化钙0.795 g,磷酸二氢钠0.78 g,硫化钠0.005 g,尿素1 g,去离子水稀释至1 000 mL,pH值7.0。0.1 mmol/L罗丹明B染液购于天津市光复精细化工研究所,HVST-1000ZA 显微硬度计(研润光机),BX-53型荧光显微镜(日本OLYMPUS),DH-250型电热恒温培养箱(北京科伟永兴仪器有限公司)。
1.2早期釉质龋模型的建立选择新鲜拔除的牛切牙,从中选取釉质发育良好,无脱钙、无龋坏、无划痕和裂纹的牛牙40颗,冠根分离,用低速双面金刚砂片切轮切取20块5 mm×5 mm×2 mm大小的釉质块(硬度标本)和20块10 mm×8 mm×3 mm大小的釉质块(荧光标本),流水下用600、800、1 000、1 200、2 400目碳化硅砂纸依次抛光唇侧釉质面。备用标本于4 ℃去离子水中保存备用。将标本在37 ℃人工脱矿液中浸泡72 h,可见其釉质表面呈白垩色,用去离子水冲洗1 min。脱矿前除釉质面外均涂上双层抗酸指甲油。荧光样本在釉质面一侧涂上双层抗酸指甲油分为脱矿区和再矿化区。
1.3实验分组将硬度标本和荧光标本均随机分成4组进行再矿化处理:生物活性玻璃组、GC护牙素组、NaF组和去离子水组,每组5个标本,再矿化处理液分别为质量分数6%生物活性玻璃溶液、GC护牙素、质量分数2%NaF溶液和去离子水。
1.4再矿化处理将标本于脱矿液中浸泡10 min,用再矿化处理液处理5 min,于人工唾液中浸泡8 h,于脱矿液中浸泡10 min,再用再矿化处理液处理5 min×2(早、晚各一次),于人工唾液中浸泡过夜。循环15 d,整个过程在37 ℃电热恒温培养箱中进行。浸泡后用去离子水冲洗牙面1 min。
1.5观测指标
1.5.1显微硬度应用显微硬度计,于脱矿前、再矿化前及再矿化后测定牙釉质表面的显微硬度,分别记为SMH0、SMH1和SMH2。负荷1.961 N,作用10 s,每个标本随机测量3个点,取平均值。计算显微硬度差值(ΔSMH=SMH2-SMH1)。
1.5.2再矿化深度再矿化处理结束后取出标本,在脱矿区和再矿化区分别切取0.3 mm厚的切片置于载玻片上,吸取0.1 mmol/L新鲜配制的罗丹明B溶液滴于切片表面,以全部覆盖切片为准,将载玻片置于湿盒内,在37 ℃恒温培养箱内放置1 h。取出切片,用大量去离子水冲洗,干燥后置显微镜下(×4)观察脱矿区和再矿化区荧光渗入情况,用Cellsens软件测量脱矿区和再矿化区荧光带的厚度。每个标本随机测3个点,取平均值,计算再矿化深度。再矿化深度=脱矿区深度-再矿化区深度。

2结果
2.14组标本显微硬度的比较见表1。再矿化后,生物活性玻璃组、NaF组和GC护牙素组显微硬度均较再矿化前显著提高,去离子水组无明显变化;生物活性玻璃组显微硬度提高的幅度ΔSMH最大。

表1 4组SMH测量结果 HV
*:4组比较,F=35.596,P<0.001;两两比较,P均<0.05。
2.24组再矿化深度的比较见图1、表2。4组再矿化区荧光带厚度均低于脱矿区,生物活性玻璃组、GC护牙素组、NaF组再矿化深度均大于去离子水组,但这3组之间比较,差异无统计学意义。

A:脱矿釉质;B:生物活性玻璃组;C:NaF组;D:GC护牙素组;E:去离子水组。图1 4组脱矿深度观察结果 (罗丹明B染色,×4)
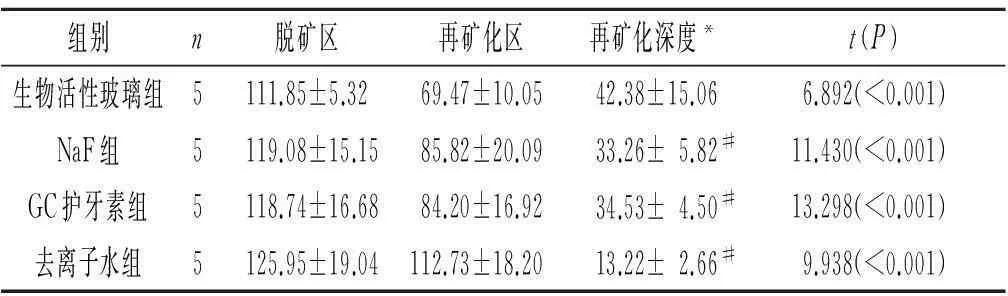
组别n脱矿区再矿化区再矿化深度*t(P)生物活性玻璃组5111.85±5.3269.47±10.0542.38±15.066.892(<0.001)NaF组5119.08±15.1585.82±20.0933.26±5.82#11.430(<0.001)GC护牙素组5118.74±16.6884.20±16.9234.53±4.50#13.298(<0.001)去离子水组5125.95±19.04112.73±18.2013.22±2.66#9.938(<0.001)
*:F=6.953,P=0.005;#:与去离子水组比较,P<0.005。
3讨论
氟化物作为公认的再矿化制剂已大量应用于临床,其防龋机制体现在以下3个方面:第一,氟离子可进入菌斑内,抑制致龋菌的生长和代谢。第二,部分氟离子通过釉质中的微孔结构扩散、渗透入釉质内部,取代羟基生成氟磷灰石,从而增强釉质的抗酸能力。第三,氟离子能与唾液和釉质溶解产生的钙离子结合,在釉质表层形成氟化钙沉积层,在以后酸性环境下能缓慢溶解、释放氟离子[4]。 虽然氟化物的防治龋效果得到了业界的公认,但仍存在一定的局限性:儿童易误食;大量使用易导致变异链球菌耐氟菌株的产生;氟化物浓度难以长时间保持稳定,需反复涂擦,且其释放区域具有局限性[4-5]。CPP-ACP含高浓度的具有生物活性的钙磷离子,无毒副作用,通过粘附在牙齿表面释放钙磷离子,维持牙体表面钙磷浓度,缓冲pH值,从而抑制釉质脱矿和促进再矿化[6-7],但较氟化物而言,CPP-ACP对于早期龋表面病损的再矿化作用相对较小。因而研发安全有效的再矿化制剂成为热点。
生物活性玻璃由SiO2、P2O5、CaO和Na2O等无机离子构成,其活性成分为钙钠磷硅酸,具有良好的生物相容性和成骨活性,在口腔领域中应用广泛,如用于牙周疾病和牙本质过敏症的治疗、骨缺损的修复及促进牙体硬组织的再矿化等[8]。Bakry等[9]发现生物活性玻璃糊剂45S5促进脱矿釉质再矿化的效果优于氟化物凝胶;Mehta等[10]发现生物活性玻璃再矿化的效果优于CPP-ACP。
釉质的显微硬度反映了釉质的矿化程度及矿物质的得失。牛牙与人牙理化性能的差异导致相同条件下二者的矿物丢失比率不同[11],因而牛牙釉质脱矿后的显微硬度值较人牙低。不同的釉质块抗酸及再矿化的能力不尽相同,因此该实验采用显微硬度差值来评价生物活性玻璃、NaF和GC护牙素等3种药物再矿化的效果,显微硬度差值越高,说明再矿化能力越好。研究结果显示,经质量分数6%生物活性玻璃溶液处理的釉质显微硬度差值较高,而再矿化深度与其他两个药物组相比无显著差别,再矿化效果显著。这可能与生物活性玻璃的防龋机制及釉质表面的钙磷浓度有关。生物活性玻璃与唾液接触后能迅速释放钙磷离子,沉积在脱矿釉质表面,形成类羟基磷灰石[12]。生物活性玻璃的再矿化机制除与钙磷有关,还可能与硅元素有关。有学者[13]发现硅能够稳定矿物质沉积形成的核心,从而加快周围饱和溶液的再沉积。矿化液中高浓度的钙离子能够加快钙和矿物质在釉质微孔中的沉积,但影响了钙离子向深层渗透,而低浓度的钙离子可渗透到龋损深层而利于矿化[14]。质量分数6%生物活性玻璃溶液及10%CPP-ACP所含的钙磷离子浓度较高,质量分数2%NaF溶液所含的氟离子浓度高,在形成氟磷灰石的同时会形成大量的氟化钙,从而影响了钙离子向深层的渗透。
综上所述,质量分数6%生物活性玻璃溶液促进脱矿釉质再矿化的疗效较好,但其远期疗效有待进一步验证。
参考文献
[1]AOBA T.Solubility properties of human tooth mineral and pathogenesis of dental caries[J].Oral Dis,2004,10(5):249
[2]方谦,周雪,穆玉,等.生物活性玻璃促进早期釉质龋再矿化最适浓度的研究[J].天津医药,2015,43(10):1187
[3]方谦,穆玉,徐晓南,等.不同浓度生物活性玻璃对早期釉质龋齿再矿化的作用[J].牙体牙髓牙周病杂志,2015,25(12):729
[4]孙皎,赵信义.口腔生物材料学[M].北京:人民卫生出版社,2011:127
[5]罗菁菁,唐旭炎,李全利.酪蛋白磷酸肽-无定形磷酸钙促进牙再矿化的机制[J].国际口腔医学杂志,2011,38(6):662
[6]POGGIO C,LOMBARDINI M,DAGNA A,et al.Protective effect on enamel demineralization of a CPP-ACP paste: an AFM in vitro study[J].J Dent,2009,37(12):949
[7]HAMBA H,NIKAIDO T,INOUE G,et al.Effects of CPP-ACP with sodium fluoride on inhibition of bovine enamel demineralization: a quantitative assessment using micro-computed tomography[J].J Dent,2011,39(6):405
[8]史舒雅,陈亚明.生物活性玻璃在口腔医学中的应用[J].口腔生物医学,2013,4(1):44
[9]BAKRY AS,MARGHALANI HY,AMIN OA,et al.The effect of a bioglass paste on enamel exposed to erosive challenge[J].J Dent,2014,42(11):1458
[10]MEHTA AB,KUMARI V,JOSE R,et al.Remineralization potential of bioactive glass and casein phosphopeptide-amorphous calcium phosphate on initial carious lesion:an in-vitro pH-cycling study[J].J Conserv Dent,2014,17(1):3
[11]黄冠玮,邹玲,李伟.人工龋模型的建立方法[J].国际口腔医学杂志,2010,37(5):537
[12]ANDERSSON OH,KANGASNIEMI I.Calcium phosphate formation at the surface of bioactive glass in vitro[J].J Biomed Mater Res,1991,25(8):1019
[13]刘振华,王铎,贺长历.硅对人恒前磨牙早期釉质龋再矿化影响的扫描电镜观察[J].中华老年口腔医学杂志,2011,9(2):74
[14]樊明文,周学东.牙体牙髓牙周病学[M].北京:人民卫生出版社,2012:52
中图分类号R781.1
doi:10.13705/j.issn.1671-6825.2016.02.031

