非肉蛋白对乳化体系稳定性影响的研究进展
牛海力++刘骞++姜秀丽++孔保华
摘 要:乳化体系中的蛋白质由于具有双亲性可以作为乳化剂吸附在油水界面上,并通过改善界面膜的性质和提高位阻等方式在抑制脂肪氧化和防止分层等方面发挥作用。非肉蛋白由于其营养性和经济性逐渐成为乳化体系中乳化剂的更好选择。本文主要综述各种非肉蛋白(大豆分离蛋白、乳清分离蛋白、豌豆分离蛋白和酪蛋白)的添加对乳化体系稳定性的作用以及作用机理,从而为非肉蛋白的乳化体系在食品中的应用提供理论研究参考。
关键词:非肉蛋白;乳化体系;稳定性;研究进展
Contribution of Nonmeat Protein to the Stability of Emulsions: A Review
NIU Haili, LIU Qian, JIANG Xiuli, KONG Baohua*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract: Proteins in emulsions can be absorded on the interface of oil and water as an emulsifier due to its amphipathy, and they inhibit fat oxidation and prevent creaming by improving properties of the interface membrane and by increasing steric hindrance. Nonmeat proteins have gradually become a good alternative to emulsifiers because of their nutritional and economical importance. This paper focuses on reviewing the functional properties of various nonmeat proteins (soybean protein isolate, whey proteinisolate, pea protein isolateand casein) and their mechanisms of action in stabilizing emulsions, aiming to provide the theoretical reference for the application of nonmeat protein emulsions in the food industry.
Key words: nonmeat; emulsion; stability; progress
DOI:10.15922/j.cnki.rlyj.2016.03.009
中图分类号:TS202.1 文献标志码:A 文章编号:1001-8123(2016)03-0039-05
引文格式:
牛海力, 刘骞, 姜秀丽, 等. 非肉蛋白对乳化体系稳定性影响的研究进展[J]. 肉类研究, 2016, 30(3): 39-43. DOI:10.15922/j.cnki.rlyj.2016.03.009. http://rlyj.cbpt.cnki.net
NIU Haili, LIU Qian, JIANG Xiuli, et al. The contribution of nonmeat protein to the stability of emulsions: a review[J]. Meat Research, 2016, 30(3): 39-43. (in Chinese with English abstract) DOI:10.15922/j.cnki.rlyj.2016.03.009. http://rlyj.cbpt.cnki.net
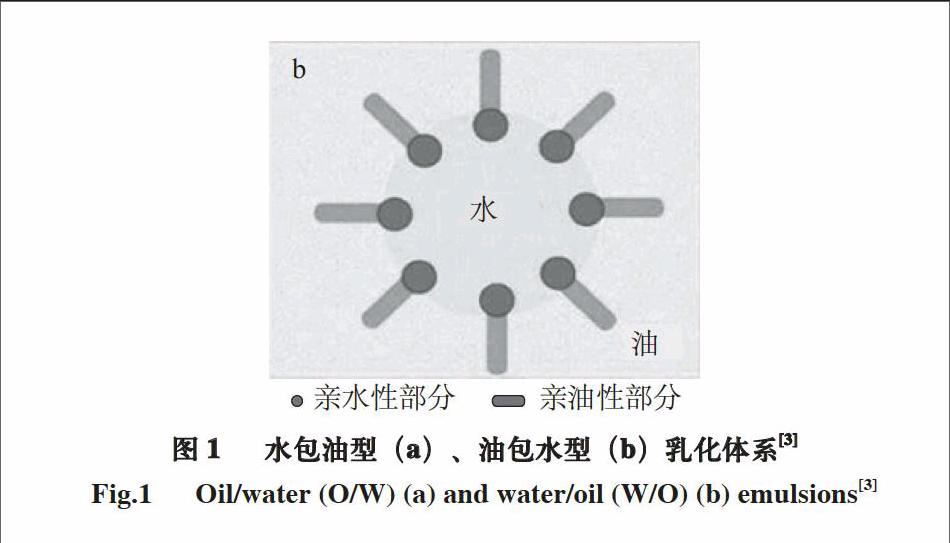
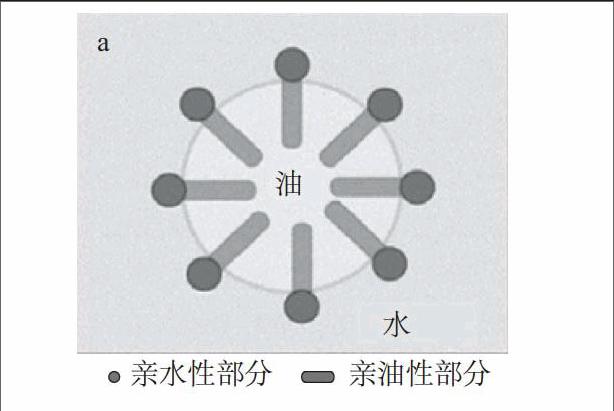
大多数食品是以乳化体系的形式存在,乳化对食品的质地、风味及感官特性都极为重要。所谓乳化,是指在一定力的作用下,如机械搅拌或高压均质,打破水和油稳定的单相体系,两性物质迁移到油水界面,降低界面间的张力,从而形成具有一定动力学稳定性的油-水两相体系[1]。乳化体系是由一种或多种物质分散到另一种分散相中形成的多相体系[2]。乳化体系包括水包油型乳化体系(O/W)(图1a)和油包水型乳化体系(W/O)
(图1b)[3],而前者在食品中的应用更为广泛。然而,乳化体系是一类不稳定的体系,在长期贮藏过程中由于热力学的不稳定性以及自由基的攻击,会发生分层及氧化等变化,因此,乳化体系的稳定性是影响乳化类食品质量的主要因素。
乳化体系的稳定性包括物理稳定性和氧化稳定性。由于多不饱和脂肪酸产生的脂肪氧化和蛋白质氧化导致的不稳定性称为氧化稳定性。氧化稳定性可以通过测定硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARs)和过氧化值(peroxide value,POV)的方法进行评定。水包油型乳化体系的氧化稳定性很大程度上取决于乳化剂的类型和乳化剂的电荷。乳化剂的电荷大小决定金属离子和界面膜之间的作用力,因此会影响乳化体系的氧化稳定性,带有正电荷的乳化剂比带负电荷的乳化剂氧化稳定性更强[4]。物理稳定性是乳化液对乳化微粒的迁移和乳化微粒粒径大小的变化而引起的失稳现象的抵抗能力[5]。一般来说,乳化体系的黏度越大,物理稳定性越好。乳化体系的黏度与油滴分子间的相互作用有关,稳定这种相互作用的作用力可分为共价键、静电相互作用、范德华力和空间位阻[6]。但是相比于这些较弱的作用力,重力会直接导致乳化液出现沉降、分层及絮凝等现象,因此会直接影响乳化体系的物理稳定性[7]。另一方面,随着贮藏时间的延长,油滴之间会相互聚合,粒径变大,因此在絮凝之后又会出现聚集的现象。乳化剂的添加会降低界面张力,从而增加乳化体系的稳定性。
许多研究[8-9]表明,添加人工合成的乳化剂可以使肉糜类乳化体系崩溃,降低乳化体系的稳定性。因此具有双亲性的天然蛋白质,是一种很好的乳化剂,可以在油滴表面通过疏水相互作用形成一层黏弹性的界面膜以提高乳化体系的物理稳定性。由于非肉蛋白的经济性和营养健康性,在食品加工中的应用逐渐广泛,根据文献总结,常用的非肉蛋白乳化剂有大豆分离蛋白[10-13]、乳清分离蛋白[14-18]、豌豆分离蛋白[19-23]和酪蛋白[24-26]等,因此本文主要综述不同非肉蛋白在稳定乳化体系中所起的作用及其作用机理。
1 大豆分离蛋白乳化体系
大豆中含有大约40%的蛋白质和20%的油(以干基计),在低温下通过分离油就可以得到大豆分离蛋白,大豆分离蛋白根据沉降系数可分为2S、7S、11S和15S 4 种蛋白质,其中7S和11S比例最高,大约达到80%[27]。近年来,天然大豆分离蛋白由于较好的溶解性、乳化性、起泡性、凝胶性和持水性等功能性质,常作为一种食品添加剂添加到食品中[10]。另一方面,由于大豆分离蛋白中蛋白含量高及经济合理性,使大豆分离蛋白乳化体系的研究也逐渐加深。
Wong等[10]通过研究发现,蛋白质结构本身的灵活可变性是其能否吸附于油水界面上的关键因素,而且蛋白质还能防止乳化体系中的油脂发生氧化,对维持乳化体系的稳定性有很重要的作用。Ji等[11]用酪蛋白酸钠和大豆蛋白作为乳化剂,通过高压均质形成乳化体系,发现结构松散的酪蛋白酸钠和球形的大豆蛋白可以吸附到油水界面上,并且还有一些游离的蛋白溶解在水相中,静电斥力与空间位阻的作用保持了乳化体系的稳定性。Fernandez-Avila等[7]分析了乳化体系的均质条件以及加热处理对大豆蛋白乳化体系稳定性的影响,并发现超高压均质处理形成的乳化体系相对于传统的均质处理得到的乳化体系油滴粒径更小,稳定性更好,而加热处理对其稳定性影响不大。
Phoon等[12]将伴大豆球蛋白(7S)进行限制性水解,再将水解物制备乳化体系以研究不同的加工条件对乳化体系氧化稳定性的影响,结果发现,在水解度为0.7%、pH值为7的低盐离子条件下,胰蛋白酶酶解后由于β-转角结构的增加而提高了其抗氧化性,这种由α-螺旋或无规则卷曲转变成分子内转角的过程对建立一个有效的界面膜起到很重要的作用。Cui等[13]将卢丁加入到大豆分离蛋白稳定的乳化体系中,研究其对乳化体系物理稳定性和氧化稳定性的影响,结果显示,芦丁可以与大豆分离蛋白通过疏水相互作用形成混合物,并且芦丁在加入乳化体系后可以竞争性的吸附到油水界面上,在界面上的富集导致油滴粒径减小并且增加了乳化体系的物理稳定性和氧化稳定性。
2 乳清分离蛋白乳化体系
乳清蛋白与其他日常饮食的蛋白质相比含有所有必需氨基酸,因此其营养性能更好。乳清蛋白包括β-乳球蛋白、α-乳白蛋白和牛血清白蛋白。乳清分离蛋白是干酪生产中的一种副产物,具有良好的乳化性。在食品工业中,乳清分离蛋白也常作为一种乳化剂应用到乳化体系中,乳清分离蛋白较好的表面活性使其可以吸附在油水界面上,并通过对油滴的包埋形成一层界面膜起到稳定乳化体系的作用。另一方面,乳清蛋白还具有抗氧化作用,它可以抑制氧化剂穿透进入油滴内发生氧化,因此可以提高其氧化稳定性。
Atarés等[14]采用葵花籽油和乳清蛋白在4 种不同条件下(使用纯化或未经纯化的葵花籽油及使用超速均质或高压喷射均质)制备乳化体系研究其稳定性,并证明乳清蛋白作为抑制脂肪氧化的活性抑制剂在稳定乳状液、防止聚集方面起到很重要的作用,乳清分离蛋白在油水界面上分布的位置会影响脂肪分子的移动性,并提高乳化体系的氧化稳定性。Hebishy等[15]制备了传统的高压均质乳化体系和超高压均质乳化体系研究均质压力与乳化体系氧化稳定的关系,当均质压力达到100 MPa时可以提高乳清蛋白在界面上的吸收及有效地抑制脂肪氧化,但当压力达到200 MPa时乳清蛋已完全变形并且失去了表面活性剂的作用。Berendsen等[16]分别采用乳清分离蛋白和乳清分离蛋白、羧甲基纤维素钠的混合物制备单层及双层膜的乳化体系,并通过表面等离子共振技术测定膜的厚度,表明双层界面膜预乳化体系的稳定性高于单层膜,其原因是尽管在不利的加工条件下,多糖依然可以阻止油滴间的聚合并形成一层更厚的界面膜,因此双层膜的稳定性更高。
高浓度的乳清蛋白尽管功能性好,但以乳清蛋白稳定的乳化体系在加热时会由于蛋白变性、聚集和絮凝产生热诱导分层。?ak?r-Fuller等[17]用普通的乳清蛋白和微粒化的乳清蛋白制备乳化体系研究其热稳定性,发现微粒化后乳化体系的热稳定性增强,并且随着乳清蛋白的含量达到11%时,经过干馏处理后,普通乳清蛋白的乳化体系产生分层而微粒化后乳化体系没有分层的现象。蛋白质除了作为乳化剂在乳化体系中发挥作用外,还可以作为一种运输物质。Wang等[18]的研究表明蛋白质由于其较多的功能性质,还可以在乳化体系中运输一些功能物质,一些疏水性的生物活性物质常存在于油相中,而本身具有双亲性的乳清蛋白通过包埋作用可以携带α-生育酚以配体键的结合方式与油滴表面的界面膜相互作用。
3 豌豆分离蛋白乳化体系
豌豆分离蛋白对于学术研究及工业生产都是一种很重要的植物蛋白,其凝胶性的研究非常广泛[28]。豌豆分离蛋白主要包含两种蛋白质,豌豆球蛋白和豆球蛋白,而豌豆分离蛋白乳化体系的稳定性取决于很多因素,如豌豆球蛋白和豆球蛋白的比例、油的比例、pH值及蛋白浓度等。
2013年,Liang等[19]发现酸性条件下豌豆分离蛋白稳定的乳化体系稳定性好于碱性及中性条件。2014年,Liang等[20]通过研究发现,酸性条件下豌豆分离蛋白在乳化体系中以纳米微粒的形式存在,随着乳化体系中蛋白浓度的增加,粒径减小,物理稳定性增强,并且在高浓度时,随着界面上吸附的蛋白含量增加,逐渐形成了一个由絮凝的液滴组成的凝胶网络结构。Jiang等[21]用碱性蛋白酶处理豌豆分离蛋白(NPP),得到结构修饰的豌豆分离蛋白,与葵花籽油形成乳化体系,并说明结构修饰后的豌豆分离蛋白作为一种表面活性剂被吸附在界面处,与NPP相比,添加后对界面膜性质的提高及其位阻在抑制乳状液氧化中起到重要的作用。Amine等[22]使用不同的植物蛋白(马铃薯蛋白、大豆蛋白和豌豆蛋白)以及牛乳蛋白(酪蛋白酸钠和乳清蛋白)制备乳化体系通过界面张力和界面弹性的方法研究乳化体系的稳定性,随着蛋白质浓度的增加,对于马铃薯蛋白、豌豆蛋白和酪蛋白酸钠乳化体系,其界面张力及z-平均粒径减小,这种降低是由于蛋白质分子的吸附,使油水界面的界面能量降低。另一方面,文章旨在研究乳化体系的弹性与其稳定性的关系,结果表明,乳化体系的弹性对于维持乳化体系的稳定性是必需的,但不是唯一的因素,还包括一些其他的因素。
Liang等[23]用3 种球蛋白(大豆蛋白、豌豆蛋白和乳清蛋白)与酪蛋白以质量比6∶4和4∶6的比例形成乳化剂,研究球蛋白的种类和浓度对乳化体系稳定性的影响,结果发现,大豆蛋白与酪蛋白的混合物形成的乳化体系热稳定性最好。
4 酪蛋白乳化体系
酪蛋白酸钠是一种很好的乳化剂,由4 种主要的蛋白质组成:αs1、αs2、β-、和κ-酪蛋白。其中β-和αs1酪蛋白对乳化体系的稳定性贡献最大。蛋白质中疏水性氨基酸残基和亲水性氨基酸残基在多肽链的两端均衡分布在稳定乳化体系方面尤其重要。
Hu等[24]分别用酪蛋白、乳清分离蛋白和大豆分离蛋白作为乳化剂与玉米油形成乳化体系,研究3 种乳化体系在pH 3.0条件下物理稳定性和氧化稳定性的区别及其原因,并通过测定脂肪氢过氧化物和己二醛的含量说明这3 种乳化体系的氧化稳定性顺序是酪蛋白>乳清分离蛋白>大豆分离蛋白。酪蛋白相对于乳清蛋白的结构更加无序,并且疏水性更强,可以更快地吸附到油水界面形成较厚的界面膜,因此有利于乳化体系的稳定性。而大豆分离蛋白中主要的蛋白质是7S和11S蛋白质,其不对称的四级结构导致其乳化性较低。Qiu等[25]分析了麦醇溶蛋白、酪蛋白酸钠和乳清蛋白对鱼油乳化体系稳定性和体外消化性的影响,并说明麦醇溶蛋白和乳清蛋白形成的乳化体系比酪蛋白酸钠乳化体系的氧化稳定性更强,而酪蛋白酸钠乳化体系在老化过程中其色氨酸荧光光谱的损失及脂肪氧化程度最大,各种乳化体系在氧化稳定性方面的不同性体现在界面膜的厚度、蛋白质螯合能力以及抗氧化的氨基酸组成。
尽管酪蛋白稳定的乳化体系稳定性好于乳清蛋白,但由于高压下酪蛋白胶束被破坏,Martin-Gonzalez等[26]
研究了高压下酪蛋白乳化体系的流变学特性,发现较高油含量的乳化体系其流变学特性随着酪蛋白浓度的增加从牛顿流体变成剪切稀释流体。当均质压力在20~100 MPa之间时,压力的作用会诱导酪蛋白与周围的液滴相互作用形成凝胶状的结构。
5 非肉蛋白稳定的乳化体系在肉制品中的应用
Gao等[29]使用大豆分离蛋白和卡拉胶的混合物作为乳化剂添加到熟肉饼中,可以提高乳化体系的乳化稳定和熟肉饼的品质,并表明植物蛋白(大豆分离蛋白)和多糖对于脂肪和水的结合能力较强,因此形成了一个更加稳定的乳化体系,并对于熟肉饼的品质有一定的促进作用。Youssef等[30]使用低凝胶性的大豆蛋白、高凝胶性的大豆蛋白、乳清分离蛋白、预热的乳清分离蛋白4 种非肉蛋白作为乳化剂添加到熟肉饼中,光学显微镜的结果表明,非肉蛋白可以降低油滴间的聚集和蛋白质的聚集,乳清分离蛋白与高凝胶性的大豆蛋白可以与肉基质互相作用,形成明显的“岛状”。Salminen等[31]使用乳清分离蛋白和含有n-3脂肪酸的鱼油制备鱼油乳化体系,添加到猪肉香肠中,降低了体系的氧化稳定性,结果表明,鱼油乳化体系中的油滴与肉基质的相互作用是导致氧化稳定性降低的可能原因。Youssef等[32]将预乳化的菜籽油(使用酪蛋白酸钠、大豆分离蛋白和乳清分离蛋白作为乳化剂)替代脂肪添加到肉糜产品中,发现使用预乳化的酪蛋白酸钠的乳化体系可以增加肉糜制品的硬度,添加预乳化的乳化体系会降低产品的红度值,因此预乳化处理一定程度上会抵消降低脂肪含量带来的变化,并且预乳化处理会促进形成一个更加稳定的肉基质。
6 蛋白质稳定乳化体系的机理
以蛋白质为乳化剂的乳化液,其分层和絮凝的原因与很多因素有关,比如:蛋白吸附层的结构、连续相的黏度、乳化体系的聚集及流变特性、贮存温度、蛋白浓度、平均粒径、粒径分布、油体积分数、油的种类以及脂肪的晶型[33-37]。一般来说,乳化体系油滴分子的粒径大小是决定乳化体系稳定性、流变学性质、货架期、颜色等最重要的因素[38],油滴粒径越小,稳定性越好。在均质过程中,蛋白质可以迅速吸附到油水界面上,降低界面张力,并且在油滴表面形成保护膜以抑制油滴的聚集。另一方面,在低于或高于蛋白质等电点的pH值处,蛋白质可以给油滴电荷的作用,这种正电荷或者负电荷的作用会产生斥力以防止油滴间的聚集和絮凝,增加乳化体系的稳定性。蛋白质对乳化体系的稳定作用可能取决于蛋白质的表面疏水性、分子灵活性及蛋白质可以在油滴表面形成界面膜。
7 结 语
由于非肉蛋白的营养性和经济性,其作为乳化剂在肉制品体系中的应用已经受到广泛关注。但由于蛋白质的结构及其功能对不同加工条件及外源添加物质的变化的敏感性,其机理性研究是一个很复杂的过程。尽管大多数实验已经证明了蛋白质对维持乳化体系稳定性的作用机理与油水界面的界面膜有很大关系,我们仍需对界面膜的结构、性质及其对乳化体系稳定性的关系进一步了解。在深入了解其内在机理后,才能为其在食品体系中的广泛应用奠定坚实的理论基础。
参考文献:
[1] 殷军. 高浓度大豆蛋白体系乳化性能及其和结构的关系[D]. 无锡: 江南大学, 2005.
[2] JIANG J, XIONG Y L. Role of interfacial protein membrane in oxidative stability of vegetable oil substitution emulsions applicable to nutritionally modified sausage[J]. Meat Science, 2015, 109: 56-65. DOI:10.1016/j.meatsci.2015.05.011.
[3] KHAN B A, AKHTAR N, KHAN H M S, et al. Basics of pharmaceutical emulsions: a review[J]. African Journal of Pharmacy and Pharmacology, 2011, 25: 2715-2725.
[4] BERTON C, ROPERS M H, VIAU M, et al. Contribution of the interfacial layer to the protection of emulsified lipids against oxidation[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 5052-5061.
[5] HERRERA M. Analytical techniques for studying the physical properties of lipid emulsions[M]. New York: Springer, 2012.
[6] PIORKOWSKI D T, MCCLEMENTS D J. Beverage emulsions: recent developments in formulation, production, and applications[J]. Food Hydrocolloids, 2013, 44: 5-41. DOI:10.1016/j.foodhyd.2013.07.009.
[7] FERNANDEZ-AVILA C, ESCRIU R, TRUJILLO A J. Ultra-high pressure homogenization enhances physicochemical properties of soy protein isolate-stabilized emulsions[J]. Food Research International, 2015, 75: 357-366. DOI:10.1016/j.foodres.2015.05.026.
[8] GORDON A, BARBUT S. Effect of chemical modifications on the stability, texture and microstructure of cooked meat batters[J]. Food Structure, 1992, 11: 133-146.
[9] MEYER J A, BROWN W L, GILTNER M E, et al. Effect of emulsifiers on the stability of sausage emulsions[J]. Food Technology, 1964, 18: 1796-1798.
[10] WONG B T, ZHAI J, HOFFMANN S V, et al. Conformational changes to deamidated wheat gliadins and β-casein upon adsorption to oil-water emulsion interfaces[J]. Food Hydrocolloid, 2012, 27: 91-101. DOI:10.1016/j.foodhyd.2011.08.012.
[11] JI J, ZHANG J P, CHEN J S, et al. Preparation and stabilization of emulsions stabilized by mixed sodium caseinate and soy protein isolate[J]. Food Hydrocolloids, 2015, 51: 156-165. DOI:10.1016/j.foodhyd.2015.05.013.
[12] PHOON P Y, MARTIN-GONZALEZ M F, NARSIMHAN G. Effect of hydrolysis of soy β-conglycinin on the oxidative stability of O/W emulsions[J]. Food Hydrocolloids, 2014, 35: 429-443. DOI:10.1016/j.foodhyd.2013.06.024.
[13] CUI Z M, KONG X Z, CHEN Y M, et al. Effects of rutin incorporation on the physical and oxidative stability of soy protein-stabilized emulsions[J]. Food Hydrocolloids, 2014, 41: 1-9. DOI:10.1016/j.foodhyd.2014.03.006.
[14] ATAR?S L, MARSHALL L J, AKHTAR M, et al. Structure and oxidative stability of oil in water emulsions as affected by rutin and homogenization procedure[J]. Food Chemistry, 2012, 134: 1418-1424. DOI:10.1016/j.foodchem.2012.02.221.
[15] HEBISHY E, BUFFA M, GUAMIS B, et al. Physical and oxidative stability of whey protein oil-in-water emulsions produced by conventional and ultra high-pressure homogenization: effects of pressure and protein concentration on emulsion characteristics[J]. Innovative Food Science and Emerging Technologies, 2015, 32. DOI:10.1016/j.ifset.2015.09.013.
[16] BERENDSEN R, G?ELL C, HENRY O, et al. Premix membrane emulsification to produce oil-in-water emulsions stabilized with various interfacial structures of whey protein and carboxymethyl cellulose[J]. Food Hydrocolloids, 2014, 38: 1-10. DOI:10.1016/j.foodhyd.2013.11.005.
[17] ?AKIR-FULLER E. Enhanced heat stability of high protein emulsion systems provided by microparticulated whey proteins[J]. Food Hydrocolloids, 2015, 47: 41-50. DOI:10.1016/j.foodhyd.2015.01.003.
[18] WANG L, GAO Y H, LI J, et al. Effect of resveratrol or ascorbic acid on the stability of α-tocopherol in O/W emulsions stabilized by whey protein isolate: Simultaneous encapsulation of the vitamin and the protective antioxidant[J]. Food Chemistry, 2016, 196: 466-474. DOI:10.1016/j.foodchem.2015.09.071.
[19] LIANG H N, TANG C H. pH-dependent emulsifying properties of pea (Pisum sativum L.) proteins[J]. Food Hydrocolloids, 2013, 33: 309-319. DOI:10.1016/j.foodhyd.2013.04.005.
[20] LIANG H N, TANG C H. Pea protein exhibits a novel Pickering stabilization for oil-in-water emulsions at pH 3.0[J]. LWT-Food Science and Technology, 2014, 58: 463-469. DOI:10.1016/j.lwt.2014.03.023.
[21] JIANG J, ZHU B, LIU Y F, et al. Interfacial structural role of pH-shifting processed pea protein in the oxidative stability of oil/water emulsions[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 1683-1691.
[22] AMINE C, DREHER J, HELGASON T, et al. Investigation of emulsifying properties and emulsion stability of plant and milk proteins using interfacial tension and interfacial elasticity[J]. Food Hydrocolloids, 2014, 39: 180-186. DOI:10.1016/j.foodhyd.2014.01.001.
[23] LIANG Y C, WONG S, PHAM S P, et al. Effects of globular protein type and concentration on the physical properties and flow behaviors of oil-in-water emulsions stabilized by micellar caseine globular protein mixtures[J]. Food Hydrocolloids, 2016, 54: 89-98. DOI:10.1016/j.foodhyd.2015.09.024.
[24] HU M, MCCLEMENTS D J, DECKER E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 1696-1700.
[25] QIU C Y, ZHAO M M, DECKER E A. Influence of protein type on oxidation and digestibility of fish oil-in-water emulsions: gliadin, caseinate, and whey protein[J]. Food Chemistry, 2015, 175: 249-257. DOI:10.1016/j.foodchem.2014.11.112.
[26] MARTIN-GONZALEZ M S, ROACH A, HARTE F. Rheological properties of corn oil emulsions stabilized by commercial micellar casein and high pressure homogenization[J]. LWT-Food Science and Technology, 2009, 42: 307-311. DOI:10.1016/j.lwt.2008.04.005.
[27] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J]. Food Hydrocolloids, 2014, 39: 301-318. DOI:10.1016/j.foodhyd.2014.01.013.
[28] SUN X D, ARNTFIELD S D. Gelation properties of salt-extracted pea protein induced by heat treatment[J]. Food Research International, 2010, 43: 509-515. DOI:10.1016/j.foodres.2009.09.039.
[29] GAO X Q, ZHANG W G, ZHOU G H. Emulsion stability, thermo-rheology and quality characteristics of ground pork patties prepared with soy protein isolate and carrageenan[J]. Journal of the Science of Food and Agriculture, 2014, 95(14): 2832-2837. DOI:10.1002/jsfa.7023.
[30] YOUSSEF M K, BARBUT S F. Effects of two types of soy protein isolates, native and preheated whey protein isolates on emulsified meat batters prepared at different protein levels[J]. Meat Science, 2011, 87(1): 54-60. DOI:10.1016/j.meatsci.2010.09.002.
[31] SALMINEN H, HERRMANN K, WEISS J. Oil-in-water emulsions as a delivery system for n-3 fatty acids in meat products[J]. Meat Science, 2013, 93(3): 659-667. DOI:10.1016/j.meatsci.2012.11.035.
[32] YOUSSEF M K, BARBUT S. Fat reduction in comminuted meat products-effects of beef fat, regular and pre-emulsified canola oil[J]. Meat Science, 2011, 87(4): 356-360. DOI:10.1016/j.meatsci.2010.11.011.
[33] DALGLEISH D G. Adsorption of protein and the stability of emulsions[J]. Trends Food Science Technology, 1997, 8: 1-6. DOI:10.1016/S0924-2244(97)01001-7.
[34] LIZARRAGA M S, PAN L G, A?ON M C, et al. Stability of concentrated emulsions measured by optical and rheological methods. Effect of processing conditions: I. Whey protein concentrate[J]. Food Hydrocolloids, 2008, 22: 868-878. DOI:10.1016/j.foodhyd.2007.04.012.
[35] ROUSSEAU D. Fat crystals and emulsion stability: a review[J]. Food Research Internation, 2000, 33: 3-14. DOI:10.1016/S0963-9969(00)00017-X.
[36] SUN C, GUNASEKARAN S. Effects of protein concentration and oil-phase volume fraction on the stability and rheology of menhaden oil-in-water emulsions stabilized by whey protein isolate with xanthan gum[J]. Food Hydrocolloids, 2009, 23: 165-174. DOI:10.1016/j.foodhyd.2007.12.006.
[37] RUTTARATTANAMONGKOL K, AFIZAH M N, RIZVI S S H.
Stability and rheological properties of corn oil and butter oil emulsions stabilized with texturized whey proteins by supercritical fluid extrusion[J]. Journal of Food Engineering, 2015, 166: 139-147. DOI:10.1016/j.jfoodeng.2015.06.005.
[38] STANG M, SCHUCHMANN H, SCHUBERT H. Emulsification in high-pressure homogenizers[J]. Engineering in Life Sciences, 2001, 1(4): 151-157.

