环境条件对辣木种子萌发的影响
林孟飞,张俊杰,陈晓阳,丁美美,陈涵斌,邓丽婷,武玉灵,李书琦 (华南农业大学林学与风景园林学院,广东省森林植物种质创新与利用重点实验室,广东广州 510642)
环境条件对辣木种子萌发的影响
林孟飞,张俊杰,陈晓阳*,丁美美,陈涵斌,邓丽婷,武玉灵,李书琦(华南农业大学林学与风景园林学院,广东省森林植物种质创新与利用重点实验室,广东广州 510642)
摘要[目的]研究不同处理条件对辣木种子萌发的影响,从而提高种子的萌发率。[方法]以从尼日利亚采收的传统印度辣木种子为试验材料,研究不同浸种温度和时间、培养温度、光照、种子脱壳、多菌灵处理等对辣木种子发芽率、发芽势及污染率的影响,探讨辣木种子最佳萌发条件。[结果]20 ℃和40 ℃条件下浸种,种子萌发效果最好,从第2天开始萌发,到第7天结束萌发,萌发率最高;在试验范围内浸种时间对萌发率没有明显影响;32 ℃条件下培养,种子萌发效果最好,种子在第2天开始萌发,萌发率最高;多菌灵能够抑制种子的污染,但是不同浓度处理之间的种子萌发率和污染率没有显著影响;全天光照和全天黑暗对种子萌发率和发芽势并没有明显的影响;种子剥壳后培养萌发早,出苗整齐,到第4天萌发率达到最大值。[结论]辣木种子最佳萌发的培养温度为32 ℃左右;选用1 000倍的多菌灵浸泡种子即可达到杀菌的目的;光照和有无种壳对种子萌发率没有明显影响。
关键词辣木种子;多菌灵;温度;光照;种皮
Effects of Environmental Factors on Seed Germination ofMoringaOleifera
LIN Meng-fei, ZHANG Jun-jie, CHEN Xiao-yang*et al
(1. College of Forestry and Landscape Architecture, South China Agricultural University, Guangdong Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm, Guangzhou, Guangdong 510642)
Abstract[Objective] To research effects of different treatments on seed germination ofMoringaoleifera,so as to improve the germination rate of seeds. [Method] With traditionalM.oleiferaseeds in Nigeria as the test materials, we researched the effects of environmental factors on seed germination, such as soaking temperature and time, culture temperature, light, seed uncoating and carbendazim treatment, so as to explore the optimal germination conditions forM.oleiferaseeds. [Result] Seed germination rate was the highest when soaking temperatures ranged from 20 to 40 ℃, and germination began from the second day to the seventh day. Under the temperature of 20 and 40 ℃, seed germination had the highest germination rate which began from the second day. Within the test range, seed soaking time had no significant effects on germination rate. Under 32 ℃, seed germination had the best germination effect. Seeds started to germinate on the second day and the germination rate reached the maximum value. Carbendazim restricted the pollution of seeds; but there were no significant effects on seed germination rate and pollution rate among different concentrations. Whole day illumination and whole day darkness had no significant impacts on seed germination rate and vigor. After seed uncoating, seed germinated earlier and had higher emergence evenness. And germination rate reached the maximum value on the 4th day. [Conclusion] The optimal cultivation temperature forM.oleiferaseed germination is around 32 ℃. Soaking in 1000 times of carbendazim can achieve the purpose of sterilization. Illumination and existence of seed coat have no significant impacts on seed germination rate.
Key wordsMoringaoleiferaseeds; Carbendazim; Temperature; Light; Seed coat
辣木(Moringaoleifera)是辣木科(Moringaceae)辣木属(MoringaAdans.)多年生常绿或落叶乔木,有14个种[1],其中原产于印度、喜马拉雅山脉南麓的印度传统辣木栽培和开发最为广泛。辣木因其具有独特的经济价值被很多国家和地区引种[2],现在美洲中部、非洲、亚洲和太平洋岛屿等热带和亚热带地区等地均有栽培[3-4]。早在19世纪,辣木就从印度传入我国台湾,目前在云南、广东、广西、海南、四川和贵州等地均有种植。
国内外对辣木的研究主要集中于良种选育[5]、栽培[6-7]、药理[8-10]、活性物质提取[11-12]等方面。辣木的主要育苗方式为播种繁殖,一般2年生开始正常结实,但在树下种苗很少出现,说明辣木种子需要特定的条件才能萌发。种子萌发是指有活力的种子受潮吸水后,进行呼吸、蛋白质合成及其他代谢活动,经过一定时期,种胚突破种皮,露出胚根的过程[13]。目前关于促进辣木种子萌发技术的研究已有些报道[14-16],还有一些关键问题需要解决,如辣木种子浸种时间、浸种温度和光照对种子萌发的影响、播种的最佳温度及杀菌剂浓度等。笔者通过试验分析辣木种子适宜的萌发条件,从而提高种子的萌发率。
1材料与方法
1.1供试材料及预处理供试材料为从尼日利亚采收的传统印度辣木种子,供试种子饱满、无虫蛀、无损坏。试验于2015年4~7月在室内进行。萌发盘底面铺有湿润干净纱布,将处理后种子播在上面,再盖1块干净的湿纱布。从放入光照培养箱开始记时,每隔12 h在纱布表面喷水,每隔24 h记录种子的开始萌发时间、萌发数量。
1.2试验设计与方法
1.2.1浸种温度、时间和培养温度试验。浸种温度设置20、40、60 ℃ 3个梯度,浸种时间设置0、12、24 h 3种,培养温度设置22、32、42 ℃ 3种(表1),试验采用L9(34)正交设计,开展3因素3水平试验,将种子置于恒温水浴锅中浸泡,在光照培养箱中培养。每处理40颗种子,重复3次。
正交试验具有综合可比性和均衡弥散性的优点,在浸种温度、浸种时间和培养温度的正交试验中共安排9次试验。对于正交试验某一因素的3种水平而言,其余2个因素的变化处于完全相似的状态,则对应的该因素3种水平的指标综合平均值主要是由于该因素变化引起的。因此,该试验通过综合平均值的比较,分别研究浸种温度、时间和培养温度3个因素对种子萌发率和发芽势的影响。

表1 正交试验因素及水平
1.2.2多菌灵杀菌试验。用75%乙醇对萌发盘消毒,将纱布和水经121 ℃高压灭菌锅灭菌30 min。在浸种时间为12 h、浸种温度为32 ℃、培养温度为32 ℃条件下,用多菌灵浸泡种子。设置多菌灵的稀释倍数分别为1 000倍、500倍、200倍,用无菌水作对照,浸泡时间为10 min,用无菌水清洗5遍后,将种子播在萌发盘上,当种子表面布满菌丝视为污染,记录后及时清理已污染种子。每处理40颗种子,重复3次。
1.2.3光照、带种壳试验。在浸种时间为12 h、浸种温度为32 ℃、培养温度为32 ℃、多菌灵稀释1 000倍的条件下,以光照带壳为对照,比较黑暗带壳、光照去壳处理对种子萌发的影响。将培养箱光强调至0 lx,作为黑暗处理;将培养箱光强调至20 000 lx,作为光照处理。每处理40颗种子,重复3次。
1.3数据统计与分析用Excel2007进行数据统计,使用SPSS统计软件进行方差分析,种子萌发各指标计算方法如下:
萌发率=萌发种子数/种子总数×100%
发芽势=日最高峰时种子萌发数/种子总数 ×100%
污染率=污染的种子数/种子总数×100%
2结果与分析
2.1浸种温度、时间及培养温度对辣木种子萌发的影响图1为不同浸种温度下种子萌发率的变化情况。当浸种温度为60 ℃时,种子的萌发率最低,少数种子到播种第4天才开始萌发,播种第8天停止萌发,萌发率为5.56%。20 ℃和40 ℃条件下浸种,种子从播种第2天开始萌发,到播种第7天结束萌发,萌发率最高。由此可见,高温浸种不利于种子萌发,浸种温度应控制在20~40 ℃。方差分析表明不同浸种温度处理下辣木种子萌发率差异达到显著水平(P<0.05)。
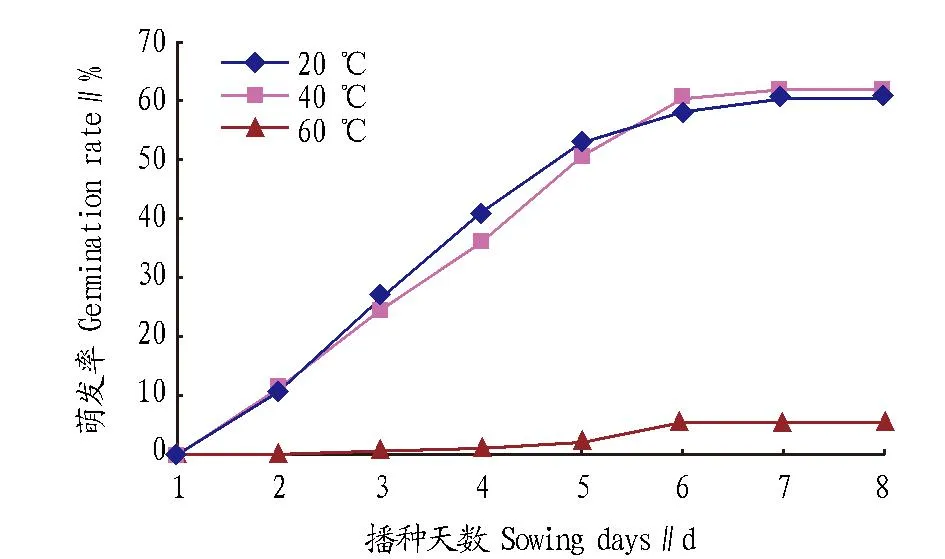
图1 浸种温度对辣木种子萌发率的影响Fig.1 Effects of soaking temperature on seed germination rate of M. oleifera
图2为不同浸种时间下种子萌发率的变化情况。不同处理在播种第2~3天开始有种子萌发,到播种第7~8天种子萌发结束。但在该试验范围内,浸种时间对萌发率没有明显影响。方差分析表明,不同浸种处理间辣木种子萌发率差异没有达到显著水平(P>0.05)。
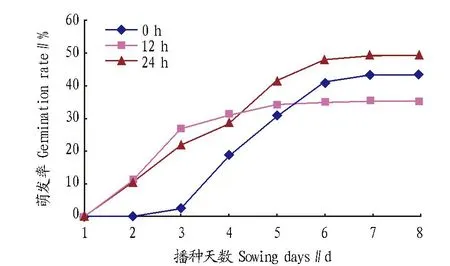
图2 浸种时间对辣木种子萌发率的影响Fig.2 Effects of soaking time on seed germination rate of M. oleifera
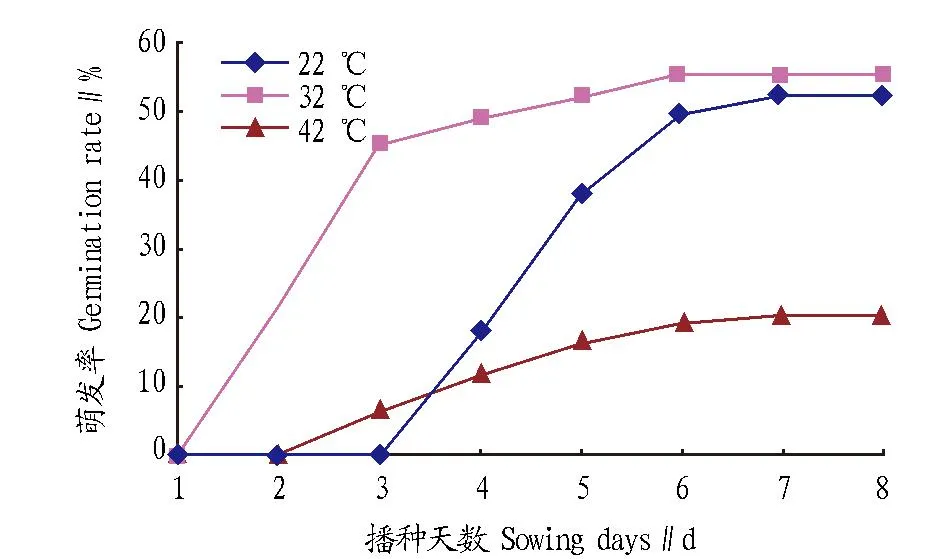
图3 培养温度对辣木种子萌发率的影响Fig.3 Effects of culture temperature on seed germination rate of M. oleifera
图3为不同培养温度下种子萌发率的变化情况。在42 ℃条件下培养,种子萌发率较低,只有20.3%;在32 ℃条件下培养,种子在第2天开始萌发,萌发率最高;在22 ℃条件下培养,种子推迟到第4天才萌发。由此表明,32 ℃是辣木种子萌发的最佳培养温度。方差分析表明,不同培养温度处理下辣木种子萌发率的差异达到显著水平(P<0.05)。
2.2多菌灵处理对辣木种子萌发的影响由图4可知,与对照相比,多菌灵能够抑制种子的污染,不同浓度多菌灵处理的种子萌发率和污染率没有显著影响,但使用多菌灵处理的种子污染率显著低于对照。综合考虑,选用1 000倍的多菌灵浸泡种子即可达到杀菌的目的。

注:各指标上小写字母表示差异显著(P<0.05)。Note:The different louercases of each index indicated significant differences at 0.05 lavel.图4 不同稀释倍数多菌灵对辣木种子萌发率和污染率的影响Fig.4 Effects of dilution times of carbendazim on seed germination rate and infection rate of M. oleifera
2.3光照和种壳对辣木种子萌发的影响由表2可知,全天光照和全天黑暗对种子萌发率和萌发势的影响没有显著差异。种壳对种子萌发率的影响没有显著差异,种子剥壳后培养,发芽势明显提高,第2天发芽势达70%以上,出苗整齐,种子发芽维持时间最短,到第4天萌发率达到最大值。
表2光照和种壳对辣木种子萌发的影响
Table 2Effects of illumination and seed coat on germination rate ofM.oleifera
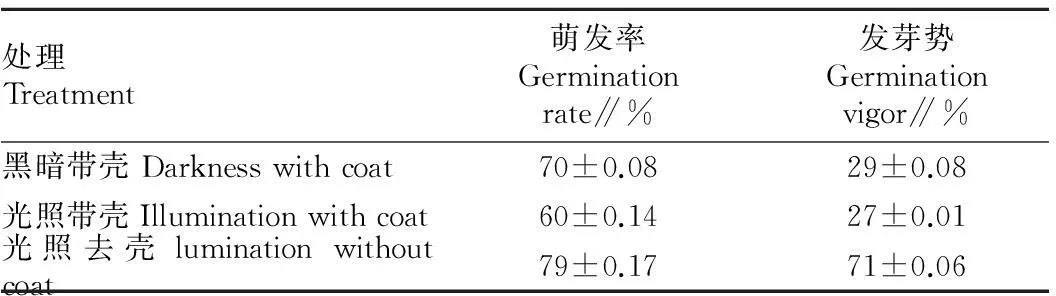
处理Treatment萌发率Germinationrate∥%发芽势Germinationvigor∥%黑暗带壳Darknesswithcoat70±0.0829±0.08光照带壳Illuminationwithcoat60±0.1427±0.01光照去壳luminationwithoutcoat79±0.1771±0.06
注:表中数据均为平均值±标准误,n=3。
Note: Data in the table were mean value ±standard error,n=3.
3结论与讨论
(1)该试验将辣木种子在60 ℃恒温水浴锅中浸种得到萌发率只有5.56%,比20~40 ℃浸种处理的萌发率低25.6个百分点,这与孔令芳等[17]研究结果不同,这可能是浸种处理时间不同引起的。该试验表明,辣木种子最佳萌发的培养温度为32 ℃,与龚德勇等[18]研究结果基本一致。
(2)冯燕燕等[19]研究表明多菌灵能显著促进土壤纤维素酶和脲酶等活性,有效降低土壤中真菌群落数量;张浩等[20]研究表明多菌灵在大豆植株内的消散速度快于土壤,收获期子粒最终残留量为0.005 mg/kg,低于FAO定义的多菌灵在大豆中的最大残留量(MRL,0.200 mg/kg)。目前,多菌灵较多用于食用植物,如葡萄[21-22]、人参[23]、香菇[24]等,但最终的残留量都低于MRL值,所以用多菌灵处理不仅能降低污染,而且还安全可靠。该研究表明,选用1 000倍的多菌灵浸泡种子可达到杀菌的目的。
(3)光照能影响很多植物种子萌发,如能促进细叶青蒌藤[25]、百合[26]等植物种子萌发,同时也会抑制沙芥和斧翅沙芥等植物种子[27]萌发。该试验表明,在种子萌发期间,光照有无对辣木种子萌发并没有影响,而关于光周期变化和光照强弱对辣木种子代谢过程是否有影响还需要进一步研究。
(4)不同植物种壳在解剖学上有较大差异,厚壁保护细胞的层数、角质层的有无、种壳的质地决定了种子的吸水性和透气性。种壳的作用具有两面性:一方面,在萌发的第一阶段,种壳作为一道物理屏障能够调节种子的膨胀速度,防止快速膨胀、损坏细胞膜;另一方面,种壳中存在抑制物或是由于机械阻力[28]抑制种子萌发,如辽东栎种子因覆盖胚根的种壳角质层较厚且具有一层致密的栅栏组织而限制其萌发[29],但也有研究表明种壳对萌发没有影响[30]。该试验结果表明,虽然种子有无种壳对萌发率没有影响,但剥壳有助于种子提早萌发和出苗整齐。
参考文献
[1] SON M E,CARLQUIST S.Stem and root anatomical correlations with life form diversity,ecology,and systematics inMoringa[J].Botanical journal of the linnean society,2001,135(4):315-348.
[2] GOPALAN G,RAMA SASTRI B V,BALASUBRAMANIAN S C.Nutritive value of indian foods[M]. Hyderabad,India:National Institute of Nutrition,Indian Council of Medical Research,2002.
[3] FUGLIE L J.The miracle tree:Moringaoleifera:Natural nutrition for the tropics[M].Dakar,Senegal:Church World Service,1999:11-28.
[4] MORTON J F.The horseradish tree,Moringapterygosperma(Moringaceae)-a boon to arid lands[J].Economic botany,1991,45:318-333.
[5] LEONE A,SPADA A,BATTEZZATI A,et al.Cultivation,genetic,ethnopharmacology,phytochemistry and pharmacology ofMoringaoleiferaleaves:An overview[J].International journal of molecular sciences,2015,16(6):12791-12835.
[6] 宿爱芝,郑益兴,吴疆翀,等.不同栽培密度对辣木人工林分枝格局及生物量的影响[J].生态学杂志,2012(5):1057-1063.
[7] 姚其盛.气雾栽培条件下药食植物辣木生长及品质研究[D].广州:广州中医药大学,2012.
[8] LIPIPUN V, KUROKAWA M,SUTTISRI R,et al.Efficacy of Thai medicinal plant extracts against herpes simplex virus type 1 infection in vitro and in vivo[J]. Antiviral Res,2003,60(3):175-180.
[9] SATHYA T N,AADARSH P,DEEPA V,et al.MoringaoleiferaLam.leaves prevent cyclophosphamide-induced micronucleus and DNA damage in mice[J].Int J Phytomed,2010,2:147-154.
[10] GANGULY R,GUHA D.Alteration of brain monoamines & EEG wave pattern in rat model of Alzheimer’s disease & protection byMoringaoleifera[J].Indian J Med Res,2008,128(6):744-751.
[11] 熊瑶.辣木叶蛋白质提取及其饮品研制[D].福州:福建农林大学,2012.
[12] 孙鸣燕,王羽梅.辣木叶总黄酮提取方法的优化研究[J].韶关学院学报,2007(12):88-92.
[13] BEWLEY J D,BLACK M.种子萌发的生理生化[M].南京:东南大学出版社,1990:1-2.
[14] 邱瑾,云叶,邱澄宇,等.辣木植物器官不同发育阶段的热值研究[J].集美大学学报(自然科学版),2006(4):320-325.
[15] 邱瑾,邓应钱,王铮敏,等.钙浸种对辣木种子萌发和幼苗生长的影响[J].三明学院学报,2007(2):189-191,226.
[16] 杜春花,陆斌,陈芳,等.辣木种子发芽试验及容器苗苗木分级研究[J].西北林学院学报,2008(1):108-110,120.
[17] 孔令芳,宋雅迪,陈艳林.不同处理方法对辣木种子萌发及生长状况的影响[J].大理学院学报,2012(4):48-49.
[18] 龚德勇,刘清国,班秀文,等.辣木种子的发芽特性及育苗试验初报[J].贵州农业科学,2006(S1):80-81.
[19] 冯燕燕.多菌灵对土壤酶和微生物的影响效应研究[D].石河子:石河子大学,2010.
[20] 张浩,王岩,逯忠斌.40%多菌灵SC在大豆和土壤中的残留动态[J].农药,2006(10):695-696.
[21] 李培培,陈敏,王军.QuEChERS-高效液相色谱法检测红葡萄酒中多菌灵和甲霜灵杀菌剂残留[J].食品与发酵工业,2015(1):202-206.
[22] 李雪,李梅,陈春丽,等.多菌灵在新疆葡萄中的最终残留分析[J].湖北农业科学,2015(4):957-959.
[23] 崔丽丽,闫梅霞,王春伟,等.液相色谱-质谱/质谱法检测人参和土壤中多菌灵的残留动态[J].分析科学学报,2015(2):223-227.
[24] 刘新锐,黎志银,谢宝贵,等.多菌灵对香菇菌丝生长影响及在子实体的残留研究[J].中国食用菌,2015(3):68-71.
[25] 罗志梁.光照、温度和沙藏对细叶青蒌藤种子萌发的影响[J].农业开发与装备,2015(6):66,68.
[26] 杨利平,宋满珍,张晶.光照和温度对百合属6种植物种子萌发的影响[J].植物资源与环境学报,2000(4):14-18.
[27] 宋兆伟,郝丽珍,黄振英,等.光照和温度对沙芥和斧翅沙芥植物种子萌发的影响[J].生态学报,2010(10):2562-2568.
[28] 樊璐,李淑娟,张蕊莲.光照和种皮对有髯鸢尾种子萌发的影响[J].中国农学通报,2010(12):200-202.
[29] 闫兴富,仇智虎,张嫱,等.种皮和播种深度对辽东栎种子萌发和幼苗早期生长的影响[J].应用生态学报,2014(1):53-60.
[30] 李建涛,罗品岗,施翔星,等.种皮和光照对小桐子种子萌发影响的研究[J].现代农业科技,2008(24):12,18.
中图分类号S 718.5
文献标识码A
文章编号0517-6611(2016)06-188-03
收稿日期2016-01-18
作者简介林孟飞(1991- ),女,浙江乐清人,硕士研究生,研究方向:辣木繁殖。*通讯作者,教授,博士,从事林木遗传育种、森林植物资源开发利用研究。
基金项目广东省林业厅资助项目(2015KJCX009);中华人民共和国农业部农垦局资助项目(15RZNJ-62)。

