H2O2对水稻幼苗生长和生理的调节
蔡凤香+陈豆豆+杨飞+郑欣+张思韬+赵凤云

摘要: 用水稻 (Oryza sativa L.) 中花 11 号分析了0.06%、0.006%、0.000 6% H2O2 处理 5 d 对水稻幼苗生长、H2O2 产生、细胞死亡及生长素积累分布的影响。结果表明,高浓度 H2O2 (0.06%)抑制地上部分和不定根的伸长及不定根上侧根的形成和生长,但对初生根上的侧根生长无明显影响。低浓度(0.000 6% )H2O2 促进初生根和不定根的伸长及其侧根数量增多和长度增加。根尖 H2O2 积累和细胞死亡随着 H2O2 浓度的增大而增加。利用 DR5-GUS 转基因水稻分析显示高浓度 H2O2 促进生长素在根尖的过量积累,本试验条件下 H2O2 对生长素积累和分布的调节与其激活转录有关。由此可见,高浓度 H2O2 对水稻幼苗生长的抑制作用与其诱导细胞死亡及生长素过度积累有密切关系。
关键词: 过氧化氢(H2O2);生长素;水稻;幼苗;生理调节;侧根数量;侧根长度;根尖细胞
中图分类号:S511.01 文献标志码: A
文章编号:1002-1302(2016)03-0074-04
H2O2是植物体内重要的信号分子,参与调节众多细胞应答过程,包括生长发育、向地性生长和激素信号等[1]。对H2O2与根系生长发育的关系研究发现,在正常和胁迫条件下H2O2都参与根系形态建成的调节。如用不同胁迫处理拟南芥,产生的表型非常相似,暗示有共同的分子-生理系统调节胁迫下的形态应答,推测H2O2在控制形态建成变化中可能起关键作用[2]。非胁迫条件下,清除H2O2促进拟南芥根的伸长但抑制根毛的形成[3-4]。研究还发现,H2O2 既是玉米根细胞壁松弛和伸长生长所必需的[5],也是水稻根生长所必需的[6]。H2O2 是黄瓜[7] 和绿豆[Mucuna pruriens (Linn.) DC. var. utilis][8] 不定根形成和发育的信号分子。这些结果表明,H2O2 对调节根系的生长发育可能起关键作用。众所周知,生长素是调节根系生长发育不可缺少的信号分子,它们是根细胞分裂、伸长生长、向地性应答和侧根发育必需的[9]。研究显示,H2O2 与生长素的相互作用对根系的生长发育产生影响。在正常生长条件下,生长素诱导H2O2 的产生是玉米根向地性生长所必需的[10]。用绿豆研究发现,外源生长素IBA诱导H2O2的过量产生,从而促进不定根的形成[8]。生长素促进番茄根尖H2O2 积累但抑制根的生长[11]。对拟南芥研究表明,H2O2代谢的变化可能通过影响生长素的平衡而控制胁迫诱导的形态生长应答[2]。氧化胁迫抑制拟南芥主根的伸长,但是能促进侧根的形成。在胁迫诱导的生长重新定向过程中,H2O2可能促进生长素驱动的细胞分裂[2]。这些研究表明,H2O2 和生长素之间的相互作用参与了根系生长发育的调节。笔者前期研究发现,Cd胁迫诱导水稻根系生长的变化与H2O2 的积累有关[12]。Zn对Cd胁迫水稻根系生长的调节与其减少H2O2产生并诱导生长素积累和分布的变化有密切关系[13]。本试验旨在研究非胁迫条件下外源H2O2调节水稻幼苗生长的生理机制。
1 材料与方法
1.1 材料与处理
挑选籽粒饱满的水稻种子(品种为中花 11 号),去壳后消毒:75%乙醇(30 s)、0.1% 氯化汞(15 min)、2% 次氯酸钠(20 min),用无菌水冲洗干净,再将种子植入MS 培养基上,放入培养箱内[光周期为 14 h光照,光照强度为 200 μmol/(m2·s),温度 26 ℃,夜间10 h,温度 20 ℃;相对湿度约为 50%~60%]培养6 d后转到Hoagland营养液,使其适应12 h后进行H2O2处理:在 Hoagland营养液中分别添加0.06%、0.006%、0.000 6%的H2O2处理5 d。每天更换1次培养液,每种处理重复3次,每次至少3个重复,每个重复约50株。
1.2 根系生长指标统计
初生根的长度:用尺子测量;初生根上侧根的数量:只统计大于1 mm的;初生根上侧根的长度:只测量5条最长的。每次重复测20株,每种处理统计60株。
不定根的数量:只计算大于1 cm的;不定根的长度:每株只测量5条最长的;不定根上侧根的长度:每株只测量5条最长的不定根上的侧根,每条不定根上只测量5条最长的侧根;每条不定根上侧根的数量:只统计大于1 mm的。每次重复测20株,每种处理统计60株。
1.3 H2O2的定性和定位测定
利用DAB染色法对根尖H2O2进行定性和定位分析[14],每种处理至少用20株染色。
1.4 细胞完整性的测定
通过Evans blue染色法对细胞完整性进行定性测定[15],每种处理至少染色20株。
1.5 根尖生长素分布和积累的测定
以转DR5-GUS 基因水稻为材料,通过GUS 染色法对根尖生长素的分布和积累进行测定,GUS 染色参考Petersson 等的方法[16]进行。转基因水稻种子在MS 培养基萌发生长6 d后转入Hoagland营养液使其适应12 h后添加0.06%的H2O2,在上述同样条件下处理3 h,该处理至少重复3次,每次重复至少用20株进行GUS 染色和活性测定。
1.6 H2O2 在RNA水平对水稻根系生长素分布的影响
将在MS固体培养基中培养6 d的水稻幼苗转入 Hoaglands 营养液中适应12 h。在Hoaglands营养液中加入 DRB (5,6-dichlorobenzimidazole 1-β-D-ribofuranoside,RNA 合成抑制剂,浓度为65 μmol/L)预处理2 h后取出,转入含0.06% H2O2的Hoaglands营养液中,在上述同样条件下处理3 h。该处理至少重复3次,每次重复至少用20株进行GUS 染色和活性测定。
1.7 数据处理
用SPSS软件对试验数据进行处理,求出3次重复试验的平均值和标准误差。利用单因子方差分析各种处理与对照之间以及3种不同处理之间的差异,P<0.05 代表差异显著。
2 结果与分析
2.1 H2O2对水稻幼苗生长的影响
2.1.1 H2O2对水稻幼苗株高和初生根长度的影响 图1-A显示,高浓度 H2O2 抑制植株生长,低浓度(0.000 6%)H2O2 对植株生长无显著作用。0.06% H2O2处理5 d时其幼苗的株高比CK的低 24.3%,差异显著(P<0.05)。低浓度(0.000 6%)H2O2 处理稍微促进初生根的伸长生长,但各浓度H2O2处理与对照组之间差异不显著(P>0.05)(图1-B)。
2.1.2 H2O2对水稻幼苗初生根上侧根数量和长度的影响 与CK相比,低浓度(0.000 6% )H2O2促进初生根上侧根数量的增多和长度的增加(P<0.05);高浓度(0.06% )H2O2处理幼苗初生根上侧根的数量和长度与对照组差异不显著(图2)。
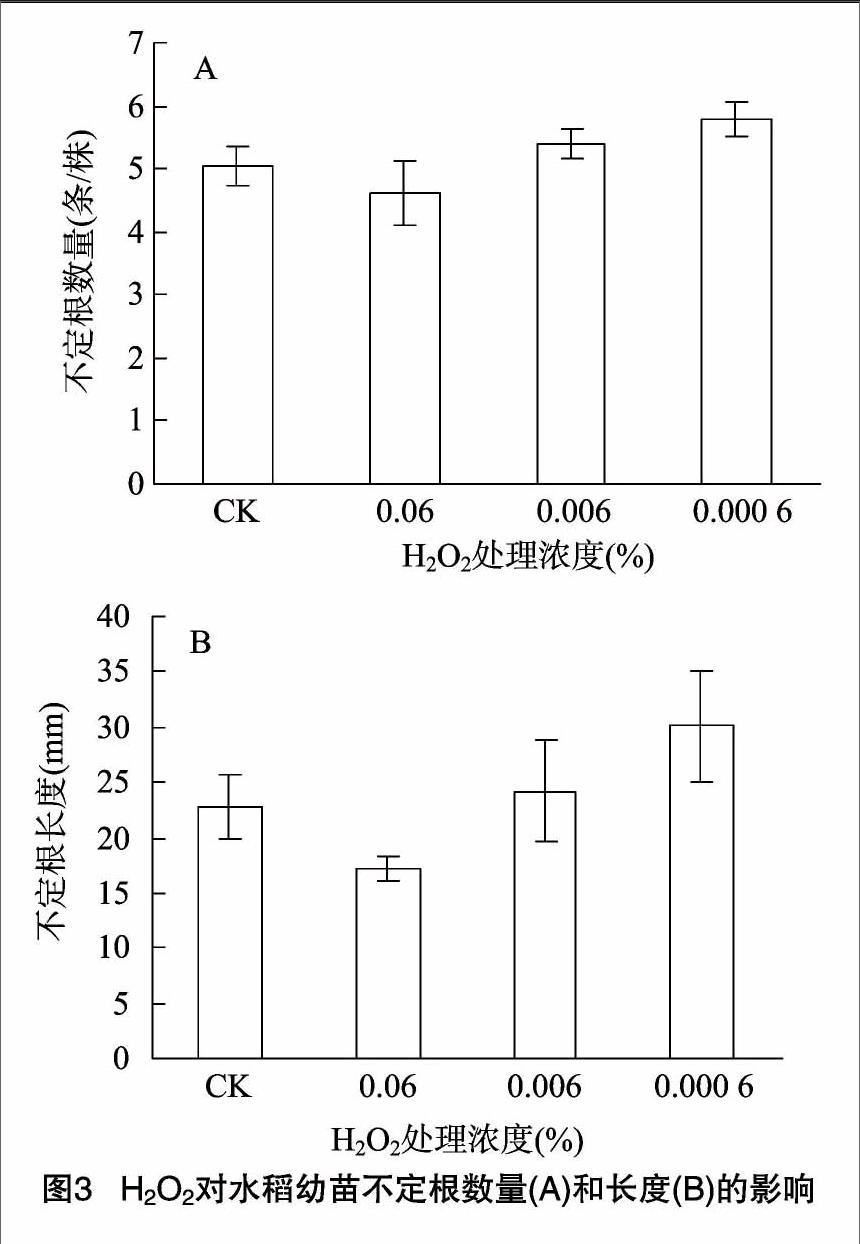
2.1.3 H2O2对水稻幼苗不定根数量和长度的影响 由图 3-A 可见,3种浓度的 H2O2 处理幼苗的不定根数量与对照组之间无明显差异(P>0.05)。高浓度(0.06% )H2O2处理抑制不定根的伸长生长,而低浓度H2O2 则促进不定根的伸长生长,0.000 6% H2O2处理的幼苗不定根比CK 的长32%(P<0.05),差异显著(图3-B)。
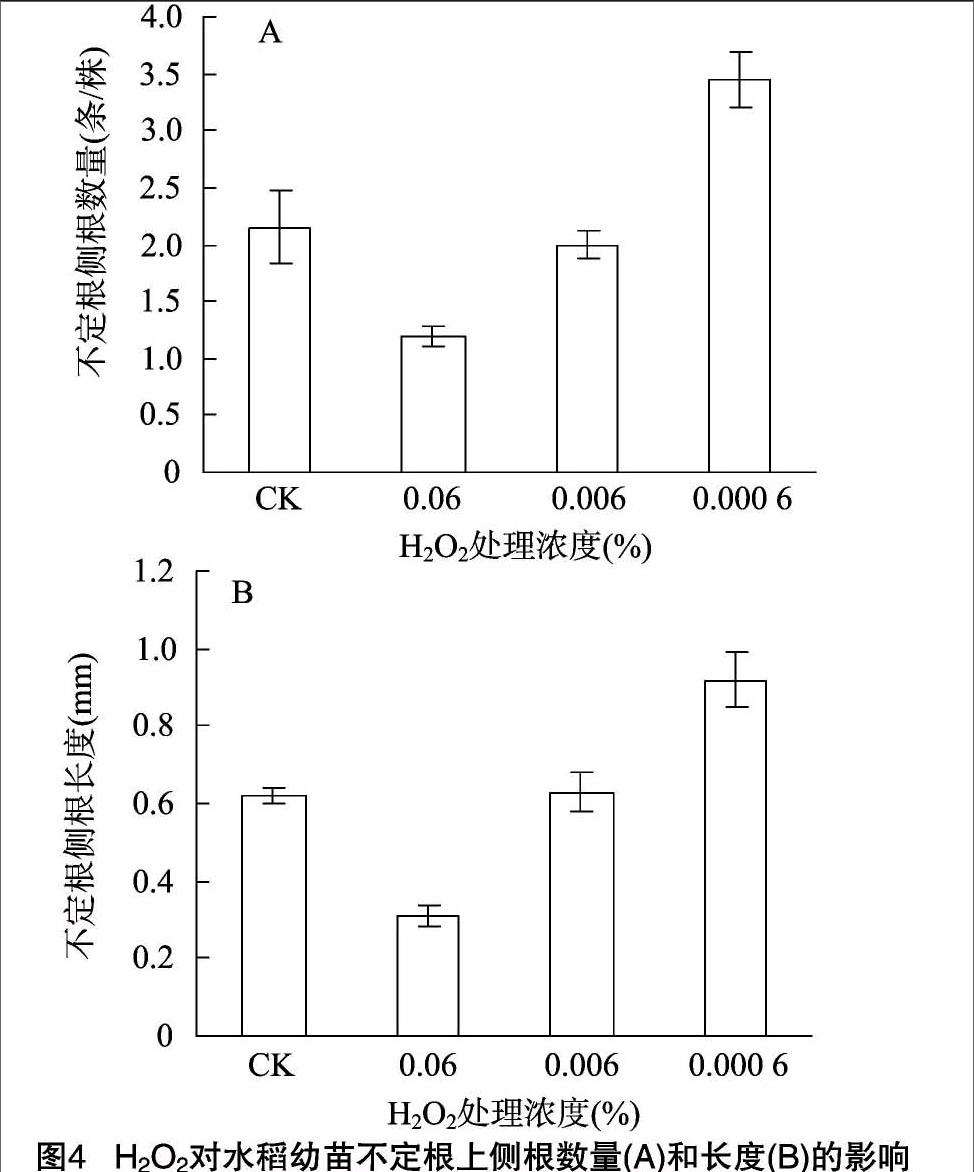
2.1.4 H2O2对水稻幼苗不定根上侧根数量和长度的影响
与对照组相比,低浓度(0.000 6% )H2O2促进不定根上侧根数量的增多和长度的增加(P<0.05);高浓度(0.06%)H2O2 处理显著抑制不定根上侧根的形成和生长(图4),该处理条件下不定根上的侧根数比对照组的少44.1%,差异极显著(P<0.01)。
2.2 H2O2处理对水稻幼苗根系H2O2积累和分布的影响
如图5所示,不同处理条件下初生根根尖上H2O2的积[JP3]累量存在差异,H2O2产生量由少到多的顺序为CK <0.000 6% H2O2<0.006% H2O2<0.06% H2O2。H2O2主要集中在成熟区前端和伸长区,外源H2O2浓度越高积累面积越大。H2O2在不定根根尖中的积累变化情况与初生根的类似(数据略)。
2.3 H2O2处理对水稻幼苗根系细胞完整性的影响
细胞完整性是检测氧化胁迫程度的重要指标之一,它与H2O2的积累有密切关系。为进一步了解外源H2O2 对细胞完整性的影响,试验利用Evans blue染色法定性测定了细胞完整性的变化。图6显示,不同浓度H2O2处理条件下初生根上染色程度和分布面积存在差异,染色由浅到深和面积从小到大的顺序为CK<0.000 6% H2O2<0.006% H2O2<0.06% H2O2。各种处理中染色深度与H2O2的积累(图5)基本一致。在不定根根尖中的染色变化情况与初生根的类似(数据略)。
2.4 H2O2对水稻幼苗根系生长素积累和分布的调节
生长素是调节根系生长的重要信号分子之一。为了解H2O2对水稻幼苗根系生长的调节是否与生长素有关,本试验利用转DR5-GUS 转基因水稻对0.06% H2O2处理幼苗根系生长素的分布和积累进行了测定 (图7)。与对照相比,H2O2诱导生长素在整个初生根根尖的积累明显增加,同样条件下不定根中生长素的积累和分布与初生根的类似(数据略)。为了进一步分析H2O2 调节生长素积累分布的机制,对根系分别进行了DRB (RNA合成抑制剂)、BFA(蛋白运输抑制剂)、CHX (蛋白合成抑制剂) 和 MG132(蛋白降解抑制剂)处理,结果显示H2O2 +DRB处理的初生根根尖生长素的积累比单一H2O2处理的明显减少。该处理条件下不定根中生长素积累也显著减少(数据略),但是在H2O2 +BFA/CHX/MG132处理条件下根尖生长素的积累与单一H2O2处理的无明显差异,说明本试验条件下0.06% H2O2 诱导生长素的增加与其激活转录有密切关系。
3 讨论
H2O2 是植物体内重要的信号分子之一,参与植物生长发育的众多过程[1-8]。本研究结果表明,高浓度 H2O2 抑制水稻幼苗地上部分及不定根的生长,特别对不定根上侧根的形成和生长具有显著的抑制作用,但低浓度的 H2O2 促进植物的生长。在本试验中,高浓度H2O2 对水稻幼苗生长的抑制作用可能与其诱导细胞的死亡增加有关。生长素在调节植物根系生长过程中发挥重要作用,但是生长素的过度积累则抑制植物的生长。大量研究显示,H2O2 与生长素的相互作用对根系的生长发育产生影响[2,8,11]。如生长素促进番茄根尖 H2O2 的积累但抑制根的生长[11]。笔者前期研究发现,Cd 胁迫下水稻根系生长的变化与 H2O2 的产生和生长素的积累分布有关[12]。Zn 对 Cd 胁迫水稻根系生长的调节也与其减少H2O2 产生并诱导生长素积累和分布的变化有密切关系[13]。本试验条件下高浓度(0.06%)的外源 H2O2 对水稻幼苗生长的抑制作用可能是由其诱导生长素的过度积累造成的。试验结果表明,H2O2 导致的生长素过度积累可能是通过激活转录途径调节的。由此可见,H2O2 和生长素互为因果关系,二者的平衡对调节植物的生长具有重要作用。综上所述,适量 H2O2 是调节植物生长所必须的。高浓度 H2O2 引起细胞死亡和生长素在根尖的过度增加从而抑制植物生长。
参考文献:
[1]Pasternak T,Potters G,Caubergs R,et al. Complementary interactions between oxidative stress and auxins control plant growth responses at plant,organ,and cellular level[J]. Journal of Experimental Botany,2005,56(418):1991-2001.
[2]Pasternak T,Rudas V,Potters G,et al. Morphogenic effects of abiotic stress:reorientation of growth in Arabidopsis thaliana seedlings[J]. Environmental and Experimental Botany,2005,53(3):299-314.
[3]Dunand C,Crèvecoeur M,Penel C. Distribution of superoxide and Hydrogen peroxide in Arabidopsis root and their influence on root development:possible interaction with peroxidases[J]. The New Phytologist,2007,174(2):332-341.
[4]Foreman J,Demidchik V,Bothwell J H,et al. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth[J]. Nature,2003,422(6930):442-446.
[5]Liszkay A,Van Der Zalm E,Schopfer P. Production of reactive oxygen intermediates O-2[KG-*2]· ,H2O2,and ·OH by maize Roots and their role in wall loosening and elongation growth[J]. Plant Physiology,2004,136(2):3114-3123;discussion 3001.
[6]Kim S G,Kim S T,Kang S Y,et al. Proteomic analysis of reactive oxygen species (ROS)-related proteins in rice Roots[J]. Plant Cell Reports,2008,27(2):363-375.
[7]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide involvement in formation and development of adventitious Roots in cucumber[J]. Plant Growth Regulation,2007,52(2):173-180.
[8]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide acts as a signal molecule in the adventitious root formation of mung bean seedlings[J]. Environmental and Experimental Botany,2009,65(1):63-71.
[9] Joanovic M,Lefebvre V R,Laporte P,et al. How the environment regulates root architecture in dicots[J]. Advances in Botanical Research,2008,46:36-74.
[10]Joo J H,Yoo H J,Hwang I,et al. Auxin-induced reactive oxygen species production requires the activation of phosphatidylinositol 3-kinase[J]. FEBS Letters,2005,579(5):1243-1248.
[11]Ivanchenko M G,Den Os D,Monshausen G B,et al. Auxin increases the hydrogen peroxide(H2O2) concentration in tomato (Solanum lycopersicum) root tips while inhibiting root growth[J]. Annals of Botany,2013,112(6):1107-1116.
[12]Zhao F Y,Han M M,Zhang S Y,et al. Hydrogen peroxide-mediated growth of the root system occurs via auxin signaling modification and variations in the expression of cell-cycle genes in rice seedlings exposed to cadmium stress[J]. Journal of Integrative Plant Biology,2012,54(12):991-1006.
[13]高华健,王玉祯,侯 丹,等. 锌调节镉胁迫水稻幼苗根系生长的生理机制[J]. 江苏农业科学,2013,41(12):49-52.
[14]Chen Z H,Feng T T,Liu L Y,et al. Effect of glucose on zinc-induced growth of root system in rice[J]. Agricultural Science and Technology,2011,12(9):1334-1337.
[15]Zhao F Y,Hu F,Zhang S Y,et al. MAPKs regulate root growth by influencing auxin signaling and cell cycle-related gene expression in cadmium-stressed rice[J]. Environmental Science and Pollution Research International,2013,20(8):5449-5460.
[16]Petersson S V,Johansson A I,Kowalczyk M,et al. An auxin gradient and maximum in the Arabidopsis root apex shown by high-resolution cell-specific analysis of IAA distribution and synthesis[J]. The Plant Cell,2009,21(6):1659-1668.

