miRNA-7对食管癌细胞TE-1化疗耐药的影响
温爽,杨晓煜,张敏,褚秀峰,钟根深,姬颖华△,路平△
miRNA-7对食管癌细胞TE-1化疗耐药的影响
温爽1,杨晓煜2,张敏1,褚秀峰1,钟根深3,姬颖华1△,路平1△
摘要:目的探讨微小RNA-7(miRNA-7)过表达对食管癌细胞TE-1顺铂敏感性的影响及其可能机制。方法用Lipofectmin 2000法向食管癌细胞株TE-1转染组瞬时转染miRNA-7 mimic,向转染对照组瞬时转染mimic Negative Control,通过RT-PCR检测以上2组及空白对照组的miRNA-7以及表皮生长因子受体(EGFR)mRNA表达情况。Western blot法分别检测转染组与转染对照组总EGFR及细胞浆、细胞核内的EGFR蛋白表达。CCK-8检测转染组与转染对照组TE-1的顺铂半数抑制浓度(IC50)。免疫荧光共聚焦显微镜观察转染组与转染对照组EGFR的表达。结果转染组较转染对照组及空白对照组的miRNA-7表达显著增高,EGFR mRNA表达下降(均P<0.001);转染组较转染对照组总EGFR降低,核内EGFR增高(均P<0.01),胞浆EGFR表达降低(P<0.05);CCK-8结果显示,TE-1中miRNA-7过表达后顺铂(48 h)IC50较转染对照组增高(P<0.01);免疫荧光示转染组较转染对照组核内EGFR增高且胞膜与胞浆EGFR表达减少。结论食管癌细胞TE-1中miRNA-7过表达可通过EGFR核转位增多使顺铂产生耐药性。
关键词:食管肿瘤;顺铂;受体,表皮生长因子;抗药性,肿瘤;微RNAs;核转位;微小RNA-7
△通讯作者E-mail:sunny8441_cn@sina.com;lupingdoctor@126.com
食管癌是我国常见的恶性肿瘤,目前治疗方案以手术联合放化疗为主[1]。顺铂(DDP)是晚期食管癌的一线治疗药物,但较易产生耐药性[2]。DDP主要作用于细胞的DNA,可导致DNA损伤并诱发细胞凋亡[3]。表皮生长因子受体(EGFR)是一种具有酪氨酸激酶活性的糖蛋白,主要分布在细胞膜表面,与其配体结合发挥生物学效应。研究发现,细胞核内EGFR可通过调节DNA修复,影响肿瘤细胞对DDP和放疗的治疗反应,这可能是食管癌DDP耐药的原因之一[4]。因此,抑制EGFR在理论上可恢复食管癌对DDP的敏感性。微小RNA-7(microRNA-7,miRNA-7)是miRNA家族成员之一,可直接作用于EGFR 3′-非翻译区(UTR),抑制EGFR mRNA及其蛋白表达[5]。miRNA-7能否增强食管癌细胞对DDP敏感性尚少见相关报道。本研究旨在通过转染技术观察miRNA-7过表达对食管癌TE-1细胞DDP敏感性的影响,并探究其可能的机制,以期为解决食管癌DDP耐药性提供参考。
1 材料与方法
1.1材料hsa- miRNA-7-5p mimic、mimic Negative Control(广州锐博生物公司);脂质体LipofectamineTM2000(Lip 2000,Invitrogen公司);opti-MEM(杭州吉诺生物医药技术有限公司);CCK-8(北京同仁化学);EGFR Rabbit mAb(Cell Signal⁃ing Technology);Tubulin、细胞浆蛋白和细胞核蛋白提取试剂盒、青霉素-链霉素(上海碧云天);荧光素标记(FITC)的羊抗兔二抗(武汉博士德公司);辣根标记的羊抗小鼠二抗、羊抗兔二抗(北京中杉金桥);Trizol(大连宝生物生物工程有限公司);引物合成(上海生工生物工程有限公司);E.coli Poly(A) Polymerase试剂盒(NEB公司);反转录试剂盒、常规及荧光定量PCR(RT-PCR)试剂(北京康为世纪生物工程有限公司);DDP(齐鲁制药厂);RPMI1640细胞培养液、胎牛血清(FBS,Hyclone);超净工作台(江苏苏净集团有限公司);低温台式高速离心机、CO2培养箱、全波长扫描酶标仪(美国Thermo Scientific);激光共聚焦显微镜(Olympus Corporation)。
1.2方法
1.2.1细胞培养人食管癌细胞株TE-1购自上海细胞库,本实验室长期冻存。参照文献[6],取对数生长期细胞进行实验。每组均设复孔,实验重复3次。
1.2.2细胞转染参照文献[7],收集对数生长期的TE-1细胞,将细胞重悬后接种于6孔培养板和96孔板培养板中,6孔板每孔约(4~5)×105个细胞,96孔板每孔约(4~5)×103个细胞。8 h贴壁培养,当细胞密度约50%~70%时按产品使用手册,应用Lip 2000法进行转染。hsa-miRNA-7-5p mimic、mimic Negative Control终浓度为50 nmol/L,Lip 2000按比例配置加入。hsa- miRNA-7-5p mimic作为转染组,mimic Neg⁃ative Control作为转染对照组,单纯Lip 2000作空白对照组。转染后分别于24、48、72 h收集细胞,取转染变化最明显的时点进行各组间统计比较。
1.2.3相关引物序列和RT-PCR miRNA-7引物序列:5′-CGGTGGAAGACTAGTGATTTTGTTG-3′。EGFR引物上游: 5′-AACCTTCTGGAGGGTGAGCC- 3′;下游:5′-GTTGTCTG⁃GTCCCCGTCCTG-3′。GAPDH上游:5′-GATCATCAGCAAT⁃GCCTCCTG-3′;下游:5′-CATGGACTGTGGTCATGAGTC-3′。细胞转染后,Trizol提取细胞总RNA后进行Poly(A)加尾,按照RT-PCR试剂盒说明书逆转录成cDNA。RT-PCR反应条件:95℃预变性10 min;95℃变性15 s;60℃1 min(采集SYBR荧光信号),60~95℃熔解曲线,40个循环。PCR反应结束后,1.5%琼脂糖凝胶电泳检测各个基因PCR结果。通过RT-PCR检测细胞样品中目的基因和内参基因的表达量,以GAPDH表达水平作为内参,通过2-ΔΔct法比较3组间miRNA-7和EGFR mRNA相对含量。
1.2.4Western blot应用RIPA裂解液,添加苯甲基磺酰氟(PMSF,1 mmol/L)提取细胞总蛋白、浆蛋白及核蛋白。蛋白浓度定量采用BCA法。样品应用10% SDS聚丙烯酰胺凝胶分离,转移至硝酸纤维素膜,5%BSA中封闭,分别应用EGFR抗体(1∶1 000)或内参抗体Tubulin(1∶1 000)抗体孵育,4℃过夜。室温下,采用辣根过氧化物酶标记的二抗摇床孵育。采用ECL化学发光法使条带显影,用成像软件扫描胶片并保存图片,用Image J图像分析软件分别测定转染组与转染对照组(经基因测定与观察,空白对照组对细胞基本无影响,与转染对照组无差异,故舍弃空白对照组)条带的光密度(OD)值。
1.2.5CCK-8法检测转染miRNA-7对TE-1 DDP敏感性的影响将TE-1接种至96孔板,设转染对照(NC)组与转染组,每组中均设定调零组和实验(0、1、2、3、4)组,每组5个复孔,实验组每孔100 μL细胞悬液,调零组加等量培养基。细胞贴壁后,实验组用Lip 2000法按说明书转染,48 h后加DDP处理。转染组中0~4组梯度DDP浓度分别为0、16.66、33.33、66.66及133.32 μmol/L,转染NC组中0~4组梯度DDP浓度分别为0、8.33、16.66、33.33及66.66 μmol/L。药物分别作用24、48及72 h后,按照CCK-8试剂盒说明书操作,继续孵育4 h后于波长450 nm处测OD值。以空白对照组细胞抑制率为100%,计算不同浓度药物对细胞增殖的抑制率。细胞增殖抑制率(%)=(1-药物组平均OD值/对照组平均OD值)×100%。以药物浓度为横轴,细胞抑制率为纵轴,绘制药物浓度-细胞抑制率曲线。实验重复3次,比较2组DDP的半数抑制浓度(IC50)。
1.2.6免疫荧光法观察EGFR核内外分布参照文献[8],取转染48 h后的TE-1细胞爬片,固定,0.1%TrionX-100透膜,10%BSA封闭,转染组及转染NC组一抗孵育(EGFR浓度1∶50,5%BSA稀释)4℃过夜,二抗孵育(FITC标记抗体,1∶50,1%BSA稀释),DAPI染核后缓冲甘油封片,共聚焦显微镜下观察。
1.3统计学方法采用SPSS 18.0统计软件分析。符合正态分布的计量数据以均数±标准差(x ±s)表示,2组间均数比较用t检验,多组间均数的比较采用单因素方差分析,组间两两比较采用LSD-t法。P < 0.05为差异有统计学意义。
2 结果
2.1过表达miRNA-7对EGFR mRNA及蛋白的影响48 h转染最明显,空白对照与转染对照组的miRNA-7、EGFR mRNA基因表达差异均无统计学意义;转染组miRNA-7较转染对照组及空白对照组明显增高,EGFR mRNA较转染对照组及空白对照组明显降低(均P < 0.001),见表1。Western blot结果示转染组(1.54±0.13)较转染对照组(2.94±0.10)总EGFR明显下降(t=30.98,P<0.01),见图1。
进一步拓展信息平台,在现有《装备承制单位名录》基础上,建立涵盖全国优势民营企业的信息平台,将众多的优势民营企业信息纳入信息平台,使之为军地共享。适度放开武器装备系统及配套装备采购信息的发布端口,扩展信息量。通过定期举办技术论坛、博览会、推介会等形式,加强各类先进技术特别是军民两用技术的相互交流,促进军地双方更进一步增进了解,使军方科技需求与地方资源优势实现无缝衔接。
Tab.1 The differences of the miRNA-7 and EGFR mRNA gene in three groups表1 不同处理组miRNA-7、EGFR mRNA基因表达的差异(n=3,2-ΔΔCt值,±s)

Tab.1 The differences of the miRNA-7 and EGFR mRNA gene in three groups表1 不同处理组miRNA-7、EGFR mRNA基因表达的差异(n=3,2-ΔΔCt值,±s)
**P < 0.01,a与(1)比较,b与(2)比较,均P < 0.001
组别空白对照组(1)转染对照组(2)转染组(3)F miRNA-7基因0.147 108±0.001 433 0.141 041±0.016 819 405.153 300±6.796 850ab10 650.00**EGFR mRNA基因0.002 723±0.000 188 0.002 207±0.000 355 0.000 909±0.000 019ab48.77**

Fig. 1 Effects of the over-expressed miRNA-7 on expression of total EGFR in TE-1 cells图1 miRNA-7过表达对TE-1中总EGFR表达的影响
2.2CCK-8法检测miRNA-7过表达对TE-1 DDP敏感性的影响转染组DDP IC50值显著高于转染对照组[(30.38±0.98)μmol/L vs (11.47±0.61)μmol/L,t= 38.67,P < 0.01],见图2。

Fig. 2 Effects of the over-expressed miRNA-7 on the sensitivity of cisplatin in TE-1 cells图2 miRNA-7过表达后TE-1对DDP的敏感性
2.3转染后2组核蛋白及浆蛋白中EGFR的表达转染48 h后,Western blot结果示转染组胞浆中EGFR表达低于转染对照组[(1.10±0.05) vs (1.60± 0.08),t=6.68,P < 0.05]。胞核中EGFR表达明显增高[(1.95±0.13) vs (0.95±0.03),t=17.14,P < 0.01],见图3。
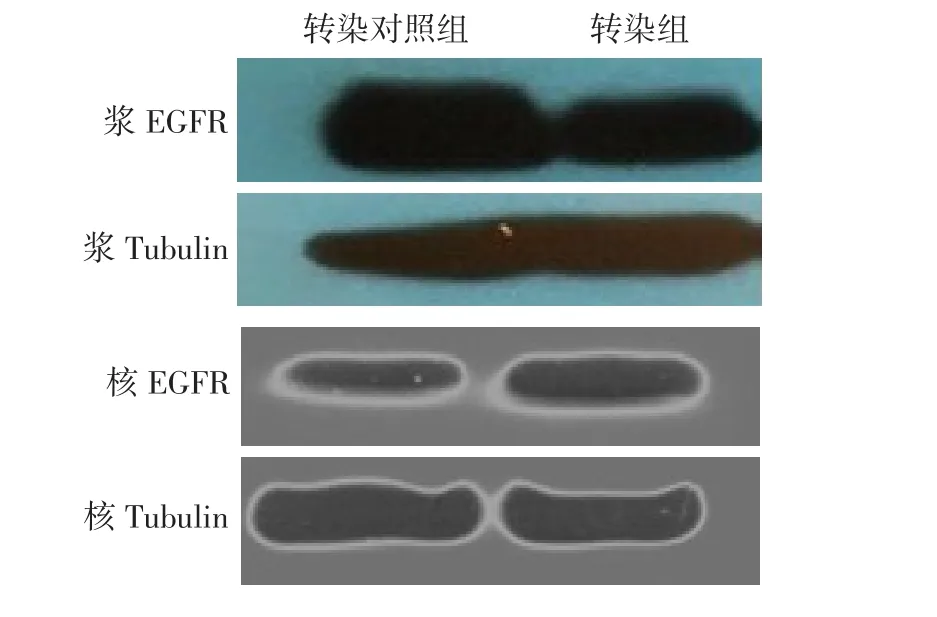
Fig. 3 Effects of the over-expressed miRNA-7 on cytoplasm expression of EGFR and nucleus expression of EGFR in TE-1 cells图3 miRNA-7过表达对TE-1细胞浆EGFR、细胞核EGFR表达的影响
2.42组TE-1细胞中EGFR的核内外分布情况EGFR免疫荧光用绿色标记。转染对照组荧光定位于胞膜和胞浆中,且细胞100%阳性表达;转染组EGFR核内高表达,胞膜和胞浆表达减少,细胞核95%阳性表达,见图4。
3 讨论
DDP通过使肿瘤细胞形成DNA加合物,造成DNA损伤,从而抑制肿瘤细胞DNA复制,使细胞分裂和再生停止,最终杀灭肿瘤细胞。然而,DDP耐药的产生,严重地影响了患者的疗效和生存质量[9]。目前DDP的耐药机制主要表现为细胞的DNA修复能力增强或者耐受DNA损伤能力增强。Wang等[10]和Huo等[11]发现,核内EGFR能够直接参与DNA损伤的修复和DNA的复制。当发生DNA损伤和氧化性应激后,核内EGFR与DNA依赖性蛋白激酶(DNA-PK)相互作用,并且通过与非配体依赖的途径使DNA修复,对射线等引起的DNA损伤产生抵抗效应[4,12]。EGFR单抗Erbitux可阻断EGFR核转移,降低DNA-PK的活性,增强残基DNA损害,进而降低放疗或化疗后肿瘤细胞的存活率[13]。本课题组在前期研究中亦发现,DDP可诱导食管癌EC9706细胞EGFR向核内移位[14]。因此,靶向抑制核内EGFR有可能逆转食管癌的DDP耐药。
miRNA -7在多种肿瘤中低表达,其能够通过抑制胰岛素样生长因子1受体(IGF1R)、EGFR、ACK1等基因的表达,抑制胃癌、肺癌、卵巢癌、恶性神经鞘瘤等多种恶性肿瘤的侵袭转移,起到抑癌基因的功能[15]。本研究结果显示,过表达miRNA-7可显著降低EGFR mRNA和总EGFR蛋白表达。然而,CCK-8增殖实验结果表明,过表达miRNA-7却增强了TE-1对DDP的耐药性。为揭示miRNA-7增强TE-1对DDP的耐药性的可能机制,本研究应用Western blot和免疫荧光等方法观察miRNA-7对EGFR核内外分布的影响。Western blot结果显示,过表达miRNA-7后胞浆中EGFR降低,但胞核中EGFR表达明显增高。免疫荧光结果同样显示,过表达miRNA-7使细胞膜和胞浆中EGFR表达明显减少,而增加了EGFR核内表达。这提示在食管癌TE-1细胞中,miRNA-7有可能增加了EGFR核转位,从而诱导了DDP耐药。核内EGFR能够诱导DDP耐药,而miRNA-7可抑制EGFR表达已经成为共识。因此,在实验进行前期,笔者推测miRNA-7过表达有可能使食管癌细胞对DDP增敏。Pogribny 等[16]研究显示,miRNA-7和miR-345在乳腺癌DDP耐药细胞中表达均下调,当转染miRNA-7和miR-345后,乳腺癌DDP耐药细胞可通过降低多重耐药相关蛋白1(MRP1)使细胞DDP敏感性增强。但本研究结果与前期预期及Pogribny等研究存在差异。这提示miRNA-7在不同肿瘤中的作用可能存在抑癌或促癌两面性,且具有主导信号通路的差异性。在食管癌细胞TE-1中,miRNA-7过表达使EGFR核转位的通路更具主导地位,促使DDP耐药,或者可能有其他的通路影响DDP耐药。
综上所述,在肿瘤的发生与发展过程中,miRNA扮演癌基因或抑癌基因的角色,在不同肿瘤中可能扮演的角色不同。本研究表明,食管癌细胞TE-1 中miRNA-7过表达可通过EGFR发生核转位,从而使DDP产生耐药,但具体机制有待进一步的研究。
(图4见插页)
参考文献
[1] Chinese Society of Esophagenal Cancer, Chinese Anti-Cancer Asso⁃ciation.Clinical practice guidelines for the diagnosis and treatment of esophageal cancer[M]. version 2. Peking:Peking Union Medical College Press,2013.[中国抗癌协会食管癌专业委员会编著.食管癌规范化诊治指南[M].第2版.北京:中国协和医科大学出版社,2013年].
[2] Tsutsui M, Kawakubo H, Hayashida T, et al. Comprehensive screen⁃ing of genes resistant to an anticancer drug in esophageal squamous cell carcinoma[J]. Int J Oncol, 2015, 47(3):867-874.doi:10.3892/ ijo.2015.3085.
[4] Liccardi G, Hartley JA, Hochhauser D. EGFR nuclear translocation modulates DNA repair following cisplatin and ionizing radiation treatment[J]. Cancer Res,2011,71(3):1103- 1114. doi: 10.1158/ 0008-5472.CAN-10-2384.
[5] Wang W, Dai LX, Zhang S, et al. Regulation of epidermal growth factor receptor signaling by plasmid-based microRNA-7 inhibits human malignant gliomas growth and metastasis in vivo [J].Neoplas⁃ma, 2013,60(3):274-283.doi:10.4149/neo_2013_036.
[6] Meng XL, Li WW, Cui YH, et al. Metformin improve cisplatin che⁃mosensitivity on esophageal cancer cell lines [J]. J of Xinxiang Med⁃ical University,2014,31(4):253-255. [孟祥丽,李伟伟,崔艳慧,等.二甲双胍对DDP治疗食管鳞癌的增敏作用[J].新乡医学院学报,2014,31(4):253-255]. doi:10.7683/xxyxyxb.2014.04.004.
[7] Zhang Q, Wang C. Effect and Mechanism of TGF-β mediated sig⁃nal pathway modulated by microRNA-21 in Hypertrophic Scars [J]. J of Tissue Engineering and Reconstructive Surgery, 2014, 10(6): 318-323. [张奇,王琛. microRNA-21调控TGF-β通路促进增生性瘢痕形成的机制研究[J].组织工程与重建外科杂志,2014, 10 (6): 318-323]. doi:10.3969/j.issn.1673-0364.2014.06.005.
[8] Li B, Zhang D, Pan YL, et al. A modified method for acute isolation of atrial myocytes in diabetic rats[J]. J of China Medical University, 2015, 44(2):164-167.[李斌,张迪,潘一龙,等.糖尿病大鼠心房肌细胞急性分离方法的改良[J].中国医科大学学报, 2015,44(2):164-167].
[9] Guo PR, Sheng YW, Liu B,et al. Influence of Ganoderma lucidum polysaccharide on the inhibitory effects of cisplatin on the tumor growth and angiogenesis in bladder cancer (T24) cells - bearing nude mice[J]. Med J Chin PLA, 2014,39(6):470-474.[郭鹏荣,盛玉文,刘奔,等.灵芝多糖对顺铂抑制荷膀胱癌T24细胞裸鼠肿瘤生长及血管生成作用的影响[J].解放军医学杂志,2014,39(6): 470-474].doi: 10.11855/j.issn.0577-7402.2014.06.09.
[10] Wang YN, Yamaguchi H, Hsu JM, et al. Nuclear trafficking of the epidermal growth factor receptor family membrane proteins[J]. J On⁃cogene, 2010, 29(28):3997-4006. doi: 10.1038/onc.2010.157.
[11] Huo L, Wang YN, Xia W, et al. RNA helicase A is a DNA-binding partner for EGFR-mediated transcriptional activation in the nucleus [J]. Proc Natl Acad Sci USA, 2010, 107(37):16125- 16130. doi: 10.1073/pnas.1000743107.
[12] Dittmann K, Mayer C, Fehrenbacher B, et al. Nuclear EGFR shut⁃tling induced by ionizing radiation is regulated by phosphorylation at residue Thr654[J]. FEBS Lett,2010, 584(18):3878-3884. doi: 10.1016/j.febslet.2010.08.005.
[13] Brand TM, Iida M, Luthar N, et al. Nuclear EGFR as a molecular target in cancer [J]. Radiother Oncol, 2013, 108(3):370-377. doi: 10.1016/j.radonc.2013.06.010.
[14] Cui YL.Study on the relationship between EGFR and cisplatin resis⁃tance in esophageal carcinoma[D]. Xinxiang Medical University, 2014. [崔月龙. EGFR核内迁移与食管癌顺铂耐药关系的研究[D].新乡医学院,2014].
[15] Kalinowski FC, Brown RA, Ganda C, et al. MicroRNA-7: a tumor suppressor miRNA with therapeutic potential[J].Int J Biochem Cell Biol, 2014,9(54):312-317. doi: 10.1016/j.biocel.2014.05.040.
[16] Pogribny IP, Filkowski JN, Tryndyak VP,et al. Alterations of mi⁃croRNAs and their targets are associated with acquired resistance of MCF-7 breast cancer cells to cisplatin[J]. Int J Cancer, 2010, 127(8):1785-1794. doi: 10.1002/ijc.25191.
(2015-05-14收稿2015-08-07修回)
(本文编辑陆荣展)
作者单位:1新乡医学院第一附属医院肿瘤科(邮编453100);2新乡医学院病理教研室;3新乡医学院第一附属医院神经病研究所
The effect of miRNA-7 on chemoresistance in esophageal cancer cell TE-1
WEN Shuang1,YANG Xiaoyu2,ZHANG Min1,CHU Xiufeng1,ZHONG Genshen3,JI Yinghua1△,LU Ping1△
1 Department of Oncology, the First Affiliated Hospital of Xinxiang Medical University, Henan 453100, China; 2 Department of Pathology, Xinxiang Medical University; 3 Research Institution of Neurology, the First Affiliated Hospital of Xinxiang Medical College
△Corresponding Author E-mail:sunny8441_cn@sina.com;lupingdoctor@126.com
Abstract:Objective To explore the impacts of over-expression of microRNA-7 (miRNA-7) on the sensitivity of cis⁃platin in esophageal carcinoma cell line TE-1, and the possible mechanism thereof. Methods Lipofectmin 2000 method was used to transient transfect with miRNA-7 mimic into esophageal cancer cell line TE-1, which was taken as transfection group, mimic negative control was taken as transfection conrtol group. The expressions of miRNA-7 and epidermal growth factor receptor (EGFR) mRNA were detected by RT-PCR in the above two groups and normal control group. The total EGFR and EGFR in cytoplasmic and nucleus were detected with Western blot assay in transfection group and transfection control group. CCK-8 was used to detect IC50of cisplatin in transfection group and transfection control group. The expression of EGFR was observed with immunofluorescence confocal microscope in two groups. Results The miRNA-7 expression was signifi⁃cantly increased in transfection group than that of transfection conrtol group and control group. The expression of EGFR mRNA was significantly reduced in transfection group (P<0.001). The total EGFR was significantly decreased in transfec⁃tion group than that of transfection conrtol group. The level of nuclear EGFR was significantly increased (P<0.01),and cyto⁃plasm EGFR expression was significantly decreased in transfection group than that of transfection control group (P<0.05). CCK-8 results showed that after the over expression of miRNA-7 in TE-1, the IC50of cisplatin (48 h) increased in transfec⁃tion group than that of control group (P<0.01). Immunofluorescence results showed that EGFG in nuclear was higher in transfection group than that of transfection control group but its expressions reduced in cell membrane and cytoplasm. Con⁃clusionThe over-expressed miRNA-7 in esophageal cancer cells TE-1 can reduce cisplatin sensitivity by the increased EGFR in nuclear translocation.
Key words:esophageal neoplasms; cisplatin; receptor, epidermal growth factor; drug resistance, neoplasm; microRNAs; nuclear translocation; miRNA-7
中图分类号:R735.1,R979.1
文献标志码:A
DOI:10.11958/58919
基金项目:新乡医学院科研项目培育基金资助项目(2013QN127)
作者简介:温爽(1989),女,硕士在读,主要从事恶性肿瘤的综合治疗研究

