紫杉醇/NLS-KALA-SA核定位纳米粒对肺腺癌A549细胞株的抑制作用
吴媛,谷继伟,荆红英,国玉芝,王晶,颜承云,△
紫杉醇/NLS-KALA-SA核定位纳米粒对肺腺癌A549细胞株的抑制作用
吴媛1,谷继伟2,荆红英2,国玉芝2,王晶2,颜承云1,2△
摘要:目的观察多肽自组装载体载紫杉醇纳米粒(NKSP)及紫杉醇单药对肺腺癌A549细胞株的体外抑制作用及可能机制。方法用噻唑蓝(MTT)法分别检测不同浓度组NKSP(20、40、80、100 μg/L)、紫杉醇单药(20、40、80、100 μg/L)作用24、48及72 h对A549细胞增殖的影响。流式细胞仪检测不加任何药物处理(A)组、加入80 μg/L的多肽自组装纳米粒(NKS)培养液(B)组、加入80 μg/L紫杉醇单药(C)组、加入含80 μg/L NKSP(D)组作用A549细胞48 h及72 h时的细胞凋亡率。Western blot检测A、B、C、D组作用48 h及72 h细胞凋亡相关蛋白bax、caspase-3的表达。结果紫杉醇单药、NKSP均能抑制A549的增殖,紫杉醇单药各组48和72 h时、NKSP单药各组在72 h时随浓度递增抑制率也呈递增趋势(均P < 0.05)。48 h时D组促A549凋亡作用低于C组(P < 0.05),72 h强于C组(P < 0.05),且药物作用48 h时D组的bax、caspase-3的表达低于C组,而72 h时高于C组(P < 0.05)。结论NKS包裹紫杉醇后可促使载体内的紫杉醇缓慢释放,与紫杉醇单药相比,可降低细胞毒性,延长抗肿瘤作用时间。
关键词:肺肿瘤;腺瘤病,肺;纳米球;抗肿瘤药;体外研究;紫杉醇;A549细胞
△通讯作者E-mail: 382841156@qq.com
肺癌是最常见的恶性肿瘤之一,占我国城市人口死亡原因第1位[1]。对于不能手术的患者,化疗为其治疗的主要手段[2]。紫杉醇是常见的细胞毒性化疗药物,其对非小细胞肺癌等多种肿瘤具有良好的治疗效果[3]。本课题组前期采用Fmoc多肽固相合成法依次将基因融合肽(KALA)、硬脂酸(SA)连接到核定位信号(NLS)多肽上,建立的多肽自组装纳米粒载体(NKS)能主动包裹紫杉醇等药物[4-5]。该NLS介导的KALA多肽纳米载体同时具有主动穿过细胞膜和跨膜转运入核的能力,SA烷基链可诱导多肽形成更加稳定的自组装体。KALA穿膜作用可实现细胞内吞,通过α-螺旋构象转变扰乱溶酶体的膜层,逃离内涵体进入细胞质,快速定位细胞核[6]。本研究旨在以NKS为载体制备紫杉醇纳米粒(NKSP)缓释制剂,探讨其用于肺癌靶向治疗的效果,以期提高药物的缓释特性及生物利用度。
1 资料与方法
1.1一般资料人肺腺癌A549细胞株(桂林医学院科学实验中心保存);紫杉醇注射液(桂林医学院附属医院肿瘤科提供);NLS-KALA-SA(自制);1640培养液购自gibco公司;胎牛血清购自依科赛公司;胰蛋白酶-EDTA消化液、10% SDS-聚丙烯酰胺凝胶配置体系购自Solarbio公司;噻唑蓝(MTT)购自华美公司;兔抗β-actin、bax、caspase-3购自万类生物公司;羊抗兔二抗购自北京中杉金桥有限公司;酶标仪、凝胶成像系统购自Bio- Rad公司;BD FACSAriaⅢ流式细胞仪、AN⁃NEXIN V-FITC细胞凋亡检测试剂盒购自美国BD公司;扫描电镜S4800购自日本高新技术公司。
1.2方法
1.2.1NKSP的制备将粉末状的NKS均匀涂抹于导电胶上,镀金,在扫描电镜S4800下观察。将粉末状NKS配成1 g/L的载体溶液,按照载体和紫杉醇的质量比为1∶1配成NKSP。NKS的制作结构式C18H36O2(SA)-WEAKLAKALAKA⁃LAKHLAKALAKALKACEA(KALA)-VKRKKKP(NLS),其中KALA加NLS合称为细胞穿膜肽(CPPs)。
1.2.2细胞培养用含有10%胎牛血清的1640培养基培养A549细胞,培养条件为37℃、5%CO2的培养箱。
1.2.3MTT实验检测紫杉醇单药及NKSP对A549细胞增殖的影响取对数生长期的A549细胞,胰蛋白酶消化,用1640完全培养液重悬成单个细胞悬液,以每孔5 000个细胞接种于96孔板中,每孔体积100 μL,培养24 h后,分设对照组(不加任何药物处理)和实验组,实验组分为不同浓度药物组(NKSP浓度分别为20、40、80及100 μg/L),紫杉醇(浓度分别为20、40、80及100 μg/L),每个浓度组分设6个复孔,分别培养24、48及72 h;每孔加入5 g/L MTT 20 μL, 37℃、5%CO2条件下继续孵育4 h,加入150 μL的二甲基亚砜(DMSO)终止反应,在37℃恒温振荡10 min, 450型ELISAReader酶标仪(Bio-Rad公司)490 nm单波长检测吸光度,计算各药物浓度对A549细胞增殖的抑制率。细胞抑制率(%) =(1-药物组吸光度/对照组吸光度)×100%。实验重复3次。计算紫杉醇单药及NKSP作用48 h时及72 h的半数抑制浓度(IC50)。
1.2.4流式细胞仪检测细胞凋亡率细胞培养至对数生长期,设A、B、C、D 4个组。A为空白对照组,不加任何药物处理的组;B组加入80 μg/L NKS的培养液;C组加80 μg/L紫杉醇单药;D组加入含80 μg/L NKSP,每组分别处理细胞48 h及72 h。待达到培养时间后,用胰蛋白酶消化,离心,收集细胞。用冷PBS洗涤、离心细胞2次(1 000 r/min,5 min),用1×Bind Buffer重悬细胞,调整细胞浓度为1×106个/mL ,取100 μL上述细胞悬液,避光条件下每组加入5 μL FITC和5 μL PI染料,15 min后每组加入400 μL 1×Bind Buffer,用流式细胞仪检测,FACSDiva Version 6.1.3软件分析结果。每组重复测3次。
1.2.5Western blot法观察凋亡相关蛋白bax、caspase-3的表达细胞培养至对数生长期,分组及干预措施同1.2.4。各组分别作用48 h及72 h后,用胰蛋白酶消化细胞,1 000 r/min离心5 min,PBS洗2遍,收集细胞,加入细胞裂解液,冰上裂解30 min,4℃、12 000 r/min离心20 min,取上清,以BCA法获得蛋白质定量值后沸水煮10 min备用。配制10% SDS-聚丙烯酰胺凝胶,恒压80 V电泳,恒流240 mA转膜1 h,常温下5%牛奶封闭2 h,一抗β-actin、bax、caspase-3(1∶500),4℃孵育过夜,二抗(1∶5 000),室温孵育1 h,凝胶成像系统发光。用Uvp grabit Image软件测定各条带的吸光度,以各组目的条带的吸光度值与内参β-actin吸光度值的比值作为细胞间蛋白表达量的比较。每组重复3次。
1.3统计学方法采用SPSS 18.0统计软件进行数据分析。符合正态分布的计量数据以±s表示,同种药物2个不同时间点的比较用独立样本t检验。多组间均数比较用单因素方差分析,两两比较用bonferroni法,P < 0.05为差异有统计学意义。
2 结果
2.1NKS的形貌圆形颗粒为NKS纳米粒,放大倍数为30 000倍,放射电流9 800 nA,见图1。

Fig. 1 The morphology of blank carrier(NKS)in SEM(×30 000)图1 扫描电镜下空白载体(NKS)的形貌(×30 000)
2.2紫杉醇单药及NKSP对A549细胞增殖的影响组间比较:紫杉醇和NKSP单药各浓度组间作用24 h时差异无统计学意义,其对A549细胞无生长抑制作用,后续实验及组内比较排除24 h数据;48、72 h时各组抑制率差异均有统计学意义(均P < 0.05),NKSP 20 μg/L与40 μg/L组间在48 h抑制率差异无统计学意义,见表1。组内比较:紫杉醇和NKSP单药各浓度组72 h抑制率均高于48 h(均P < 0.05),见表1。紫杉醇单药作用48 h和72 h时的IC50分别为64.8和63.2 μg/L。NKSP作用48 h时和72 h 的IC50分别为123.3和59.4 μg/L。后续实验为了取一个中间浓度,故选药物浓度为80 μg/L。
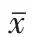
Tab.1 The inhibitory rates of A549 cells treated by various concentrations of paclitaxel monotherapy and NKSP monotherapy表1 各浓度组紫杉醇单药和NKSP单药作用A549细胞的抑制率 (n=3,%,±s)
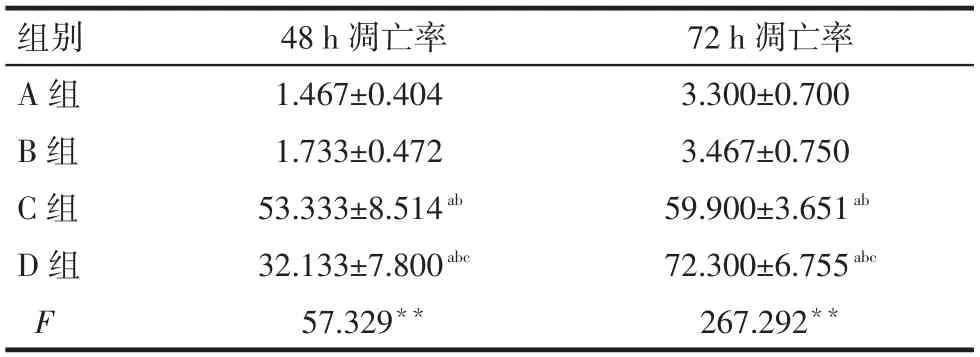
2.3流式细胞仪检测结果48 h时,C组与D组的细胞凋亡率均高于A组和B组,D组低于C组;72 h时,C组、D组高于A组B组,而D组高于C组(P < 0.05)。48 h及72时A组和B组凋亡率差异均无统计学意义,见表2、图1。
Tab. 2 The apoptotic rates after 48 h and 72 h treatment in four groups表2 各组分别作用48 h及72 h后的凋亡率(n=3,%,±s)
Tab. 2 The apoptotic rates after 48 h and 72 h treatment in four groups表2 各组分别作用48 h及72 h后的凋亡率(n=3,%,±s)
**P<0.01;a与A组比较,b与B组比较,c与C组比较,P<0.05
组别A组B组C组D组F 48 h凋亡率1.467±0.404 1.733±0.472 53.333±8.514ab32.133±7.800abc57.329**72 h凋亡率3.300±0.700 3.467±0.750 59.900±3.651ab72.300±6.755abc267.292**
2.4Western blot检测结果除72 h时A、B组bax差异无统计学意义外,其他各组间bax和caspase-3比较差异均有统计学意义,其中48 h时C组bax、caspase-3蛋白的表达量高于D组;72 h时低于D组(均P < 0.05),见图2、表3。
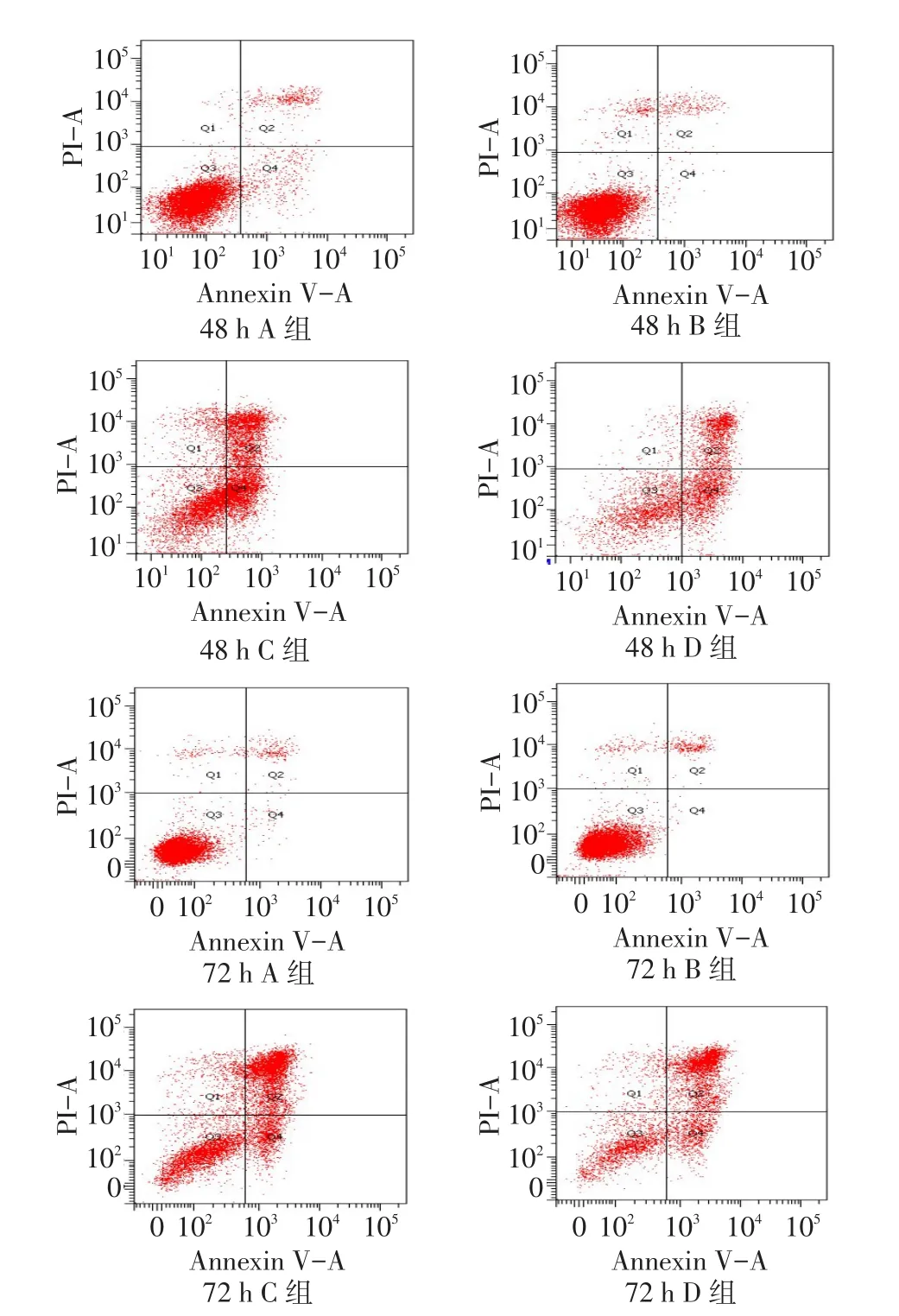
Fig. 1 The apoptotic results of flow cytometry in four groups of A549 cells图1 流式检测各实验组对A549凋亡的影响
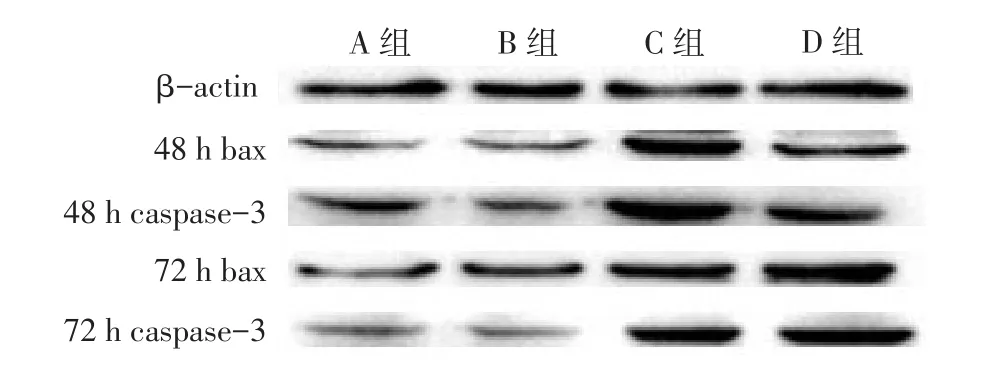
Fig. 2 Results of Western blot assay for apoptotic proteins bax and caspase-3 in four groups图2 Western blot检测各组对凋亡蛋白bax、caspase-3的影响
Tab. 3 Comparison of the expression amount of bax and caspase-3 after 48 h or 72 h treatment between four groups表3 各组48 h及72 h时bax、caspase-3表达量的比较(n=3,±s)
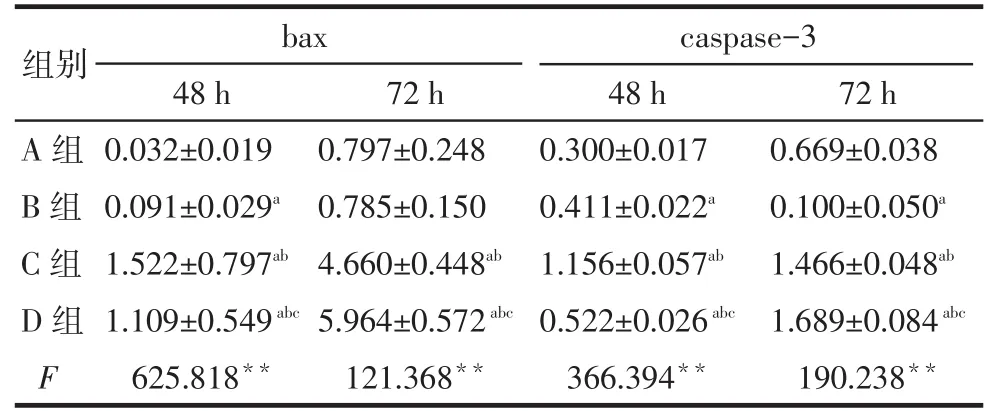
Tab. 3 Comparison of the expression amount of bax and caspase-3 after 48 h or 72 h treatment between four groups表3 各组48 h及72 h时bax、caspase-3表达量的比较(n=3,±s)
**P < 0.01;a与A组比较,b与B组比较,c与C组比较,P<0.05
组别A组B组C组D组F bax 48 h 0.032±0.019 0.091±0.029a1.522±0.797ab1.109±0.549abc625.818**72 h 0.797±0.248 0.785±0.150 4.660±0.448ab5.964±0.572abc121.368**caspase-3 48 h 0.300±0.017 0.411±0.022a1.156±0.057ab0.522±0.026abc366.394**72 h 0.669±0.038 0.100±0.050a1.466±0.048ab1.689±0.084abc190.238**
3 讨论
与其他生物大分子转运方式相比,细胞穿膜肽(CPPs)作为分子载体应用于体内外的入胞转运具有很多优势。首先,细胞穿膜肽能够有效转导具有不同分子质量和天然性质的大分子进入细胞;其次,细胞穿膜肽毒性相对较小[7]。该多肽分子中引入SA烷基链可以稳定α-螺旋肽的二级结构,并诱导多肽形成更加稳定的自组装载体。
紫杉醇是从红豆杉树皮中提取的具有抗癌作用的天然的广谱抗肿瘤药物。它通过促进细胞微管蛋白聚合,维系已聚合微管蛋白稳定,抑制细胞有丝分裂来实现抗肿瘤作用[8]。紫杉醇是常见的细胞毒性化疗药物,常用于肺癌的治疗,不良反应有骨髓抑制、超敏反应、心脏毒性等[9]。
本研究MTT实验结果显示,紫杉醇和NKSP单药各浓度组间作用24 h时差异无统计学意义,表明各组A549细胞无生长抑制作用,考虑原因可能为药物作用时间较短,药效发挥;NKSP各浓度组72 h抑制率均高于48 h,且在72 h时随着浓度的增大对A549的抑制作用也增强,表明NKSP可在体外抑制肺腺癌A549细胞的增殖,抑制作用具有浓度依赖性。流式细胞仪可以在大量凋亡细胞和坏死混合的条件下,快速、定量和准确地检测细胞活力[10]。本研究结果显示,48 h时紫杉醇单药导致的细胞凋亡率高于NKSP,而72 h时低于NKSP;48 h及72时B组凋亡率和A组差异均无统计学意义,表明NKS本身并没有导致A549凋亡的作用;而D组高于C组,提示NKSP药物具有缓释作用,同时又具有高效性,在同样浓度下能达到更好抑制肿瘤细胞的作用。Western blot实验显示,48 h紫杉醇单药组bax、cas⁃pase-3的表达量高于NKSP组,而72 h低于NKSP组,表明NKSP可能通过上调bax、caspase-3表达水平,来诱导A549细胞发生凋亡,提示NKSP对基因的调控速度相对单药紫杉醇起始较慢,但是随着作用时间的延长,其作用明显增强并且作用时间更加持久。
综上所述,笔者认为,NKS包裹紫杉醇后,可促使载体内的紫杉醇缓慢释放,从而降低了细胞毒性,延长了抗肿瘤作用时间。故NKSP有望成为抗肿瘤治疗的一种新药。
参考文献
[1] Yang T.Patients with non-small cell lung cancer and clinical signifi⁃cance sB7-H4 expression[J].Medical Theory and Practice,2015,15: 2061-2062.[杨焘.非小细胞肺癌患者血清中sB7-H4表达的临床意义[J].医学理论与实践,2015,15:2061-2062].
[2] Li WJ.Diallyl trisulfide and simvastatin induce apoptosisand inhib⁃its proliferation of A549 cells[D].Shandong University,2013:9.[李文军.大蒜素和辛伐他汀对肺癌A549细胞凋亡和增殖抑制的研究[D].山东大学,2013:9].
[3] Gu SJ,Li MB,Zhao WP,et al.Pharmacodynamics of paclitaxel longcirculating thermo-sensitive liposome in Lewis tumor-bearing mice [J].Chinese Medical Journal,2015,35(7):583-587.[顾生玖,李美波,赵文鹏,等.紫杉醇长循环热敏脂质体对Lewis肺癌荷瘤鼠的药效学[J].中国医院药学杂志,2015 ,35(7):583-587].
[4] Jain AK, Yusuf H, Pattani A,et al. Development of a method to quantify the DNA content in cationic peptide-DNA nanoparticles [J]. J Pharm Biomed Anal,2014, 100: 236-242.doi:10.1016/j/jp⁃ba.2014.07.036.
[5] Hyodo M, Sakurai Y, Akita H,et al. "Programmed Packaging" for gene delivery[J]. J Control Release, 2014, 193:316- 323.doi: 10.1016/j.jconrel.2014.04.023.
[6] Wang HY, Chen JX, Sun YX,et al. Construction of cell Penetrating PePtide vectors with N-terminal stearylated nuclear localization sig⁃nal for targeted delivery of DNA into the cell nuclei[J]. J Control Re⁃lease,2011, 155(1):26-33.doi:10.1016/j.jconrel.2010.12.009.
[7] Sun CM,Shen Y,Tu JS. Advance on the research of cell-penetrating peptides[J]. Chinese Pharmaceutical Journal, 2013,14:1143-1147.[孙春萌,沈雁,涂家生.细胞穿膜肽的研究进展[J].中国药学杂志, 2013,14:1143-1147].doi:10.11669/cpj.2013.14.002.
[8] Zhang L,Li YH,Wang CX,et al. Preparation of liposomal paclitaxel and its toxicity and antitumor effect[J]. Chinese Pharmaceutical Journal, 2013, 6:446-449.[张兰,李彦辉,王彩霞,等.紫杉醇脂质体的制备及初步毒性、药效学研究[J].中国药学杂志,2013,6:446-449].doi:10.11669//cpj.2013.06.012.
[9] Lin S,Lu L,Zeng JJ.Clinical observation of traditional chinese medi⁃cine washing in treatment of muscle and joint pain caused by pacli⁃taxel[J].Liaoning University of Traditional Chinese Med, 2015, 1: 189-191. [林森,陆玲,曾加佳.中药熏洗预防紫杉醇化疗引起肌肉关节疼痛临床观察[J].辽宁中医药大学学报, 2015, 1:189-191].doi:10.13194/j.issn.1673-842x.2015.01.067.
[10] Kang WW. 5-fluorouracil-chitosan nanoparticles preparation,char⁃acterization and a preliminary study on their anticancer effects to human ovary epithelial cancer cell[D].Fourth Military Medical Uni⁃versity,2013:36-44.[康卫卫. 5-FU-壳聚糖纳米粒的制备、检测及其对卵巢癌细胞的抑制作用[D].第四军医大学,2013:36-44].
(2015-07-02收稿2015-07-22修回)
(本文编辑陆荣展)
作者单位:1广西桂林,桂林医学院研究生院(邮编541004);2黑龙江佳木斯,佳木斯大学附属第一医院
Inhibition effects of paclitaxel/NLS-KALA-SA nanoparticles on A549 cell line in vitro
WU Yuan1, GU Jiwei2, JING Hongying2, GUO Yuzhi2, WANG Jing2, YAN Chengyun1,2△
1 Guilin Medical University, Guilin 541004, China; 2 First Affiliated Hospital of Jiamusi University
△Corresponding Author E-mail:382841156@qq.com
Abstract:Objective To observe NLS-KALA-SA-PTX (NKSP) for lung adenocarcinoma cell line A549 in vitro with paclitaxel monotherapy, and the mechanism thereof. Methods MTT assay was used to detect A549 cell proliferation influ⁃enced by different concentrations of NKSP (20, 40, 80, 100 μg/L) and paclitaxel monotherapy (20, 40, 80, 100 μg/L) for 24 h, 48 h and 72 h.. Subsequent experiments were divided into four groups, namely, group A (without any drug treatment), group B (added polypeptide 80 μg/L of self-assembled nanoparticles, NKS), group C (80 μg/L paclitaxel monotherapy) and group D (80 μg/L NKSP). Flow cytometry was used to detect the cell apoptotic rates after 48 h and 72 h treatment in four groups. Western blot assay was used to analyse the protein expressions of bax and caspase-3 after 48 h and 72 h treatment in four groups. Results Both paclitaxel monotherapy and NKSP can inhibit the proliferation of A549 cells. The inhibitory rates of paclitaxel monotherapy group at 48 h and 72 h and NKSP group at 72 h showed an increasing trend in a dose-depen⁃dent manner (P < 0.05). After treatment for 48 hours, the apoptotic rate was significantly higher in D group than that of C group (P < 0.05). But the apoptotic rate at 72 h was lower in D group than that of C group (P < 0.05). The protein expressions of bax and caspase-3 at 48 h were significantl lower in D group than those of C group, which were higher at 72 h in D group than those of C group (P < 0.05). Conclusion Compared to paclitaxel monotherapy group, NKS promotes slow release of pa⁃clitaxol, which reduces the cytotoxicity and extends the antitumor effects.
Key words:lung neoplasms;adenomatosis, pulmonary;nanospheres;antineoplastic agents;in vitro; paclitaxel; A549 cells
中图分类号:R734.2,R979.1
文献标志码:A
DOI:10.11958/59151
基金项目:国家自然科学基金资助项目(81260484);广西自然科学基金资助项目(2013GXNSFAA019226)
作者简介:吴媛(1990),女,硕士研究生在读,主要从事肿瘤靶向研究

