人牙龈成纤维细胞和牙周膜韧带细胞多向分化潜能的比较
苏瑞,宋立婷,董允允,邓嘉胤,蒋少云
人牙龈成纤维细胞和牙周膜韧带细胞多向分化潜能的比较
苏瑞,宋立婷,董允允,邓嘉胤,蒋少云△
摘要:目的体外培养人牙周膜韧带细胞(HPDLCs)和人牙龈成纤维细胞(HGFs),对比两者成骨、成软骨以及成脂的多向分化潜能的差异。方法运用酶消化结合组织块法体外培养HPDLCs和HGFs,选择生长状态良好的3~4 代HPDLCs和HGFs,进行成骨、成软骨、成脂诱导,未分化诱导的细胞作为对照组。分别用茜素红染色、油红O染色以及阿利新蓝染色分别检测两种细胞的成骨、成软骨及成脂分化能力。半定量逆转录聚合酶链反应(RT-PCR)检测HPDLCs和HGFs中相关标志基因骨钙素(OCN)、Ⅰ型胶原蛋白(Col 1)、runt相关转录因子2(RUNX2)、过氧化物酶体增殖物激活受体γ2(PPARγ2)、X型胶原蛋白(Col 10)mRNA的表达。结果成骨诱导两种细胞培养至28 d时,细胞周围均有红染钙结节形成,HPDLCs形成的钙结节明显多于HGFs;成软骨诱导两种细胞14 d时均可见胞质蓝染的细胞,HGFs较HPDLCs明显;成脂诱导两种细胞21 d时,可见红色脂肪滴形成,HPDLCs形成的脂肪颗粒明显少于HGFs。HGFs和HPDLCs分化培养7 d和14 d后,均有OCN、Col 1、RUNX2、PPARγ2和Col 10的表达,在14 d时的表达均高于7 d;HPDLCs中OCN、Col 1、RUNX2的表达高于HGFs,PPARγ2、Col 10的表达低于HGFs(均P<0.05)。结论HPDLCs的成骨能力较HGFs强,成软骨和成脂能力较HGFs弱。
关键词:人牙周膜韧带细胞;人牙龈成纤维细胞;细胞分化;成骨分化;成脂分化;成软骨分化
△通讯作者E-mail: sjiang@tmu.edu.cn
近年来,牙周炎导致牙周附着丧失、牙槽骨的吸收和牙齿的松动,已成为成年人失牙的主要原因。利用组织工程学获得牙周组织的再生已成为目前的研究热点。人牙周膜韧带细胞(human periodontal ligament cells,HPDLCs)和人牙龈成纤维细胞(hu⁃man gingival fibroblasts,HGFs)是牙周组织中两种主要的细胞成分,在细胞更新、组织修复以及组织再生中发挥重要的作用。已有研究证实,这两种细胞在一定条件下均有多向分化的潜能[1-2],但至今鲜见两者多向分化潜能比较的文献报道。本研究旨在通过对HPDLCs和HGFs进行体外成骨、成软骨、成脂的分化诱导,比较这两种细胞多向分化潜力的差异,为牙周组织工程学选择可靠种子细胞提供依据。
1 材料与方法
1.1材料DMEM培养液(低糖),胎牛血清,胰蛋白酶(Gib⁃co公司,美国);青/链霉素,Ⅰ型胶原酶,地塞米松,抗坏血酸,甘油磷酸钠,茜素红(Sigma公司,美国);吲哚美辛,3-异丁基-1-甲基黄嘌,胰岛素,饱和油红O,转化生长因子(transforming growth factor,TGF)-β1,阿利新蓝(北京索莱宝公司,中国);Trizol总RNA提取试剂盒(Invitrogen,美国)、cDNA逆转录试剂盒、半定量逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒(Pro⁃mega,美国);CO2细胞培养孵箱,低温高速离心机(Heraeus公司,德国);超净工作台(苏州净化设备厂);倒置显微镜及照相系统(Olympus公司,日本)。
1.2方法
1.2.1HGFs和HPDLCs的体外分离与培养选择2014年9月—10月就诊于天津医科大学口腔医院颌面外科的志愿者(无全身系统性疾病和吸烟),年龄18~25岁,因阻生齿(无龋病、牙周病)需拔除,经患者知情同意后,术中收集分离的新鲜健康牙龈组织培养HGFs。HPDLCs则是选择年龄12~ 18岁的志愿者,经患者知情同意后,收集因正畸需要拔除的双尖牙(无龋病、牙周病),采用Ⅰ型胶原酶消化结合组织块法培养HGFs和HPDLCs,两种细胞均待细胞爬出组织块并铺满瓶底达80%融合时,进行首次传代,用DMEM低糖培养基培养,取第3~4代细胞进行实验。
1.2.2细胞分化培养取生长状态良好的第3~4代HGFs 和HPDLCs,以1×104/mL的浓度接种于6孔板中,37℃温箱孵育至细胞达到80%融合时,弃原培养液,实验组加入诱导液。成骨诱导:含10 mmol/L β-甘油磷酸钠、50 mg/L维生素C、1×10-8mol/L地塞米松、3%胎牛血清、DMEM低糖培养基;其对照组为含3%胎牛血清的DMEM低糖培养基。成软骨诱导:含6.25 mg/L胰岛素,10 μg/L TGF-β1,50 mg/L抗坏血酸,3%胎牛血清、DMEM低糖培养基;其对照组为含3%胎牛血清的DMEM低糖培养基。成脂诱导:含0.25 μg/L地塞米松,2×10-4mol/L吲哚美辛,0.5 mmol/L 3-异丁基-1-甲基黄嘌,10 mg/L胰岛素,3%胎牛血清、DMEM低糖培养基;其对照组为含3%胎牛血清的DMEM低糖培养基。
1.2.3茜素红染色按照上述成骨诱导方法培养两种细胞,每周换液2~3次,培养至28 d,弃原培养液,PBS漂洗2次,4%多聚甲醛进行细胞固定30 min后,PBS漂洗3次,每次2~3 min,加入0.1%茜素红(Alizarin Red -S),室温放置30 min,PBS清洗2~3遍,直视及显微镜下拍照观察。
1.2.4阿利新蓝染色按照上述成软骨诱导方法培养两种细胞,每周换液2~3次,培养至14 d,弃原培养液,PBS漂洗2次,4%多聚甲醛进行细胞固定30 min后,PBS漂洗3次,每次2~3 min,加入阿利新蓝染色液,孵育过夜,3%醋酸漂洗3次,每次5 min,PBS清洗2~3遍,直视及显微镜下拍照观察。
1.2.5油红O染色按照上述成脂诱导方法培养两种细胞,每周换液2~3次,培养至21 d,弃原培养液,PBS漂洗2次,4%多聚甲醛进行细胞固定30 min后,PBS漂洗3次,每次2~3 min,加入油红O染色液,室温放置20 min,PBS漂洗2~3次,显微镜下拍照观察。
1.2.6RT-PCR按照1.2.2中3种分化培养基分别培养两种细胞,每周换液2~3次,取培养至7 d和14 d的细胞,弃原培养液,PBS冲洗,提取总RNA,按照RT-PCR试剂盒说明书逆转录合成cDNA。检测成骨诱导后HGFs和HPDLCs中成骨基因骨钙素(osteocalcin,OCN)、Ⅰ型胶原蛋白(collagen 1,Col 1)和runt相关转录因子2(runt-related transcription factor 2,RUNX2)的表达;成脂诱导后HGFs和HPDLCs中过氧化物酶体增殖物激活受体2(peroxisome proliferator-acti⁃vated receptor gamma 2,PPARγ2)的表达;成软骨诱导后HGFs和HPDLCs中X型胶原蛋白(collagen 10,Col 10)的表达。PCR引物由上海生工生物技术有限公司合成,引物序列如下:OCN上游5′-GTCCAAGCAGGAGGGCAG-3′,下游5′-TTGAGCTCACACACCTCCC- 3′;Col 1上游5′- AGGGC⁃CAAGACGAAGACATC-3′,下游5′-AGATCACGTCATCGCA⁃CAACA-3′;RUNX2上游5′-TCTGACCGCCTCAGTGATTT-3′,下游5′-CAGCGTCTATGCAAGTGAAACC-3′;PPARγ2上游5′-AGACAACCTGCTACAAGCCC-3′,下游5′-AGCGGGT⁃GAAGACTCATGTC- 3′;Col 10上游5′- CCCAGCACG⁃CAGAATCCATC-3′,下游5′-TCTTGGTGTTGGGTAGTGGG-3′;GAPDH上游5′-GCACCGTCAAGGCCTGAGAAC-3′,下游5′-ATGGTGGTGAAGACGCCAGT-3′。以上所有引物RTPCR的反应条件均为:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环,72℃终末延伸5 min。所得PCR产物经2%琼脂糖凝胶电泳,EB染色,紫外灯下拍照。使用Quantity One凝胶图像分析软件处理,以GAPDH作为内参基因,进行半定量RT-PCR分析。
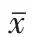
2 结果
2.1茜素红染色对照组细胞周围均无钙结节形成,而成骨诱导组的HGFs和HPDLCs周围均有大量红染的钙结节,但HPDLCs组中钙结节较HGFs组明显,见图1。
2.2阿利新蓝染色对照组细胞阿利新蓝染色阴性,成软骨诱导组的HGFs和HPDLCs镜下均可见胞质蓝染的细胞,但HGFs较HPDLCs明显,见图2。
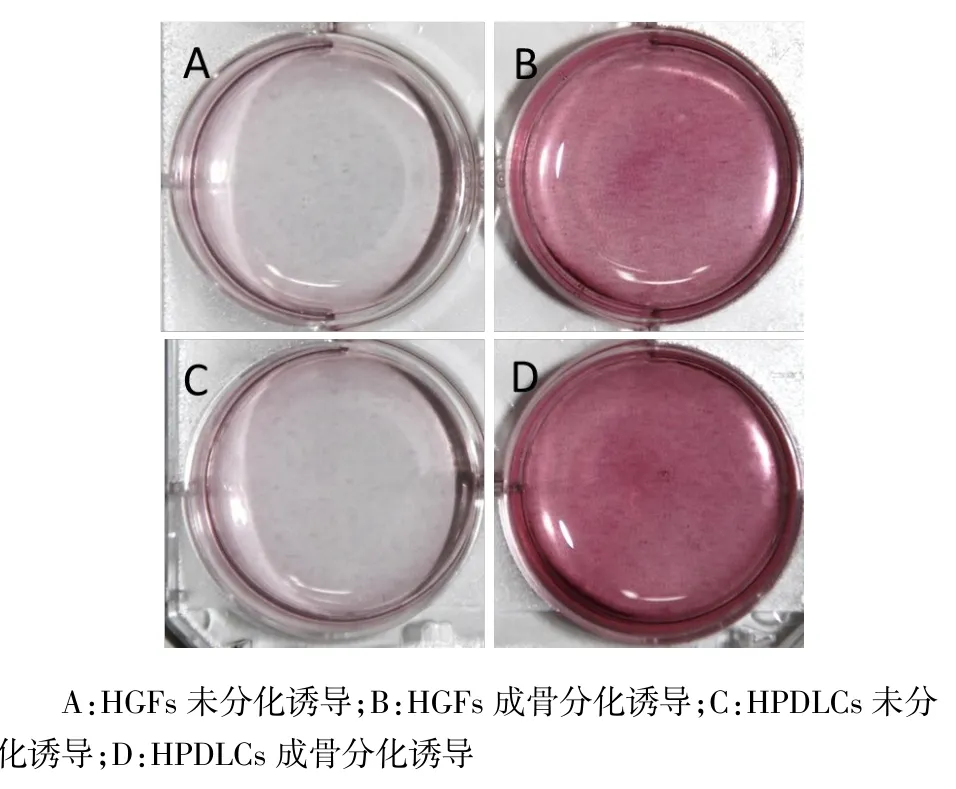
Fig. 1 Alizarin red staining in HGFs and HPDLCs induced in osteogenic medium图1 HGFs和HPDLCs成骨诱导茜素红染色

Fig. 2 Alcian blue staining in HGFs and HPDLCs induced in chondrogenic medium图2 HGFs和HPDLCs成软骨诱导阿利新蓝染色
2.3油红O染色HGFs加入成脂诱导液5 d后,细胞体积明显增大,形态由原来的长梭型变为尖椭圆形或者不规则形,诱导21 d后细胞形态改变更加明显,油红O染色后镜下可见细胞质内大小不一葡萄球样红色脂肪颗粒,数量较多。HPDLCs成脂诱导后,细胞形态变化缓慢,培养至21 d镜下可见少量细胞形态呈不规则形改变,油红O染色后极少数细胞质内可见球状红色脂肪颗粒。HGFs产生的脂肪颗粒明显多于HPDLCs。对照组油红O染色阴性。见图3。
2.4RT-PCR检测成骨、成软骨、成脂相关基因的表达(1)成骨诱导组HGFs和HPDLCs成骨诱导7 d和14 d后,均有成骨基因OCN、Col 1以及RUNX2的表达,成骨诱导14 d时其表达均高于7 d,同时其在HPDLCs中的表达均高于HGFs(均P<0.05),见图4、表1。(2)HGFs和HPDLCs成软骨诱导7 d和14 d后均有Col 10的表达,成软骨诱导14 d时Col 10的表达均高于7 d,HGFs中Col 10的表达均明显高于HPDLCs(均P<0.05),见图4、表2。(3)HGFs和HPDLCs成脂诱导7 d和14 d后,均有PPARγ2的表达,成脂诱导14 d时PPARγ2的表达均高于7 d,HGFs中PPARγ2的表达明显高于HPDLCs(均P<0.05),见图4、表3。

Fig. 3 Oil red O staining in HGFs and HPDLCs induced in adipogenic medium (×100)图3 HGFs和HPDLCs成脂诱导油红O染色(×100)
Fig. 4 The expression levels of OCN, Col 1, RUNX2, Col 10 andPPARγ2 at 7-day and 14-day after differentiation in HGFs and HPDLCs图4 HGFs和HPDLCs分化培养7 d和14 d后OCN、Col 1、RUNX2、Col 10和PPARγ2的表达
Tab. 2 Expressions of Col 10 at day 7 and day 14 after chondrogenic differentiation in HGFs and HPDLCs表2 HGFs和HPDLCs成软骨分化培养7 d和14 d后Col 10的表达 (n=5,±s)
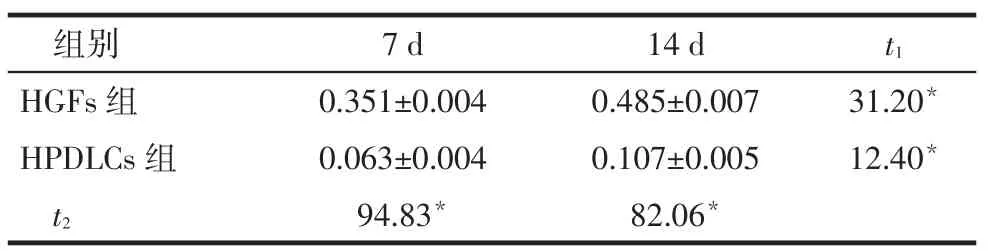
Tab. 2 Expressions of Col 10 at day 7 and day 14 after chondrogenic differentiation in HGFs and HPDLCs表2 HGFs和HPDLCs成软骨分化培养7 d和14 d后Col 10的表达 (n=5,±s)
组别HGFs组HPDLCs组t2 7 d 0.351±0.004 0.063±0.004 94.83*14 d 0.485±0.007 0.107±0.005 82.06*t1 31.20*12.40*
Tab. 3 Expressions of PPARγ2 at day 7 and day 14 after adipogenic differentiation in HGFs and HPDLCs表3 HGFs和HPDLCs成脂分化培养7 d和14 d后PPARγ2的表达 (n=5,±s)
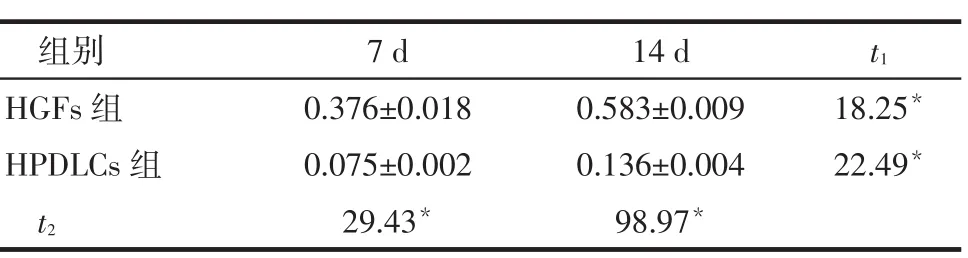
Tab. 3 Expressions of PPARγ2 at day 7 and day 14 after adipogenic differentiation in HGFs and HPDLCs表3 HGFs和HPDLCs成脂分化培养7 d和14 d后PPARγ2的表达 (n=5,±s)
组别HGFs组HPDLCs组t2 7 d 0.376±0.018 0.075±0.002 29.43*14 d 0.583±0.009 0.136±0.004 98.97*t1 18.25*22.49*
Tab. 1 The expression levels of OCN, Col 1 and RUNX2 at day 7 and day 14 after osteogenic differentiation in HGFs and HPDLCs表1 HGFs和HPDLCs成骨分化培养7 d和14 d后OCN、Col 1和RUNX2的表达 (n=5,±s)
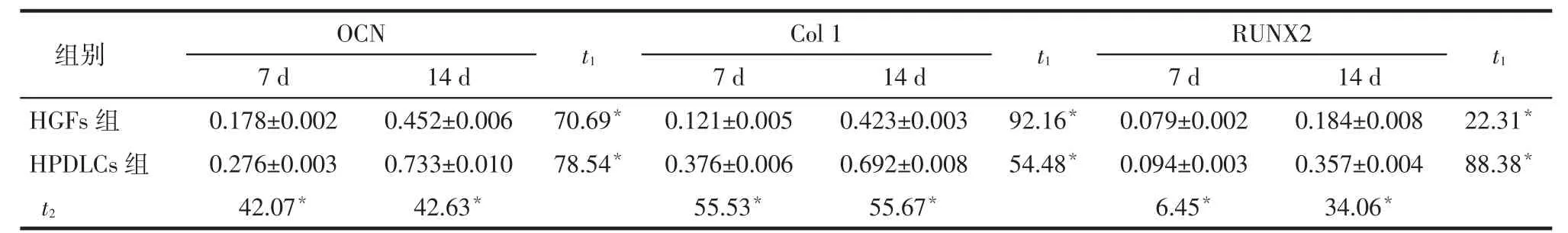
Tab. 1 The expression levels of OCN, Col 1 and RUNX2 at day 7 and day 14 after osteogenic differentiation in HGFs and HPDLCs表1 HGFs和HPDLCs成骨分化培养7 d和14 d后OCN、Col 1和RUNX2的表达 (n=5,±s)
t1为配对t检验所得t值,t2为独立样本t检验所得t值;*P < 0.05;表2~3同
组别HGFs组HPDLCs组t2 OCN 7 d 0.178±0.002 0.276±0.003 42.07*14 d 0.452±0.006 0.733±0.010 42.63*t1 70.69*78.54*Col 1 7 d 0.121±0.005 0.376±0.006 55.53*14 d 0.423±0.003 0.692±0.008 55.67*t1 92.16*54.48*RUNX2 7 d 0.079±0.002 0.094±0.003 6.45*14 d 0.184±0.008 0.357±0.004 34.06*t1 22.31*88.38*
3 讨论
本课题组前期研究显示,HPDLCs和HGFs作为牙周组织中两种主要的细胞成分,不仅参与炎症反应[3-4],而且具有成骨分化能力[1-2],均有望成为牙周组织再生中的细胞来源。OCN是骨组织中最丰富的非胶原蛋白,能够反映骨形成的速率,是骨代谢和骨细胞活性的特异性指标,其能够维持骨正常的矿化速率,抑制软骨的矿化速率[5];Col 1是成骨细胞分化过程中的重要基质,为组织的矿化提供基础;RUNX2是成骨分化过程中重要的转录因子,能够调控成骨细胞的成熟和分化,是骨形成的关键基因。本研究结果显示,茜素红染色后,成骨诱导组的HGFs和HPDLCs周围均有大量红染的钙结节,且HGFs和HPDLCs成骨诱导7 d和14 d后均有成骨基因OCN、Col 1、RUNX2的表达,进一步证实了HGFs和HPDLCs均能在体外诱导环境中成骨,与Jin等[6]和Mostafa等[7]的研究结果一致。另外,本研究显示,成骨诱导后HPDLCs组中钙结节较HGFs组明显,且HPDLCs成骨诱导7 d和14 d后OCN、Col 1、RUNX2的表达均高于HGFs,提示HPDLCs成骨向分化的能力较HGFs强。有研究显示HGFs基线水平即有一定成骨相关基因的表达,虽然相对于HPDLCs中Ⅰ型和Ⅲ型胶原强阳性的表达而言,HGFs的表达能力较弱,但HGFs仍具有HPDLCs的一些特性[8-9],此结果与本研究结果基本一致。但Chio等[10]研究显示,HGFs无明显的成骨能力,可能是由于成骨诱导培养基成分不同所致。本研究所采用成骨诱导培养基中地塞米松的浓度较Chio等[10]实验高,从而能更好地诱导HGFs成骨分化[11]。
阿利新蓝染色是细胞成软骨分化的重要标志。本研究中HGFs和HPDLCs成软骨分化诱导14 d时阿利新蓝染色均为阳性,提示二者均具有成软骨分化的潜能。Col 10是重要的软骨肥大标志分子,在成软骨分化诱导7 d和14 d后,HGFs中成软骨相关基因Col 10的表达较HPDLCs强,且阿利新蓝染色结果显示HGFs产生的阳性细胞多于HPDLCs,提示HGFs向成软骨分化的能力强于HPDLCs。
在体外成脂诱导的研究中发现,HGFs在诱导后5 d即发生细胞形态的明显变化,表现出脂肪细胞的形态;从成脂分化诱导7 d到14 d的过程中,细胞内成脂分化标志基因PPARγ2的表达逐渐上调,决定了HGFs成脂分化的方向,从而出现21 d油红O染色阳性明显的结果。但是,HPDLCs成脂诱导后,细胞形态变化缓慢,产生的脂肪颗粒明显少于HGFs,且HPDLCs中PPARγ2的表达明显低于HGFs,以上结果均证实HGFs较HPDLCs有更强的成脂分化能力。
总之,HPDLCs和HGFs均具有成骨、成软骨、成脂的多向分化潜能。二者在不同分化方向中的能力有差别,HPDLCs的成骨分化潜能较强,而HGFs的成软骨和成脂分化潜能较强。由于HPDLCs临床来源有限,而HGFs的细胞来源丰富,HGFs有望成为牙周组织工程学中的种子细胞,但其可能需要其他细胞因子的辅助,促进其成骨。
参考文献
[1] Liu J, Zhao HY, Xuan DY, et al. Differentiation characteristics of human periodontal ligament cell population in vitro [J]. West China Journal of Stomatology, 2010, 28(2):185-189.[刘娟,赵红宇,轩东英,等.人牙周膜细胞群多向分化潜能的实验研究[J].华西口腔医学杂志, 2010, 28(2):185- 189].doi:10.3969/j.issn.1000- 1182. 2010.02.018.
[2] Jiang SY, Tao YF, Li Y, et al. Study on differentiation pluripotency of human gingival fibroblasts induced in vitro [J]. Tianjin Med J, 2015, 43(7):713-716. [蒋少云,陶玉飞,李阳,等.体外诱导人牙龈成纤维细胞多向分化潜能的实验研究[J].天津医药, 2015, 43(7): 713-716].doi:10.11958/j.issn.0253-9896.2015.07.003.
[3] Jiang SY, Xue D, Xie YF, et al. The negative feedback regulation of microRNA-146a in human periodontal ligament cells after Porphy⁃romonas gingivalis lipopolysaccharide stimulation [J]. Inflammation research, 2015, 64(6):441-451.doi:10.1007/s00011-015-0824-y.
[4] Wei CC, Jiang SY, Deng JY. Inflammatory stimulation of Porphy⁃romonas gingivalis lipopolysaccharide on human gingival fibroblasts [J]. Tianjin Med J, 2013, 41(5):419-422.[魏丛丛,蒋少云,邓嘉胤.牙龈卟啉单胞菌脂多糖对人牙龈成纤维细胞炎症刺激作用的研究[J].天津医药, 2013, 41(5):419- 422]. doi:10.3969/j.issn. 0253-9896.2013.05.006.
[5] Kondo A, Tokuda H, Matsushima-Nishiwaki R, et al. Rho-kinase limits BMP-4-stimulated osteocalcin synthesis in osteoblasts:Reg⁃ulation of the p38 MAP kinase pathway [J]. Life Sci, 2014, 96(1-2): 18-25. doi: 10.1016/j.lfs.2013.12.017.
[6] Jin SH, Lee JE, Yun JH, et al. Isolation and characterization of hu⁃man mesenchymal stem cells from gingival connective tissue [J]. J Periodontal Res, 2014, 50(4):461-467. doi:10.1111/jre.12228.
[7] Mostafa NZ, Uludağ H, Varey M, et al. In vitro osteogenic induction of human gingival fibroblasts for bone regeneration [J].Open Dent J, 2011, 5:139-145.doi:10.2174/1874210601105010139.
[8] Zhou Y, Hutmacher DW, Sae-Lim V, et al. Osteogenetic and adipo⁃genic induction potential of human periodontal cells [J]. J Periodon⁃tol, 2008, 79(3):525-534. doi: 10.1902/jop.2008.070373.
[9] Li HX,Hong FF,Lei L.Effects of enamel matrix derivatives on prolif⁃eration and apoptosis in lipopolysaccharide stimulated periodontal ligament fibroblasts[J].Journal of Dental Prevention and Treatment, 2014, 22(9): 464-467.[李厚轩,洪菲菲,雷浪.釉基质衍生物对脂多糖作用下牙周膜成纤维细胞增殖和凋亡的影响[J].广东牙病防治, 2014, 22(9): 464-467].
[10] Chio JK, Hwang HI, Jang YJ. The efficiency of in vitro osteo/dentin⁃ogenic differentiation of human dental pulp cells, periodontal liga⁃ment cells and gingival fibroblasts [J]. Int J Mol Med, 2015, 35(1): 161-168. doi:10.3892/ijmm.2014.1986.
[11] Tao YF, Jiang SY, Yan ZM, et al. The effects of bone morphogenetic protein-2 combined with dexamethasone on proliferation and osteo⁃genic differentiation of human gingival fibroblasts [J]. Zhongguo Zu⁃zhi Gongcheng Yanjiu, 2014, 18(51):8248-8253. [陶玉飞,蒋少云,严志敏,等.骨形态发生蛋白-2联合地塞米松对人牙龈成纤维细胞增殖及成骨分化的影响[J].中国组织工程研究, 2014, 18 (51):8248-8253]. doi: 10.3969/j.issn.2095-4344.2014.51.010.
(2015-09-22收稿2015-10-16修回)
(本文编辑陈丽洁)
作者单位:天津医科大学口腔医院牙周科(邮编300070)
The comparison on pluripotent differentiation between human gingival fibroblasts and human periodontal ligament cells in vitro
SU Rui, SONG Liting, DONG Yunyun, DENG Jiayin, JIANG Shaoyun△
Department of Periodontology, Hospital of Stomatology, Tianjin Medical University, Tianjin 300070, China
△Corresponding Author E-mail: sjiang@tmu.edu.cn
Abstract:Objective To investigate the the multi-directional differentiation potential between pluripotent of human gingival fibroblasts (HGFs) and human periodontal ligament cells (HPDLCs). Methods HPDLCs and HGFs were obtained from the primary culture. HPDLCs and HGFs at 3rd-4thpassage were cultured in osteogenic, adipogenic or chondrogenic me⁃dium. Cells without differentiation were taken as control. Alizarin red, Alcian blue and oil red O staining were performed to detect osteogenic differentiation, chondrogenic and adipogenic differentiation in vitro, respectively. Reverse transcription polymerase chain reaction (RT-PCR) was applied to examine the expression of osteocalcin (OCN), runt-related transcription factor 2 (RUNX2) and collagen 1 (Col 1), peroxisome proliferator-activated receptor gamma 2 (PPARγ2) and collagen 10 (Col 10). Results HPDLCs and HGFs cultured in osteogenic medium showed massive calicium nodulus at day 28, but HP⁃DLCs formed more calicium nodulus than those of HGFs. The expressions of OCN, RUNX2 and Col 1 were significantly high⁃er in HPDLCs than those in HGFs (P<0.05). In chondrogenic medium both cells were found blue deposit at day 14, and the expression of Col 10 was significantly higher in HGFs than that of HPDLCs (P<0.01). Furthermore, in adipogenic medium HGFs showed more lipid-filled droplets stained with oil red O than HPDLCs at day 21. The expression of PPARγ2 was sig⁃nificantly higher in HGFs than that of HPDLCs (P<0.01). Conclusion HPDLCs has the better potency of osteogenic differ⁃etiation than HGFs, however, HGFs has the better potency of adipogenic and chondrogenic differentiation.
Key words:human periodontal ligament cells; human gingival fibroblasts; cell differentiation; osteogenic differentia⁃tion; adipogenic differentiation; chondrogenic differentiation
中图分类号:R781
文献标志码:A
DOI:10.11958/20150183
基金项目:天津市应用基础及前沿技术研究计划-自然科学基金重点项目(12JCZDJC22700)
作者简介:苏瑞(1987),女,硕士研究生,主要从事牙周炎发病机制及牙周再生的研究

