猪TGEV HN-2012株ORF3a和ORF3b基因遗传变异分析及其真核表达研究
曹贝贝,兰培英,2,韩 丽,刘玲玲,韦学雷,胡 慧,2
(1 河南农业大学 牧医工程学院,河南 郑州 450002;2 河南省动物性食品安全重点实验室,河南 郑州 450002)
猪TGEV HN-2012株ORF3a和ORF3b基因遗传变异分析及其真核表达研究
曹贝贝1,兰培英1,2,韩丽1,刘玲玲1,韦学雷1,胡慧1,2
(1 河南农业大学 牧医工程学院,河南 郑州 450002;2 河南省动物性食品安全重点实验室,河南 郑州 450002)
[摘要]【目的】 研究猪传染性胃肠炎病毒(TGEV)HN-2012株ORF3a和ORF3b基因的遗传变异情况。【方法】 根据GenBank公布的猪传染性胃肠炎病毒ORF3a和ORF3b基因序列,分别设计合成1对特异性引物,通过RT-PCR从猪传染性胃肠炎病毒HN-2012株的cDNA中扩增ORF3a和ORF3b基因,经克隆测序后,将其基因序列与NCBI中不同来源的TGEV毒株的相应序列进行同源性分析,构建系统进化树并进行遗传变异分析,然后将ORF3a和ORF3b基因亚克隆至真核表达载体,构建pCAGGS-ORF3a-flag和pCAGGS-ORF3b-flag载体,转染293T细胞进行表达,利用flag标签抗体对2个基因的蛋白表达情况进行Western blot分析。【结果】 TGEV HN-2012株的ORF3a基因与其他毒株间核苷酸的同源性为92.6%~100%,ORF3b基因与其他毒株间核苷酸的同源性为98.6%~99.7%。Western blot结果表明,ORF3a蛋白和ORF3b蛋白的分子质量约为8 ku和28 ku。【结论】 TGEV HN-2012株的ORF3a基因与CH/JLY2/08、CH/HLJH/08株等亲缘关系较近,ORF3b基因与TS株、Miller M6株等亲缘关系较近,与我国其他毒株关系较远;成功实现了ORF3a和ORF3b蛋白在293T细胞中的表达。
[关键词]TGEV 河南分离株(HN-2012);ORF3a和ORF3b基因;293T细胞;真核表达
猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)属冠状病毒科冠状病毒属成员,可导致猪传染性胃肠炎(Transmissible gastroenteritis,TGE)。TGE是猪的一种急性、高度传染性胃肠道疾病[1],以呕吐、水样腹泻为临床特征。不同年龄和品种的猪对该病均易感,其中2周龄以内的仔猪死亡率可达100%。该病呈世界范围分布[2],大多数养猪国家都有发生,给世界养猪业造成了巨大的经济损失。世界动物卫生组织(World Organization for Animal Health,OIE)将TGE定为B类传染病;我国从20世纪50年代末期就有该病的报道,近年来TGE在我国部分地区仍然时有发生和流行,属于我国法定检疫的疫病[3]。
TGEV的基因组为不分节段的单股正链RNA,3′端有Poly(A),基因组长约28.5 kb,编码4种结构蛋白(S、M、sM 和N)和3种非结构蛋白(ORF1、ORF3和ORF7)。ORF3编码基因包括ORF3a和ORF3b2个基因,不同毒株的ORF3b都为735 bp,而ORF3a因毒株的不同而长度不等。TGEVORF3a和ORF3b碱基不同程度缺失可使ORF3发生突变,将突变的TGEV在细胞中培养后进行毒力试验,结果表明TGEV的毒力有不同程度的减弱[4],说明ORF3对毒株毒力的强弱起重要作用。
本试验对TGEV河南新分离株(HN-2012)的ORF3a、ORF3b基因进行克隆及序列分析,并将其克隆到真核表达质粒pCAGGS中,在293T细胞中进行蛋白表达,以期为进一步研究ORF3a、ORF3b的生物学功能及TGEV的遗传变异和综合防治等奠定基础。
1材料与方法
1.1材料
1.1.1病毒细胞TGEV HN-2012株由河南省动物性食品安全重点实验室分离并保存;改造的真核表达载体pCAGGS和真核细胞293T由中国科学院武汉病毒研究所王汉中老师惠赠;pGEM-T Easy质粒载体购自Promega公司;大肠杆菌DH5α由河南省动物性食品安全重点实验室保存。
1.1.2主要试剂与仪器Trans 5K DNA Marker、Trans 15K DNA Marker购自南京百斯凯科技有限公司;QIAamp Viral RNA Mini Kit提取试剂盒和QIAGEN反转录试剂盒购自QIAGEN公司;DNA胶回收试剂盒、质粒提取试剂盒均购自OMEGA公司;KOD Neo DNA聚合酶购自TOYOBO公司;限制性内切酶XhoⅠ和BglⅡ均购自大连宝生物工程有限公司;T4 DNA连接酶和磷酸钙转染试剂盒均购自Promega公司;胎牛血清、DMEM购自Gibco公司;蛋白分子质量Marker为Fermentas公司产品;Western blot用HRP标记的二抗和显色系统购自Pierce公司;2×HBS溶液(140 mmol/L NaCl,1.5 mmol/L Na2HPO4·2H2O,50 mmol/L HEPS,调节pH值,0.22 μm滤器过滤);RIPA细胞裂解液(50 mmol/L Tris,150 mmol/L NaCl,体积分数1% NP-40,质量分数0.5%脱氧胆酸钠)。
紫外凝胶成像系统购自美国 SIM 公司;PTC-200型PCR仪、CO2培养箱、微量加样器购自美国 Thermo Forma 公司;超净工作台购自苏净集团安泰公司;LEICA DMIL倒置显微镜购自德国莱卡公司。
1.2PCR引物的设计与合成
分别根据GenBank公布的TGEVORF3a、ORF3b基因序列,利用Primer Premier 5.0软件设计1对引物,用于扩增ORF3a、ORF3b基因全长,长度分别为219和735 bp。引物由上海生物工程有限公司合成,引物用灭菌ddH2O稀释至 25 μmol/L,各引物序列及扩增片段长度见表1。
1.3TGEV HN-2012株cDNA模板的制备
取TGEV在ST细胞上的第八代毒,提取病毒RNA,操作步骤按照QIAGEN试剂盒说明进行。具体步骤为:吸取140 μL的样品于560 μL配好的Buffer AVL-carrier RNA中,涡漩振荡,瞬离,室温孵育10 min,加入560 μL的乙醇(体积分数96%~100%)至样本中,混匀,瞬离;将上步混合液吸取630 μL于QiAamp Mini columm(柱子)上,4 ℃、8 000 r/min离心1 min,丢弃带废液的旧管,移至新的2 mL的收集管中,重复此步骤。加入500 μL Buffer AW1,4 ℃、8 000 r/min 离心1 min,丢弃废管,移至新管。加入500 μL Buffer AW2,4 ℃、12 000 r/min 离心3 min,丢弃废管,移至新管。4 ℃、12 000 r/min空离1 min,移至新EP管中,60 μL的平衡酚Buffer AVE至膜上,室温放置1 min,4 ℃、8 000 r/min离心1 min。并利用QIAGEN反转录试剂盒反转录为cDNA。

表 1 引物序列及扩增片段预计长度
注:上游引物3a-F、3b-F中下划线部分为XhoⅠ酶切位点,下游引物3a-R、3b-R中下划线部分为BglⅡ酶切位点和flag标签序列。
Note:Underlined in upstream primers 3a-F and 3b-F wereXhoⅠ enzyme cutting sites,while those in downstream primers 3a-R and 3b-R wereBglⅡ enzyme sites and flag tags.
1.4TGEVORF3a/ORF3b基因的PCR扩增及克隆
PCR反应总体系为25 μL,其中TGEV HN-2012株cDNA模板2 μL,上下游引物各0.5 μL,KOD Neo DNA聚合酶0.5 μL,dNTPs 2 μL,10×PCR Buffer 2.5 μL,MgSO41 μL,灭菌ddH2O补至25 μL。反应条件为:95 ℃预变性4 min;94 ℃变性30 s,ORF3a基因53 ℃(ORF3b基因52 ℃)退火1 min,68 ℃延伸1 min,35个循环;最后68 ℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR产物,按OMEGA胶回收试剂盒操作说明回收目的片段,克隆到pGEM-T easy vector,进行PCR鉴定。
1.5ORF3a和ORF3b序列测定与分析
将经PCR鉴定正确的质粒送上海生物工程有限公司测序。运用生物信息学软件将所获序列与GenBank中登录的TGEV其他毒株的ORF3a、ORF3b基因序列及由其推导的氨基酸序列进行分析比较。参与比较的序列见表2。
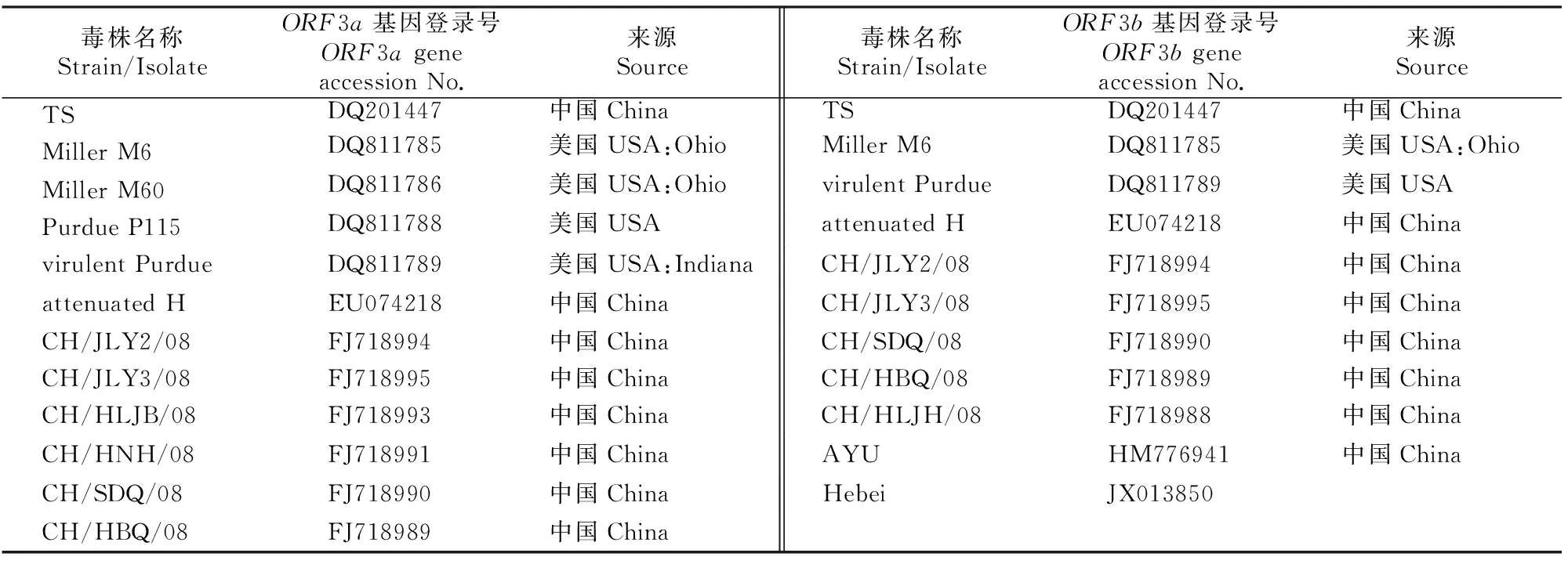
表 2 NCBI中所选TGEV毒株的ORF3a和ORF3b基因信息
1.6ORF3a和ORF3b基因真核表达载体的构建
利用限制性内切酶XhoⅠ和BglⅡ分别对pGEM-Teasy-ORF3a-flag、pGEM-Teasy-ORF3b-flag和pCAGGS载体进行双酶切,产物经1%琼脂糖凝胶电泳后,切取酶切产物,用胶回收纯化试剂盒分别回收目的片段,再用T4 DNA连接酶于16 ℃连接过夜,转入大肠杆菌DH5α感受态细胞中,涂布于含50 μg/mL Amp的LB平板上培养过夜,挑取单个菌落于5 mL液体LB培养基中培养12 h后,提取质粒,进行PCR及XhoⅠ和BglⅡ双酶切鉴定,将鉴定正确的重组质粒命名为pCAGGS-ORF3a-flag、pCAGGS-ORF3b-flag。
1.7重组质粒转染293T细胞
用含体积分数10%胎牛血清的DMEM培养基培养293T细胞,转染前1天将其接种到小的细胞培养皿(35 mm)上,转染前细胞密度达到80%左右;18~20 h后可用于转染。转染具体步骤为:①取出小皿培养的293T细胞,更换新鲜的含体积分数10%胎牛血清的DMEM培养液;②试验分为2组:第1组,取2支无菌的EP管,标记为A1和B1,先向A1管内依次加入对应体积的ddH2O 55 μL、pCAGGS-ORF3a-flag质粒 15 μL、CaCl230 μL,轻轻混匀(终体积为100 μL);B1管内加入100 μL的2×HBS溶液;第2组,取2支无菌的EP管,标记为A2和B2,先向A2管内依次加入对应体积的ddH2O 55 μL、pCAGGS-ORF3b-flag质粒15 μL、CaCl230 μL,轻轻混匀(终体积为100 μL);B2管内加入100 μL的2×HBS溶液;③将管A和管B溶液混合:即将管A内混合液慢慢滴加至管B中,一边滴加管A液体一边轻弹管B;④混合好后室温静置30 min;⑤将室温静置30 min的混合液(A+B)用移液器轻轻混匀后滴加到小皿内,置于体积分数5% CO2、37 ℃恒温培养箱内继续培养;⑥转染6 h后更换新鲜的培养液。试验同时设转染空质粒pCAGGS作为阴性对照。
1.8ORF3a和ORF3b蛋白表达情况的Western blot鉴定
收集转染24 h后的293T细胞,先用PBS洗1~2 次,向细胞中加入100 μL的RIPA细胞裂解液,冰上裂解10 min;4 ℃、12 000 r/min离心5 min;取上清液,加入 25 μL的5×上样Buffer,沸水中煮 10 min,4 ℃、12 000 r/min离心10 min,取上清液,进行SDS-PAGE电泳。利用半干转法将目标蛋白电转移至PVDF膜上,将膜放入体积分数5% BSA中4 ℃封闭过夜;TBST洗涤3次,每次5 min;加入flag标签抗体 4 ℃过夜或37 ℃放置1 h;TBST洗膜3次,每次5 min;加入1∶10 000稀释的羊抗鼠IgG(HRP标记),37 ℃孵育1 h;TBST洗膜3次,每次5 min;进行HRP显色。
2结果与分析
2.1TGEV HN-2012株ORF3a和ORF3b基因的PCR扩增
以TGEV HN-2012株cDNA为模板,加入ORF3a和ORF3b基因的上、下游引物,PCR扩增后分别在219 和735 bp处获得了一特异性条带(图1),与预期长度相符。

图 1 TGEV HN-2012株ORF3a(a)和ORF3b(b)基因的PCR扩增
2.2TGEV HN-2012株ORF3a和ORF3b基因的遗传变异分析
将PCR扩增得到的ORF3a和ORF3b基因全长克隆、测序后,运用生物信息学软件MegAlign对所测的基因序列进行分析。序列分析结果(表3)显示,TGEV HN-2012株ORF3a基因与attenuated H、CH/HLJH/08、CH/HBQ/08、CH/JLY3/08、CH/HNH/08株的核苷酸同源性最高,为100%;遗传进化分析显示,TGEV HN-2012株的ORF3a基因与CH/JLY2/08、CH/HBQ/08、CH/HLJH/08、attenuated H、CH/HNH/08和CH/JLY3/08亲缘关系较近,与其他毒株如Purdue P115株和virulent Purdue株关系较远(图2a)。TGEV HN-2012株ORF3b基因与Miller M6、CH/SDQ/08和Hebei株的核苷酸同源性最高,为99.7%(表4);遗传进化分析显示,HN-2012株的ORF3b基因与TS株、Miller M6株、CH/SDQ/08和Hebei株亲缘关系较近,与我国其他毒株如virulent Purdue株、AYU株关系较远(图2b)。
2.3重组质粒pCAGGS-3a-flag和pCAGGS-3b-flag的构建
重组质粒pCAGGS-3a-flag经XhoⅠ和BglⅡ双酶切获得了219 bp的条带(图3a),pCAGGS-3b-flag经XhoⅠ和BglⅡ双酶切获得了735 bp的条带(图3b),均与预期结果一致。

表 3 TGEV HN-2012株ORF3a基因的核苷酸同源性分析
注:1~14毒株分别为HN-2012、TS、virulent Purdue、Miller M6、Miller M60、Purdue P115、CH/SDQ/08、attenuated H、CH/HLJH/08、CH/HBQ/08、CH/JLY3/08、CH/HNH/08、CH/HLJB/08、CH/JLY2/08。
Note:1-14 strains were HN-2012,TS,virulent Purdue,Miller M6,Miller M60,Purdue P115,CH/SDQ/08,attenuated H,CH/HLJH/08,CH/HBQ/08,CH/JLY3/08,CH/HNH/08,CH/HLJB/08,and CH/JLY2/08, respectively.

图 2 TGEV HN-2012株ORF3a (a)和ORF3b(b) 基因的核苷酸进化分析

毒株Strain12345678910111299.6399.799.3499.098.698.8599.999.599.998.9699.599.099.598.599.6798.998.598.699.998.898.48100.099.699.798.699.999.598.9999.699.299.998.899.799.398.599.61099.799.3100.098.999.999.598.699.799.911100.099.699.799.099.999.598.9100.099.699.71299.799.399.598.899.699.298.699.799.399.599.7
注:1~12分别为Miller M6、TS、CH/HBQ/08、virulent Purdue、attenuated H、CH/HLJH/08、AYU、CH/SDQ/08、CH/JLY2/08、CH/JLY3/08、Hebei、HN-2012。
Note:1-12 strains were Miller M6,TS,CH/HBQ/08,virulent Purdue,attenuated H,CH/HLJH/08,AYU,CH/SDQ/08,CH/JLY2/08,CH/JLY3/08,Hebei,and HN-2012,respectively.

图 3 重组质粒pCAGGS-3a-flag(a)和pCAGGS-3b-flag(b)的酶切鉴定
2.4pCAGGS-3a-flag和pCAGGS-3b-flag在293T细胞中的表达
Western blot检测结果(图4)显示,在转染重组质粒pCAGGS-3a-flag和pCAGGS-3b-flag的293T细胞中,发现有针对flag标签抗体的特异性条带,条带大小分别约为(分子质量)8 ku和28 ku;而在转染空载体质粒的293T细胞中,未检测到相应的目的条带,说明重组质粒pCAGGS-3a-flag和pCAGGS-3b-flag转染293T细胞后可成功表达蛋白。
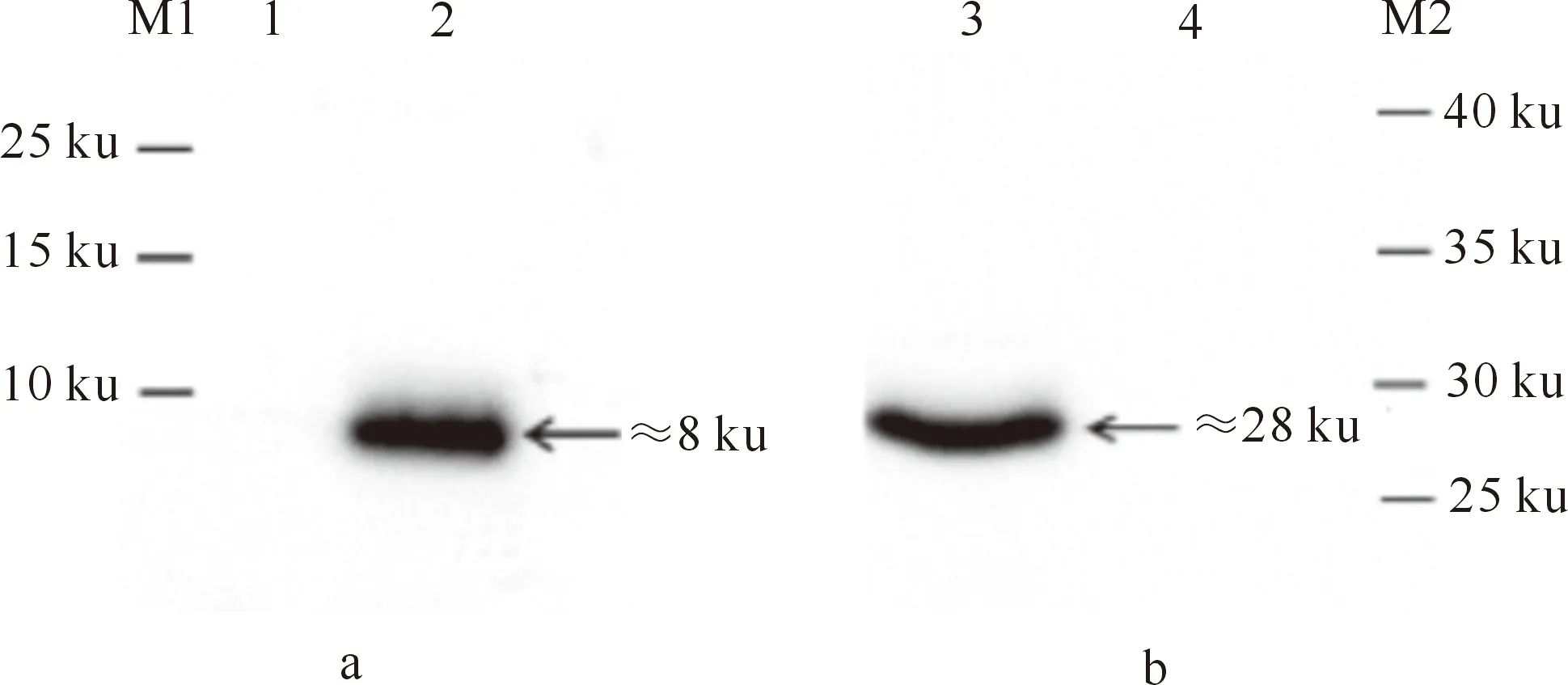
图 4 重组蛋白ORF3a(a)和ORF3b(b)的Western blot分析
3讨论
猪传染性胃肠炎病毒是一个典型的感染胃肠道的冠状病毒,但也可以在呼吸道组织中复制[5]。该病毒能耐受胃液中的低pH环境,感染覆盖在空肠和回肠绒毛上的柱状上皮细胞。当上皮细胞感染后,导致细胞脱落、绒毛萎缩以致腹泻[6]。所有年龄猪均对猪传染性胃肠炎易感,但仔猪最为严重。
TGEV复制周期及其影响因素比较复杂, 病毒编码结构蛋白和非结构蛋白的功能及其相互作用比较复杂, 这就可能决定了病毒与宿主抗病毒天然免疫反应及其机制的复杂性[7]。缺失ORF3基因的TGEV PUR46-MAD感染性克隆株在体内的致病力略有降低,但在细胞培养中能正常复制[7-8]。然而,另有研究显示,TGEV 96-1933毒株在ORF3a删除后仍能保持肠毒性,这表明ORF3a对维持毒力不是必不可少的,但是这种病毒的毒力需要进一步确认,因为病毒分离和测序未进行噬斑纯化,且纯化后的噬斑在猪体内并未测试[9-12]。
为了深入研究TGEV HN-2012株的ORF3a和ORF3b基因与其他毒株的进化关系,本试验进行了这2个基因遗传变异的分析比较,结果显示,TGEV HN-2012的ORF3a基因与其他毒株间核苷酸的同源性为92.6%~100%,与CH/JLY2/08、CH/HLTH/08株等亲缘关系较近;TGEV HN-2012株的ORF3b基因与其他毒株间核苷酸的同源性为98.6%~99.7%,与TS株、Miller M6株等亲缘关系较近,与我国其他毒株关系较远。对TGEV病毒变异及进化分析等方面的研究,有助于理解TGEV的分子生物学特性、遗传与变异规律,对新型疫苗的研发及抗病毒药物的筛选有重要的理论指导价值。
本研究成功构建了含ORF3a和ORF3b基因的真核表达质粒,并转染到293T细胞中,通过免疫印迹方法证实其可在真核细胞中成功表达,为进一步研究该蛋白的生物学功能和抗毒药的研制奠定了基础。
[参考文献]
[1]Chen C M,Cavanagh D,Britton P.Cloning and sequencing of a 8.4-kb region from the 3′-end of a Taiwanese virulent isolate of the coronavirus transmissible gastroenteritis virus [J].Virus Research,1995,38(1):83-90.
[2]Paton D,Ibata G,Sands J,et al.Detection of transmissible gastroenteritis virus by RT-PCR and differentiation from porcine respiratory coronavirus [J].Journal of Virological Methods,1997,66(2):303-309.
[3]何孔旺,钱永清.猪传染性胃肠炎病毒弱毒株STC3细胞培养特性及致病性研究 [J].中国兽医科技,2001,31(8):8-9.
He K W,Qian Y Q.Studies on cell cultivation and pathogenicity of attenuated transmissible gastroenteritis virus STC3 [J].Chinese Veterinary Science,2001,31(8):8-9.(in Chinese)
[4]Britton P,Kottier S,Chen C M,et al.The use of PCR genome mapping for the characterisation of TGEV strains [J].Advances in Experimental Medicine and Biology,1993,342:29-34.
[5]Hu W W,Yu Q H,Zhu L Q,et al.Complete genomic sequence of the coronavirus transmissible gastroenteritis virus SHXB isolated in China [J].Archives of Virology,2014,159(9):2295-2302.
[6]殷相平,任晓峰,柳纪省.猪传染性胃肠炎病毒致病机制的研究进展 [J].世界华人消化杂志,2013,21(1):39-43.
Yin X P,Ren X F,Liu J S.Progress in understanding pathogenic mechanisms of porcine transmissible gastroenteritis virus [J].World Chinese Journal of Digestology,2013,21(1):39-43.(in Chinese)
[8]Wesley R,Woods R,Cheung A.Genetic analysis of porcine respiratory coronavirus,an attenuated variant of transmissible gastroenteritis virus [J].Journal of Virology,1991,65(6):3369-3373.
[9]Hiscox J A,Cavanagh D,Britton P.Quantification of individual subgenomic mRNA species during replication of the coronavirus transmissible gastroenteritis virus [J].Virus Research,1995,36(2):119-130.
[10]Zhang X,Hasoksuz M,Spiro D,et al.Complete genomic sequences,a key residue in the spike protein and deletions in nonstructural protein 3b of US strains of the virulent and attenuated coronaviruses,transmissible gastroenteritis virus and porcine respiratory coronavirus [J].Journal of Virology,2007,358(2):424-435.
[11]Mcgoldrick A,Lowings J,Paton D.Characterisation of a recent virulent transmissible gastroenteritis virus from Britain with a deleted ORF 3a [J].Archives of Virology,1999,144:763-770.
[12]Narayanan K A,Maeda J S,Makino.The TGEV M protein may serve to initiate the viral particle assembly process through interactions with genomic RNA and nucleoprotein in pre-Golgi compartments [J].Journal of Virology,2000,74:8127-8134.
Genetic variation and eukaryotic expression ofORF3aandORF3bfrom porcine TGEV HN-2012 strain
CAO Bei-bei1,LAN Pei-ying1,2,HAN Li1,LIU Ling-ling1,WEI Xue-lei1,HU Hui1,2
(1CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou,Henan450002,China;2InternationalFederationofZoonoticDiseaseLaboratoryofHenanProvince,Zhengzhou,Henan450002,China)
Abstract:【Objective】 The genetic variation of ORF3a and ORF3b genes of porcine transmissible gastroenteritis virus (TGEV) HN-2012 was investigated.【Method】 A pair of specific primers were designed and synthesized according to TGEV ORF3a and ORF3b sequences in GenBank.RT-PCR was used to amplify ORF3a and ORF3b from HN-2012 strain.Homology analysis was conducted on gene sequences of HN-2012 and other TGEV strains from various sources in NCBI.Phylogenetic tree was also constructed to analyze genetic variation.Then ORF3a and ORF3b were cloned into eukaryotic expression vectors to construct pCAGGS-ORF3a-flag vector and pCAGGS-ORF3b-flag vector, which were transfected into 293T cells to express.Western blot analysis was conducted using flag to tag antibody.【Result】 The homology of ORF3a gene between TGEV HN-2012 strain and other strains was 92.6%-100%,and that of ORF3b was 98.6%-99.7%.Western blot indicated that molecular weights of ORF3a protein and ORF3b protein were 8 ku and 28 ku,respectively.【Conclusion】 The ORF3a gene of TGEV HN-2012 strain was close to CH/HLJH/08,CH/JLY2/08,while ORF3b gene was close to TS strain and Miller M6 strain.They had distant relationship with other strains in China.This study also achieved the expression of ORF3a and ORF3b in 293T cells.
Key words:TGEV isolates in Henan (HN-2012);ORF3a and ORF3b gene;293T cells;eukaryotic expression
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.002
[收稿日期]2014-08-14
[基金项目]国家自然科学基金项目“Ⅰ型干扰素在TGEV与树突状细胞相互作用中的免疫功能及调控机制研究”(31101796);河南省基础与前沿技术研究计划项目“猪传染性胃肠炎病毒感染对ST细胞免疫生物学特性的影响”(112300410161)
[作者简介]曹贝贝(1987-),女,河南安阳人,硕士,主要从事动物病原学研究。E-mail:cbb0416@126.com[通信作者]胡慧(1976-),女,陕西汉中人,副教授,博士,主要从事动物微生物学研究。E-mail:huhui2001@163.com
[中图分类号]S852.65+9.6
[文献标志码]A
[文章编号]1671-9387(2016)04-0010-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.004.html

