春性甘蓝型油菜FCA同源基因可变剪接体的克隆及表达研究
张生萍,罗玉秀,杜德志,罗春燕,马小岗,赵志刚,许唱唱,张红生,吴 鹏,晁文俊
(青海大学 a 生态环境工程学院,b 农林科学院,青海 西宁 810016)
春性甘蓝型油菜FCA同源基因可变剪接体的克隆及表达研究
张生萍a,罗玉秀a,杜德志b,罗春燕b,马小岗b,赵志刚b,许唱唱a,张红生a,吴鹏a,晁文俊a
(青海大学 a 生态环境工程学院,b 农林科学院,青海 西宁 810016)
[摘要]【目的】 克隆特早熟春性甘蓝型油菜的FCA同源基因(sBnFCA)及其可变剪接体,并分析该基因的表达模式。【方法】 根据拟南芥和芸薹属植物FCA基因的DNA序列和cDNA序列设计引物,用PCR和RT-PCR技术克隆特早熟春性甘蓝型油菜“86号”的FCA同源基因(sBnFCA)及其可变剪接体,对克隆基因及编码蛋白序列进行生物信息学分析,构建系统进化树,并用qRT-PCR技术检测sBnFCA基因在不同发育时期根、茎、叶、茎尖中的表达量。【结果】 克隆出了sBnFCA基因的全长序列(8 827 bp),得到了sBnFCA-γ可变剪接体及一个新的可变剪接体(sBnFCA-5),新的可变剪接体在GenBank中的登录号为KJ701579.1。sBnFCA-5剪接体的CDS全长1 986 bp,编码662个氨基酸残基,其推导的氨基酸序列具有2个保守的RRM结构域和1个WW结构域。生物信息学分析显示,sBnFCA-5与已报道甘蓝型油菜BnFCA-γ(AF414188.1)的相似性达99%,与拟南芥FCA-γ的相似性达87%。sBnFCA-5比sBnFCA-γ少了172个碱基序列,是一个跨外显子剪接体。sBnFCA蛋白相对分子质量和理论等电点分别为72.5 ku和9.2。基因表达模式分析显示,sBnFCA-γ和sBnFCA-5在苗期、蕾期、花期的根、茎、叶和茎尖组织中都有表达,sBnFCA-γ在蕾期茎尖和花期叶片中表达量较高,sBnFCA-5在蕾期茎尖和花期叶片中表达量极高。【结论】 克隆的sBnFCA-5为甘蓝型油菜sBnFCA基因的一个新的可变剪接体,该基因在春性特早熟甘蓝型油菜开花调控中可能有着重要的调节作用。
[关键词]春性甘蓝型油菜;基因克隆;FCA同源基因;可变剪接;自主开花途径
开花时间是决定油菜成熟期早晚的一个重要指标,适时开花能保证花朵在适宜的条件下授粉和种子的正常成熟,避免生育后期高温逼熟或干热等自然灾害的影响,是油菜高产和优质的重要条件[1]。影响油菜成花的环境因素很多,其中最关键的因子是温度和光照,而影响春性甘蓝型油菜成花的环境因素主要为光周期,温度影响相对较小[2]。青海大学农林科学院作物遗传实验室多年的研究结果表明,春性甘蓝型油菜品种间对光周期的敏感性差异很大[1]。青海省春油菜研究中心实验室通过春性甘蓝型油菜与青藏高原白菜型油菜种间杂交,创造出的86号品系为春性甘蓝型油菜,其对光周期不敏感,在长日照和短日照下都早花,且对春化不敏感,是一优良的种质资源[3]。为了将该资源的优良性状尽快应用到育种实践中,有必要对其成花关键基因进行研究。
外界环境因素对植物进行诱导可以使植物在适宜的环境下开花,但如果缺少这种诱导,有些植物在其营养生长达到一定阶段后也会自然开花[2],说明植物能够感知自身的发育状态,即植物内部存在控制开花的自主途径。自主开花途径是光周期途径和春化途径之外的另一种开花途径,该途径依靠体内各基因间的相互拮抗和协同作用而使植物在到达一定生长阶段后开花。目前,自主开花途径相关的6个基因FVE、FCA、FPA、FLD、LD和FY在拟南芥中都已被克隆,这些基因可能参与染色质转录后修饰,通过抑制FLC基因的表达促进开花[3-11]。尽管自主途径在拟南芥中进行了很多的研究,但其分子机理尚不清楚[9]。油料作物油菜中自主开花途径的研究还处于起步阶段。
FCA是自主开花途径调控因子。Macknight等[4]首次分离出了拟南芥FCA基因。目前,已在多种植物中分离鉴定出了FCA同源基因,且在单子叶植物[12]和双子叶植物[13]中都发现了FCA基因的可变剪接现象,推测其可能直接参与可变剪接调控。拟南芥FCA基因含有多个内含子,FCA初级转录本在第3和第13内含子中选择性剪切,得到4种转录物:α、β、γ 和δ, 其中FCA-γ编码的蛋白有747个氨基酸残基,含有2个RRM结构域和1个WW结构域,能够抑制FLCmRNA 的活性,从而促进植物开花[14];而没有活性的FCA-δ蛋白只有RRM结构域,没有WW结构域。水稻FCA基因也存在4种可变剪接OsFCA-1,OsFCA-2,OsFCA-3和OsFCA-4,其中OsFCA-1与拟南芥FCA-γ同源,也含有2个RRM结构域和1个WW结构域,OsFCA-2因缺少WW结构域而没有活性[14]。进一步的研究结果表明,FCA蛋白是通过选择性使用FCA初级转录本中的不同加尾位点来调节自身表达量的,其RRM结构域在高等植物中高度保守[15-19]。冬性甘蓝型油菜FCA-γ基因(AF414188.1)与拟南芥FCA基因(Z82992.1)和白菜型油菜FCA基因(EU700363.1)高度同源[18]。冬性甘蓝型油菜FCA-γ剪接体编码的蛋白由715个氨基酸残基组成,含有与拟南芥和白菜型油菜FCA-γ蛋白相同的结构域,但有关春性甘蓝型油菜FCA同源基因sBnFCA(springB.napusFCA)序列的研究尚未见报道。
综上所述,FCA同源基因在高等植物中具有保守性,同时也具有种属特异性[20-21]。本研究以源自甘蓝型油菜与白菜型油菜种间杂交后代新型特早熟春性甘蓝型油菜“86号”品系为材料,根据GenBank中已报道的拟南芥和芸薹属植物FCA基因序列的保守区性,采用同源克隆的方法分离sBnFCA基因,用qRT-PCR技术检测该基因在花芽分化过程中不同组织(叶和茎尖)内的表达水平,探讨其时空表达模式,为新型特早熟春性甘蓝型油菜的早熟机理研究奠定基础,为筛选、培育早熟优质油菜新品种提供理论依据和技术支撑。
1材料与方法
1.1材料
以春性甘蓝型油菜与青藏高原白菜型油菜种间杂交创造出的“86号”品系为材料,“86号”为春性甘蓝型油菜,表现特早熟,且对光周期和春化不敏感,由青海大学农林科学院春油菜研究中心提供。大肠杆菌菌株DH5α、克隆载体pMD18-T、各种内切酶、T4连接酶、各试剂盒,均由TaKaRa(大连)公司提供。所用引物自行设计并由上海生工合成。
选取籽粒饱满的油菜种子种植于人工气候箱中,温度设置为22/18 ℃(昼/夜),16 h光照/8 h黑暗,光照强度350 μmol/(m2·s),相对湿度60%。于苗期(2叶1心)、蕾期(现蕾初期)和花期(第1朵花开放)取根、茎、叶、茎尖,液氮速冻后保存于-80 ℃冰箱备用。
1.2方法
1.2.1总RNA的提取和反转录根据RNAiso Reagent试剂盒说明提取供试材料苗期叶片的总RNA,1.2%琼脂糖电泳检测后按照First-Strand cDNA Synthesis Kit试剂盒说明合成cDNA第一链,置-20 ℃冰箱备用。反转录条件为:将1 μL总RNA,2 μL Oligo(dT)18和24 μL RNA free ddH2O混匀,65 ℃水浴5 min,冰浴30 s,12 000 r/min瞬时离心,然后依次加入8 μL 5×R Buffer,2 μL RNA inhibitor,4 μL dNTPs和2 μL M-MVLV,瞬时离心后在PCR仪上42 ℃孵育60 min,70 ℃灭火10 min。将合成的cDNA置-20 ℃冰箱备用。
1.2.2sBnFCA基因克隆(1)基因DNA序列克隆。根据 GenBank数据库中已报道的拟南芥FCA基因(GenBank登录号为Z82992.1)、冬性甘蓝型油菜FCA同源基因(GenBank 登录号为AF414188.1)和白菜型油菜FCA同源基因(EU700363.1)核苷酸序列的保守序列设计引物(表1),以“86号”材料基因组DNA为模板扩增sBnFCA基因的DNA序列。
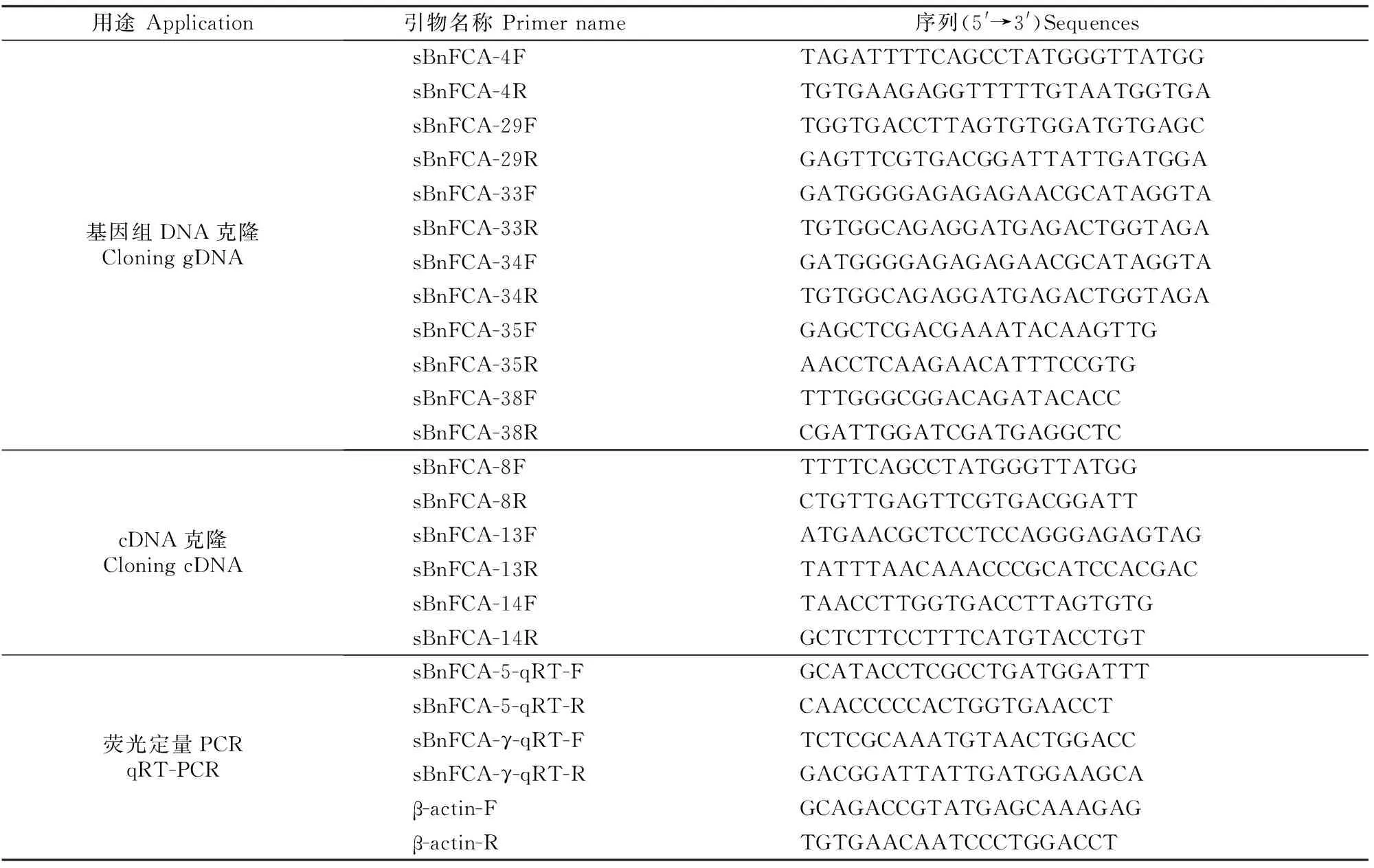
表 1 本研究所用引物序列
PCR反应体系为:DNA模板2 μL,10×Buffer 1.4 μL,2.5 mmol/L dNTPs 1 μL,10 pmol/L上下游引物各0.3 μL,rTaq0.2 μL,补充ddH2O至10 μL。 PCR反应程序为:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃延伸7 min。1.0%琼脂糖凝胶电泳检测扩增产物,用琼脂糖凝胶回收试剂盒回收PCR产物,与载体 pMD18-T连接、转化大肠杆菌感受态细胞并过夜培养,蓝白斑筛选后挑取白斑进行菌液培养,将鉴定正确的阳性克隆菌液送上海生工测序,命名为sBnFCA。
(2)基因可变剪接体的克隆。根据 GenBank数据库中已报道的拟南芥FCA基因(GenBank登录号为Z82992.1)、冬性甘蓝型油菜FCA同源基因(GenBank 登录号为AF414188.1)和白菜型油菜FCA同源基因(EU700363.1)编码区序列的保守区设计引物(表1),以“86号”油菜蕾期叶片RNA反转录合成的cDNA第一链为模板进行RT-PCR扩增,获得的片段测序后与GenBank中已公布的芸薹属植物的FCA同源基因的EST进行拼接。用RACE试剂盒进行3′和5′RACE扩增,获得cDNA全长序列。反应体系为10 μL,包括cDNA模板2 μL,10×Buffer 1.4 μL,2.5 mmol/L dNTPs 1 μL,10 pmol/L的上下游引物各0.3 μL,rTaq0.2 μL,ddH2O 4.8 μL。反应程序为:94 ℃预变性3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃延伸 7 min。PCR产物的回收、连接、转化、鉴定、测序等步骤同上。
1.2.3sBnFCA基因及编码蛋白特征分析将获得的sBnFCA基因在NCBI网站上进行 Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html) 寻找开放阅读框;利用DNAStar软件进行多重序列比较和氨基酸同源性分析,产生的多重比对结果通过 MEGA v5.05软件构建系统发育树。利用在线工具 TMHMM (http://genome.cbs.dtu.dk/services/TMHMM/)和 SignalP4.0(http://www.cbs.dtu.dk/services/SignalP/) 分析sBnFCA蛋白跨膜结构域、预测信号肽;利用 ExPASy 工具中的 SOPMA 软件预测蛋白质二级结构,用SWISS-MODEL(http://swissmodel.expasy.org/)对三级结构进行预测[22]。利 用MEGA v.5.05进行系统发育树构建(1 000次重复) 。
1.3sBnFCA基因表达模式分析
分别提取苗期(2叶1心)、蕾期(现蕾初期)和花期(第1朵花开放)根、茎、叶和茎尖总RNA,并用RNase-free DNaseⅠ(Promega,USA) 消化处理,经 1.5%琼脂糖凝胶电泳检测 RNA 完整性。用分光光度计检测 RNA 纯度。按First-Strand cDNA Synthesis Kit(TaKaRa)试剂盒说明合成cDNA第一链,以反转录的cDNA链为模板,根据分离出的sBnFCA基因cDNA保守序列设计特异引物,以sBnFCA-γ基因和β-actin基因(GenBank登录号AF11812)为内参,用qRT-PCR技术检测sBnFCA在花芽分化过程中不同组织(根、茎、叶和茎尖)内的表达水平。具体步骤按TaKaRa一步法荧光定量试剂盒说明进行,PCR 仪为ABI7900,并采用2-ΔΔCt法计算相对表达量。用于基因表达研究的引物见表1,其中sBnFCA-γ的上游引物在第14外显子内设计,下游引物在第17外显子内设计;而sBnFCA-5的上游引物在第14外显子设计,下游引物跨第15和17外显子设计。PCR反应体系10 μL,包括cDNA模板2 μL,10×Buffer 1.4 μL,2.5 mmol/L dNTPs 1 μL,10 pmol/L的上下游引物各0.3 μL,rTaq0.2 μL,ddH2O 4.8 μL。PCR反应条件为:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
2结果与分析
2.1sBnFCA基因分离及序列分析
以“86号”春性甘蓝型油菜基因组DNA为模板,用设计的基因组DNA扩增引物分离出了春性甘蓝型油菜FCA同源基因的DNA全长 8 827 bp的序列(图1)。克隆测序结果显示,该序列与冬性甘蓝型油菜BnFCA基因DNA序列(AF414188.1)的相似性达95%,与白菜型油菜BrpFCA基因DNA序列(EU700363.1)的相似性达99%,与拟南芥FCA基因DNA序列(Z82992.1)的相似性达78%。证明扩增出的是春性甘蓝型油菜FCA同源基因的DNA序列,命名为sBnFCA。
以“86号”春性甘蓝型油菜蕾期叶片cDNA为模板,用sBnFCA基因cDNA克隆引物进行RT-PCR,扩增产物经克隆测序后与FCA同源基因的EST序列拼接, 获得了sBnFCA基因的2个可变剪接体,一个是sBnFCA-γ剪接体;而另一个可变剪接体尚未见报道,暂命名为sBnFCA-5,在GenBank中的登录号为KJ701579.1。这2个剪接体与GenBank中已报道的冬性甘蓝型油菜BnFCA-γ(AF414188.1)和白菜型油菜BrpFCA-γ(EU700363.1)的相似性达99%,与拟南芥FCA-γ的相似性达87%。
将sBnFCA基因DNA序列与sBnFCA-γ和sBnFCA-5序列进行比对发现,sBnFCA-γ有21个外显子,20个内含子,sBnFCA-γ编码全长基因产物。与sBnFCA-γ相比,sBnFCA-5在第15和17外显子间发生了跨外显子可变剪接体,保留了第15和17外显子的部分序列,第16外显子被全部切除(图2),导致sBnFCA-5比sBnFCA-γ少了172个碱基序列;sBnFCA-5 CDS全长1 986 bp,编码662个氨基酸。

图 1 sBnFCA DNA部分片段的扩增结果

图 2sBnFCA基因的可变剪接体结构
Fig.2Alternative splicing isoforms ofsBnFCA
2.2sBnFCA-5蛋白的氨基酸序列分析
经ORF Finder预测,sBnFCA-5的CDS区长1 986 bp,编码662个氨基酸,分子质量为72.5 ku,等电点为9.2,命名为sBnFCA-5,GenBank登录号为AIE12126.1。通过SignalP4.0预测结构表明,sBnFCA-5为非分泌蛋白。TMHMM跨膜预测结果表明,sBnFCA-5为非膜蛋白。分析sBnFCA-5蛋白二级结构发现,sBnFCA-5蛋白N端有2个保守的RRM结构域,第1个在103-179位氨基酸残基之间,第2个在194-269位氨基酸残基之间;C端有一个WW结构域,位于568-600位氨基酸残基之间;这3个结构域与FCA-γ高度同源。用SWISS-MODEL网上在线预测了sBnFCA-5的三级结构,结果(图3)显示该蛋白有多个α螺旋和β折叠。

图 3 sBnFCA-5蛋白的三级结构
氨基酸相似性比较发现,sBnFCA-5蛋白(AIE12126.1)的氨基酸序列与NCBI中已公布的甘蓝型油菜C01染色体基因编码的RRM2-FCA(CDY34447.1)相似性达99%,与FCA-γ基因编码的蛋白(AAL61622.1)相似性达99%,与白菜型油菜FCA蛋白(XP_009146104.1)相似性达98%,与甘蓝型油菜A01染色体基因编码的RRM2-FCA(CDY32233.1)氨基酸序列相似性达97%,与拟南芥FCA蛋白(CAB05388.1)相似性达77%(图4)。证明sBnFCA-5基因编码的蛋白是FCA同源蛋白。

1.春性甘蓝型油菜BrassicanapusL.AIE12126.1;2.冬性甘蓝型油菜BrassicanapusL.CDY34447.1;3.冬性甘蓝型油菜BrassicanapusL.AAL61622.1;4.白菜型油菜BrassicarapaL.XP_009146104.1;5.冬性甘蓝型油菜BrassicanapusL.CDY32233.1;6.拟南芥ArabidopsisthalianaL.CAB05388.1
图 4sBnFCA-5氨基酸序列与其他物种FCA序列的多重比较
Fig.4Multiple alignment results of sBnFCA-5 and FCA from other species
进一步分析特早熟春性甘蓝型油菜与其他植物预测的sBnFCA蛋白的亲缘关系,将不同植物的FCA蛋白氨基酸预测序列进行系统发生分析。结果表明,“86号”春性甘蓝型油菜的 sBnFCA蛋白与芸薹属属于同一亚族,与甘蓝型油菜和白菜型油菜的亲缘关系近(图5)。

图 5 sBnFCA氨基酸序列系统进化树分析
2.3sBnFCA基因表达模式
以苗期(2叶1心)叶片反转录产物为模板,用sBnFCA基因特定部位设计的引物对sBnFCA-5和sBnFCA-γ进行特异性扩增,获得了预期长度的片段,RT-PCR扩增结果如图6所示,证明设计的引物序列正确,可用作可变剪接基因表达检测。以β-actin(GenBank登录号AF11812)为内参,用qRT-PCR技术检测sBnFCA-5和sBnFCA-γ在苗期、蕾期和开花期不同组织的表达水平,结果如图7。由图7可见,sBnFCA-5在苗期、蕾期和花期的根、茎、叶及茎尖组织中都有表达,表达量因发育时期和组织类型不同而存在较大的差异;在苗期和蕾期的茎中表达量最高,花期叶片中的表达量最高;根、茎和茎尖中的表达量随发育进程呈现出先升高后降低的趋势,叶片中的表达量呈上升趋势。sBnFCA-γ在苗期、蕾期及花期的根、茎、叶和茎尖组织中都有表达,表达量因发育时期和组织类型不同而存在差异,但差异较小;sBnFCA-γ在各组织中的表达量均低于sBnFCA-5,但在茎、叶和茎尖中二者有着相同的表达趋势。

图 6 sBnFCA可变剪接体的RT-PCR电泳
3讨论
FCA是从拟南芥中首先分离出的自主开花途径的重要基因[6],目前,在水稻、玉米、白菜型油菜、冬性甘蓝型油菜、芥蓝、蓖麻和甜瓜等多种植物中均已分离出其同源基因,序列分析结果表明,FCA基因序列物种间高度保守[20]。RT-PCR研究结果发现,FCA基因在单子叶植物[21]和双子叶植物[16]中都存在多个可变剪接体 ,且剪接方式复杂。mRNA的可变剪接可以使一个特定的基因对应于不同的组织、发育阶段和外界生存条件,通过剪接方式的调控变化提高基因表达产物的多样性和功能的可塑性[23]。如拟南芥中FCA基因通过选择性剪接产生4个可变剪接体(α、β、γ和δ),冬性甘蓝型油菜BnFCA基因也存在与拟南芥相对应的4个剪接体[20]。水稻中除了与拟南芥FCA基因的α、β、γ和δ相对应的4个剪接体(OsFCA-1、OsFCA-2、OsFCA-3和OsFCA-4)外,还发现了OsFCA基因的一个新的ε剪接体[21]。ε剪接体在水稻的各组织中均有表达,但对其功能研究尚未见报道。为了探明春性甘蓝型油菜sBnFCA基因及其可变剪接体的类型,本研究采用RT-PCR与同源克隆技术相结合的方法,以新型特早熟甘蓝型油菜“86号”为研究材料,分离出了春性甘蓝型油菜的sBnFCA基因及其可变剪接体,结果得到sBnFCA-γ和1个新的可变剪接体sBnFCA-5。植物断裂基因常采用保留内含子的可变剪接方式使翻译提前终止。如水稻的OsFCA-ε剪接体保留了该基因的第16内含子的22个碱基,FCA-α中保留了该基因的内含子3,二者均可产生非功能蛋白。说明可变剪接对转录后调控起重要作用[21]。与sBnFCA-γ相比,sBnFCA-5剪接体切除了sBnFCA的第15和17外显子的一部分和16外显子的全部序列,共172个碱基,为一个跨外显子剪接。

图 7 sBnFCA基因表达模式分析
氨基酸序列分析结果表明,克隆的sBnFCA-5 cDNA具有完整的编码框,所编码的蛋白与GenBank中公布的拟南芥和芸薹属植物FCA-γ具有极高的同源性,证明了所克隆基因的准确性。开花机理的研究结果表明,自主开花基因编码调节蛋白[24]。如LD编码的蛋白含有两个核定位信号序列和一个富含谷氨酰胺同源异性结构域,是一个转录因子。FPA蛋白N端含有3个RRM结构域,是RNA结合蛋白[13]。FVE蛋白含有WD重复结构域,与染色质装配和重塑有关[12]。拟南芥FLD基因编码一个与人的组蛋白赖氨酸去甲基化酶1(LSD1)同源的蛋白,参与组蛋白的去甲基化和去乙酰化,通过抑制FLC基因促进开花。已克隆的sBnFLD基因编码含有一个SWIRM结构域和一个NAD(P)-binding-8结构域(待发表)的蛋白。含有SWIRM结构域的蛋白参加蛋白互作,很多与染色体相互作用的蛋白都含有SWIRM结构域,是LSD1家族的成员。NAD(P)-binding Rossmann-like domain结构域有一个α-β-α螺旋结构,隶属于Rossmann折叠大家族的成员,作用原理是以辅酶DND(P)作为辅助因子,催化氨基酸脱氢形成酮酸。拟南芥FCA功能蛋白FCA-γ编码的蛋白由747个氨基酸残基组成,含有两个RRM型RNA结合的结构域和一个WW蛋白相互作用结构域,是RNA结合蛋白,能够抑制FLCmRNA 的活性,从而促进植物开花;而没有活性的FCA-δ蛋白只有RRM结构域,没有WW结构域[25]。而sBnFCA-5 蛋白N端有2个RRM结构域,C端保留WW结构域,可能是一转录调控因子,其功能有待进一步研究。
自主开花途径基因(LD、FCA、FVE、FPA、FCA和FY)的表达不依赖环境条件,彼此之间互不影响基因mRNA水平的表达,在植物的各个器官中平行表达[24]。LD转录产物分布在整个植物体内,但在根尖和茎尖生长点含量最为丰富。FPA独立于FCA调节FLC,在正在发育的组织中表达极强[24]。GmFLD基因转录产物在大豆所有组织中都能检测到,但该基因在真叶和茎尖中的表达量非常低[10]。春性特早熟甘蓝型油菜sBnFLD基因在油菜各器官中均有表达,但在蕾期茎尖中的表达量最高(待发表)。FLD基因表达研究报道在大豆、春油菜和拟南芥中一致。FCA基因编码植物特有的RNA识别基序(RRM)的结合蛋白,能抑制FLCmRNA的积累,从而促进开花[25]。FCA-γ基因在拟南芥几乎所有组织中表达,但在茎尖中的表达水平最高[25]。BnFCA-γ在冬性甘蓝型油菜整个发育过程中稳定表达[20]。本研究结果表明,sBnFCA-γ和sBnFCA-5在特早熟春性甘蓝型油菜的茎、叶和茎尖中都有表达,在苗期、蕾期及花期茎、叶和茎尖中的表达趋势相同,说明sBnFCA-γ和sBnFCA-5间可能存在协同作用。sBnFCA-5在蕾期茎尖和花期叶片中的表达量极高,推测对春性甘蓝型油菜开花调控起着关键作用。
4结论
开花是高等植物中的一个重要的生理过程,从“86号”油菜中分离出的sBnFCA-5基因是春性甘蓝型油菜的一个新的可变剪接体,sBnFCA-5基因cDNA全长1 986 bp,编码由662个氨基酸残基组成的蛋白,含有2个RRM结构域和1个WW结构域,该基因在春性甘蓝型油菜苗期、蕾期和花期各器官均有表达,但在蕾期茎尖和花期叶片中表达量极高,推测其对开花调控起着十分重要的调控作用。
[参考文献]
[1]Luo Y X,Luo C Y,Du D Z,et al.Quantitative trait analysis of flowering time in spring rapeseed (B.napusL.) [J].Euphytica,2014,200(3):321-335.
[2]Xu L,Jia F F,Wang L L.Progresses on molecular mechanisms of flowering transition inArabidopsis[J].Acta Bot Boreal,2011,31(5):1057-1065.
[3]Hayama R,Coupland G.Shedding light on the circadian clock and the photoperiodic control of flowering [J].Curr Opin Plant Biol,2003,6(1):13-19.
[4]Macknight R,Bancroft I,Page T,et al.FCA,a gene controlling flowering time inArabidopsis,encodes a protein containing RNA-binding domains [J].Cell,1997,89:737-745.
[5]Schomburg F M,Patton D A,Meinke D W.FPA,a gene involved in floral induction inArabidopsisencodes a protein containing RNA-Recognition Motifs [J].Plant Cell,2001,13(6):1427-1436.
[6]Macknight R,Duroux M,Laurie R,et al.Functional significance of the alternative transcript processing of theArabidopsisfloral promoter FCA [J].The Plant Cell,2002,14:877-888.
[7]Che N R,Zhang S,Sun S.Characterization of a new mutant allele of theArabidopsisFlowering Locus D (FLD) gene that controls the flowering time by repressing FLC [J].Chin Sci Bull,2005,50(23):2701-2706.
[8]Hu Q,Jin Y,Shi H Z,et al.GmFLD,a soybean homolog of the autonomous pathway gene FLOWERING LOCUS D,promotes flowering inArabidopsisthaliana[J].BMC Plant Biology,2014,14:263.
[9]Chalhoub B,Denoeud F,Liu S Y,et al.Early allopolyploid evolution in the post-NeolithicBrassicanapusoilseed genome [J].Science,2014,345:950-953.
[10]Sun X M,Qin Q P,Zhang J,et al.Isolation and characterization of the FVE gene of aDoritaenopsishybrid involved in the regulation of flowering [J].Plant Growth Regu,2012,68:77-86.
[11]Izawa T,Oikawa T,Sugiyama N,et al.Phytochrome mediates the external light signal to repress FT orthologues in photoperiodic flowering of rice [J].Genes Dev,2002,16:2006-2020.
[12]Lu Q,Xu Z K,Song R T.OsFY,a homolog of AtFY,encodes a protein that can interact with OsFCA-γ in rice (OryzasativaL.) [J].Acta Biochimica et Biophysica Sinica,2006,38(7):492-499.
[13]Sonmez C,Bäurle I,Magusin A,et al.RNA 3′ processing fun-ctions ofArabidopsisFCA and FPA limit intergenic transcription [J].Proc Natl Acad Sci USA,2011,108:8508-8513.
[14]Simpson G G,Dijkwel P P,Quesada V,et al.FY is an RNA 3′ end-processing factor that interacts with FCA to control theArabidopsisfloral transition [J].Cell,2003,113:777-787.
[15]Simpson G G,Laurie R E,Dijkwel P P,et al.Noncanonical translation initiation of theArabidopsisflowering time and alternative polyadenylation regulator FCA [J].Plant Cell Nov,2010,22(11):3764-3777.
[16]Cavell A C,Lydiate D J,Parkin I A P,et al.Collinearity between a 30-centimorgan segment ofArabidopsisthalianachromosome 4 and duplicated regions within theBrassicanapusgenome [J].Genome,1998,41:62-69.
[17]Winichayakul S,Beswick N L,Dean C,et al.Component of theArabidopsisautonomous floral promotion pathway,FCA and FY,are conserved in monocots [J].Funct Plant Biol,2005,32:345-355.
[18]Darracq A,Adams K L.Features of evolutionarily conserved alternative splicing events betweenBrassicaandArabidopsis[J].New Phytologist,2013,199:252-263.
[19]Jang Y H,Lee H H,Park H Y,et al.OsFCA transcripts show more complex alternative processing patterns than itsArabidopsiscounterparts [J].J Plant Biol,2009,52:161-166.
[20]Yang J,Yan R,Roy A,et al.The I-TASSER suite:Protein str-ucture and function prediction [J].Nature Methods,2015,12:7-8.
[21]Birzele F,Csaba G,Zimmer R.Alternative splicing and protein structure evolution [J].Nucleic Acids Res,2008,36:550-558.
[22]Lee J H,Cho Y S,Yoon H S,et al.Conservation and divergence of FCA function betweenArabidopsisand rice [J].Plant Mol Biol,2005,58:823-838.
[23]Quesada V,Macknight R,Dean C,et al.Autoregulation of FCA pre-mRNA processing controlsArabidopsisflowering time [J].EMBO J,2003,22:3142-3152.
[24]Baürle,I,Smith L,Baulcombe D C,et al.Widespread role for the flowering time regulators FCA and FPA in RNA-mediated chromatin silencing [J].Science,2007,318:109-112.
[25]Jung J H,Seo P J,Ahn J H,et al.ArabidopsisRNA-binding protein FCA regulates microRNA172 processing in thermosensory flowering [J].J Biol Chem,2012,287(19):16007-16016.
A novel alternative splicing isoform ofFCAhomologue in spring rapeseed
ZHANG Sheng-pinga,LUO Yu-xiua,DU De-zhib,LUO Chun-yanb,MA Xiao-gangb,ZHAO Zhi-gangb,XU Chang-changa,ZHANG Hong-shenga,WU Penga,CHAO Wen-juna
(aCollegeofEco-EnvironmentalEngineering,bQinghaiAcademyofAgricultureandForestry,QinghaiUniversity,Xining,Qinghai810016,China)
Abstract:【Objective】 The research cloned the sBnFCA gene and its alternative splicing isoform,and analyze their expressions.【Method】 The primers were designed according to the published FCA DNA and cDNA sequences of Arabidopsis and Brassica.The genome DNA and complete open reading frame of FCA homologue gene were cloned from an early-flowering rapeseed “No.86” strain using the method of homologues cloning and reverse transcription PCR (RT-PCR) bioinformatics analysis was conducted for cloned gene and proteins before the phylogenetic tree was constructed and the expression levels at different stages were detected using qRT-PCR.【Result】 The DNA sequence of FCA from spring B.napus L.(sBnFCA) was 8 827 bp and the cDNA sequence of novel alternative splicing isoform (sBnFCA-5) was 1 986 bp,encoding a protein of 662 amino acid residues with a predicted molecular weight of 72.5 ku and a theoretical pI of 9.2.Bioinformatics analysis showed that the predicted sBnFCA-5 protein contained two RRM domains and a WW domain.It was showed that sBnFCA-5 had 99% similarity with BnFCA-γ(AF414188.1) and had 87% similarity with A.thaliana FCA-γ.The expression analysis of sBnFCA-5 using qRT-PCR showed that the sBnFCA gene was expressed in roots,stem,leaves,shoot tips and buds at seeding,bud and flowering stages.The relative expression level of sBnFCA-5 was highest in shoot tips at bud stage and in leaves at flowering stage,respectively.【Conclusion】 The cloned sBnFCA-5 was a new alternative splicing isoform of sBnFCA gene and it might play an important role in flowering regulation of spring rape.
Key words:spring rape (Brassica napus L.);gene cloning;FCA homologue;alternative splicing;autonomous flowering pathway
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.009
[收稿日期]2015-07-10
[基金项目]国家自然科学基金项目(31360345);青海省科技厅项目(2013-Z-716);国家863项目(2011AA10A104);高层次人才项目(2012-QGC-3);科技部项目(2013BAD01B05-3)
[作者简介]张生萍(1991-),女,青海湟中人,硕士,主要从事油菜遗传育种研究。E-mail:582522253@qq.com[通信作者]罗玉秀(1969-),女,青海民和人,教授,博士,主要从事油菜遗传育种研究。E-mail:lyxiu2@163.com
[中图分类号]S634.3;Q78
[文献标志码]A
[文章编号]1671-9387(2016)04-0064-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.018.html

