藏北高寒草原耐碱放线菌的多样性及其生物活性
尹明远,何建清,张格杰
(西藏大学农牧学院,西藏 林芝 860000)
藏北高寒草原耐碱放线菌的多样性及其生物活性
尹明远,何建清,张格杰
(西藏大学农牧学院,西藏 林芝 860000)
[摘要]【目的】 研究藏北高寒草原耐碱放线菌的多样性、产酶潜力及拮抗活性,为开发利用相关资源提供参考。【方法】 从藏北高寒草原盐碱地采集22份土样,用平板稀释法从中分离放线菌,进行初步的形态鉴定后得到有代表性的36株耐碱放线菌,对这些代表性菌株的16S rRNA基因序列进行系统发育分析,将这些菌株鉴定到属;采用生长速率法测定分离菌株发酵液对1种细菌和4种农作物真菌的抑菌活性,并对分离株菌进行纤维素酶、蛋白酶、淀粉酶酶活初筛,分析其拮抗活性。【结果】 从22份土样中分离到有代表性的36株耐碱放线菌;16S rRNA基因序列分析表明,这36株菌分布于放线菌门放线菌纲5个亚目5个科的5个属,即链霉菌属(Streptomyces)、糖丝菌属(Saccharothrix)、小单孢菌属(Micromonospora)、原小单孢菌属(Promicromonospora)和韩国生工菌属(Kribbella);分离菌株中25.0%具有纤维素酶活性,8.3%具有淀粉酶活性,16.6%具有蛋白酶活性。所得耐碱放线菌中33.3%的菌株有抑菌活性,其中有5株具有高拮抗活性(抑菌圈直径≥20 mm),分别是J10、J14、J21、J48和J65。【结论】 藏北高寒草原盐碱地生境蕴藏着丰富的耐碱放线菌资源,这些耐碱放线菌具有高酶和拮抗菌活性。
[关键词]耐碱放线菌;16S rRNA;生物活性;藏北高寒草原
能在pH 9以上的环境生长,且在pH 10~12的环境生长良好,但在pH 6.5左右的环境不能或仅能缓慢生长的放线菌,人们称之为嗜碱放线菌[1-2]。嗜碱放线菌又可以分为专性嗜碱、兼性嗜碱和耐碱放线菌,耐碱放线菌主要分布在一些天然的高碱环境,如盐碱湖、盐碱地以及人为的碱性环境[3]。耐碱放线菌可以产生多种碱性酶和生物活性物质,如抗生素[4-5]和酶的抑制剂[6]。耐碱放线菌是极端环境中的一个特殊类群,由于其产物的特殊性和广阔的应用前景,引起了国际上许多微生物学者的广泛关注。藏北高寒草原地处青藏高原腹地,藏北高原大陆性气候特征极为明显,年平均气温0~3 ℃,全年无绝对无霜期,年降水量100~300 mm,年蒸发量2 000 mm。在高寒和干旱的共同作用下,高寒草原成土过程微弱,土层浅薄,土壤结构性差且有机质和有效养分含量低[7]。近几十年来,藏北高寒草原因人为和自然因素导致大面积退化,以草地盐碱化、草地沙化为主的各种草地退化不断加速[8]。随着草地的盐碱化,草地土壤的性质已经改变。这些因素决定了藏北高寒草原土壤形成发育有其独特之处,在这种特殊的生境中蕴藏着极为丰富的放线菌资源,基于此,本试验以藏北耐碱放线菌为研究对象,探索藏北高寒草原耐碱放线菌资源种类、分布、拮抗活性及其酶的应用潜力,为开发利用我国耐碱放线菌资源提供参考。
1材料与方法
1.1材料
1.1.1样品采集根据土质以及植被覆盖的差别,从藏北高寒草原采集22份盐碱土样,置于4 ℃冰箱保存,土样详细情况见表1。
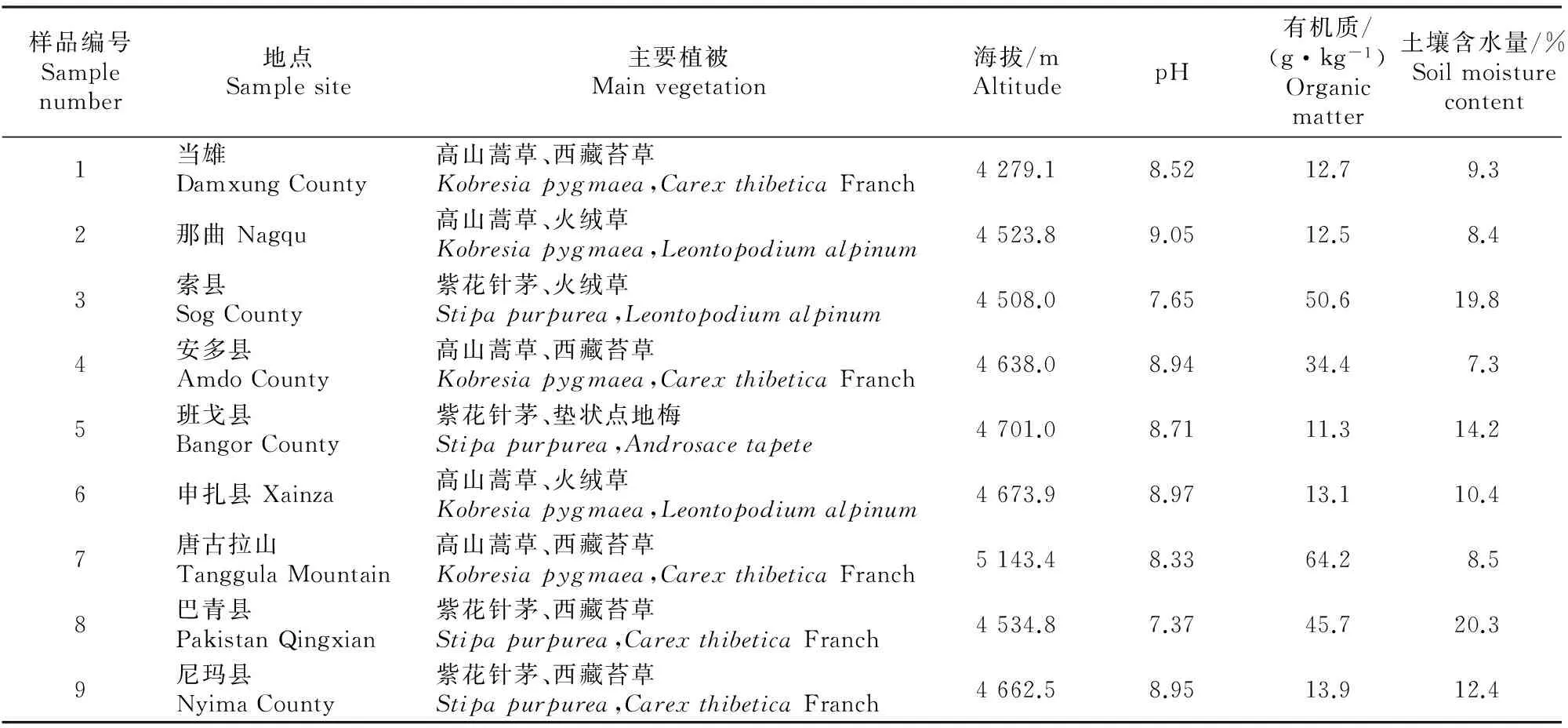
表 1 藏北高寒草原土样基本情况
1.1.2分离培养基分离培养基为改良纤维素酪素琼脂(CCMS)、甘油天门冬酰胺琼脂(ISP5)和淀粉酪素琼脂3种基础培养基[3]。以上培养基于121 ℃灭菌30 min后,用10 mol/L NaOH将pH调至9~10.0,为抑制细菌和真菌生长,在分离培养基中均加入终质量浓度为70 mg/L的重铬酸钾。
1.1.3主要试剂和仪器脱脂奶粉、酵母提取物、蛋白胨、淀粉、微晶纤维素等试剂均为国产分析纯,DNA Polymerase、dNTPs、DNA Marker DL-2000、pMD18-T vector 购自TaKaRa公司,胶回收试剂盒购自QIAGEN公司;PCR仪为东胜公司产品。
1.1.4病原菌菌株所用菌株金黄色葡萄球菌(Staphylococcusaureus)、番茄灰霉菌(Botrytiscinerea)、南瓜枯萎菌(Fusariumoxysporum)、粉红聚端孢(Trichotheciumroseum)、小麦根腐菌(Bipolarissorokiniana),均由西藏大学农牧学院真菌实验室保存并提供。
1.2样品预处理与菌株分离
用无菌袋装采集的土样,28 ℃自然风干约7 d后称取10 g,转移至装有90 mL无菌水的三角瓶里,置于28 ℃恒温振荡箱里120 r/min充分振荡,获得样品悬浮液,将样品悬浮液放入装有自来水的烧杯中,120 W、2 450 Hz微波处理40 s,用移液枪取1 mL至装有9 mL无菌水的试管中,稀释至10-3,取0.2 mL涂布于装有CCMS、ISP5和淀粉酪素琼脂培养基的分离平板上,28 ℃恒温培养箱中倒置培养14 d。收集菌落,根据菌落形态、大小、颜色进行初步分离筛选,比较3种培养基的分离效果,利用分离效果最好的培养基纯化并保藏菌株。
1.3菌株生长条件
以H1为基础培养基,参照Li等[9]的方法,利用pH6.0~12.0缓冲液体系,检测分离菌株的pH生长范围及最适pH。所用的pH缓冲体系如下:pH6.0~8.0,0.1 mol/L KH2PO4+0.1 mol/L NaOH;pH 9.0~10.0,0.1 mol/L NaHCO3+0.1 mol/L Na2CO3;pH11.0,0.05 mol/L Na2HPO4+0.1 mol/L NaOH;pH12.0,0.2 mol/L KCl+0.2 mol/L NaOH,缓冲液的制备参照文献[10]的方法。在培养基灭菌结束后,将培养基与无菌缓冲液混合,然后分装到无菌玻璃试管中。接种试验菌株,然后于28 ℃培养2周,观察菌株的生长情况。
1.4耐碱放线菌16S rRNA鉴定
按照参考文献[11]的方法提取菌株总DNA,利用细菌通用引物(PA(对应E.coli的7-24)5′-CAGAGTTTGATCCTGGCT-3′),PB(对应E.coli的1 540-1 522)5′-AGGAGGTGATCCAGCCGCA-3′)对16S rRNA序列进行PCR扩增,得到的PCR产物直接送到杭州擎科梓熙生物技术有限公司测序,序列用ClustalX[12]软件进行比对,然后用MEGA4[13]软件Neighbour-Joining法[14]进行系统进化树构建,用于检验支持率的重复抽样次数为 1 000 次。
1.5测定指标及方法
1.5.1酶活淀粉酶水解、纤维素分解、蛋白酶活性测定均参照文献[15]的方法进行。
1.5.2拮抗活性采用生长速率法测定供试放线菌发酵液的抑菌作用,选用的细菌为金黄色葡萄球菌(Staphyloccocusaureus),植物病原真菌为番茄灰霉菌(Botrytiscinerea)、南瓜枯萎菌(Fusariumoxysporum)、粉红聚端孢(Trichotheciumroseum)和小麦根腐菌(Bipolarissorokiniana)。用十字交叉法测量抑菌圈直径(D),按照30 mm>D≥20 mm、20 mm>D≥10 mm及10 mm>D定义菌株拮抗性强弱。
2结果与分析
2.1耐碱放线菌菌株的鉴定
本试验从22份土样中共分离得到89株放线菌,根据形态特征和培养特征去重复后获得36株耐碱放线菌。对这36株代表性耐碱放线菌进行16S rRNA基因序列测定,序列保存在GenBank相应数据库中。用Blast搜索软件从GenBank等数据库进行相似度搜索,调出相似度最高的相关性菌株的16S rRNA基因序列,用ClustalX比对后用 MEGA4构建系统进化树 (图1),确定了36株耐碱放线菌的系统发育地位。由图1可知,藏北高寒草原盐碱地生境的耐碱放线菌组成较简单,供试的36株耐碱放线菌分布于放线菌门放线菌纲下5个亚目5个科5个属,即链霉菌属(Streptomyces)、糖丝菌属(Saccharothrix)、小单孢菌属(Micromonospora)、原小单孢菌属(Promicromonospora)和韩国生工菌属(Kribbella)。其中链霉菌属为藏北草原优势放线菌,占分离菌的83.2%;小单孢菌属、糖丝菌属,分别占分离菌的5.5%,8.3%;原小单孢菌属和韩国生工菌属仅占分离菌的2.7%。
36株耐碱放线菌与其参比菌株的相似度见表 2。由表2可知,供试36株耐碱放线菌16S rRNA基因序列与参比菌株的相似度在98.0%~99.0%,以16S rRNA基因序列相似度≥98.0%作为同一个物种的标准[3,16],根据图1可以判断,这36株放线菌中仅菌株J46与StreptomycesalbovinaceusHBUM 175136 (FJ532408.1)相似度为98.0%;其他菌株与其相似菌株的相似度均为99%;可以初步判定这36株菌在系统发育地位上属于已知放线菌属。Kasai等[17]研究发现,小单孢菌属(Micromonospora)种之间16S rRNA基因序列相似度高达99.3%,而同样2个种的DNA-DNA同源性依然小于70%,这表明小单孢菌属(Micromonospora)种间16S rRNA基因序列相似度不高于99.3%的可能为新种,本试验共分离到2株小单孢菌属(Micromonospora)菌株,分别是J53、J93(表2),且这2株菌株与该属数据库中最相近的代表种的16S rRNA序列相似度均小于99.3%,表明这2株放线菌可能是小单孢菌属(Micromonospora)的潜在的新种。

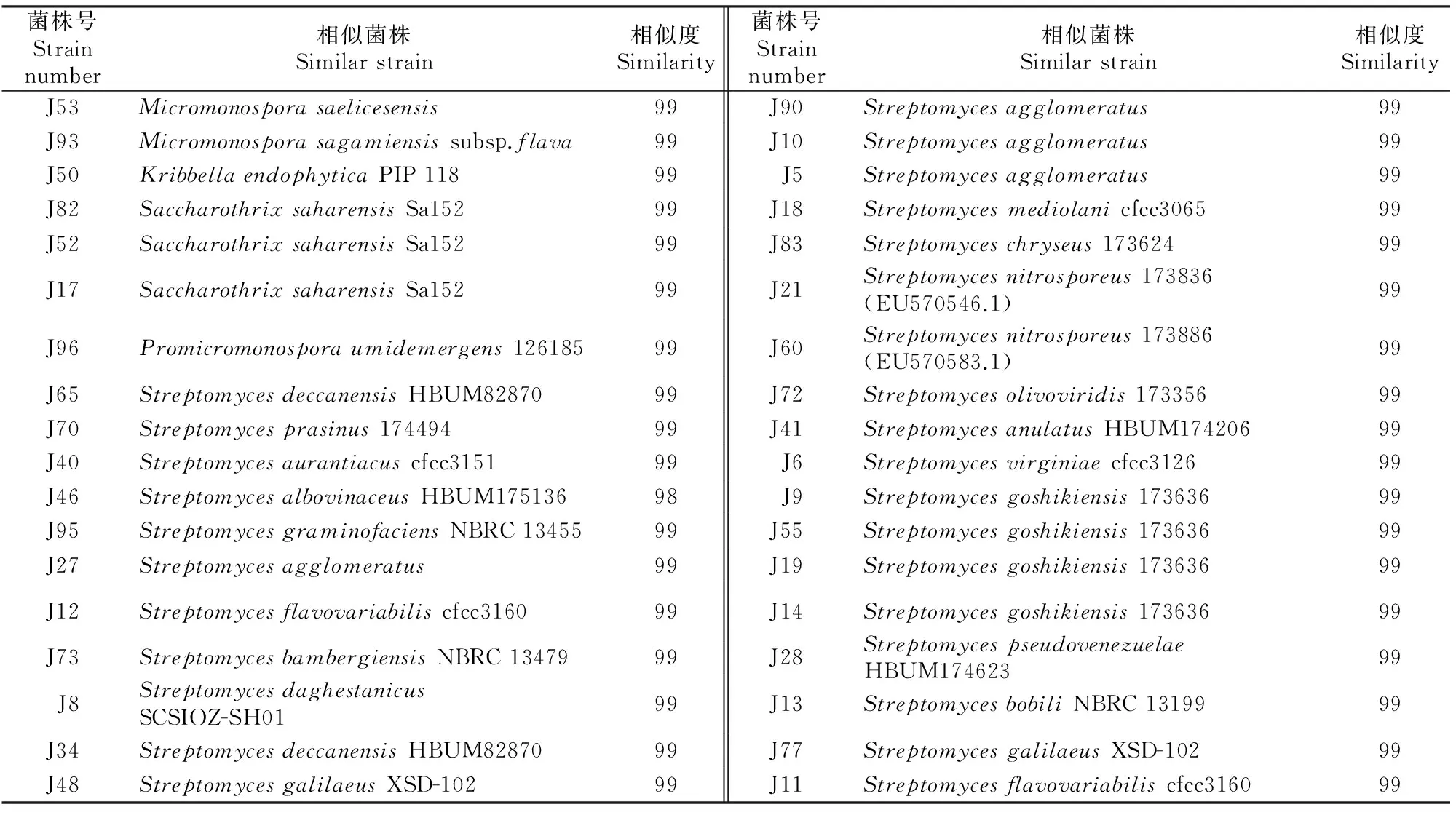
Micromonospora.小单孢菌属;Kribbella.韩国生工菌属;Saccharothrix.糖丝菌属;Promicromonospora.原小单孢菌属;Streptomyces.链霉菌属
经检测发现,36株菌株的pH生长范围为7.0~11.0,最适pH为9.0~10.0,未分离到在pH8.0以下不生长的放线菌,可知所得36株菌株均为耐碱放线菌。
2.23种培养基对36株耐碱放线菌菌株的分离效果
由表3可见,用CCMS培养基共分离到7株耐碱放线菌,分布在4个属;用ISP5培养基分离到6株菌,分布在1个属;用淀粉酪素琼脂培养基分离到23株菌,分布在3个属。可见用淀粉酪素琼脂培养基分离得到的菌株数最多,且物种单一;CCMS培养基分离得到的菌株虽少,但物种较多,分离效果最好。

表 3 3种培养基对36株耐碱放线菌菌株的分离效果比较
2.3分离耐碱放线菌菌株的酶活及拮抗活性
对分离的36株耐碱放线菌进行纤维素利用、淀粉酶水解和蛋白酶活性测定,结果(表4)表明,供试放线菌对不同靶标菌的抑制作用差异较小,对金黄色葡萄球菌和小麦根腐菌的拮抗效果最好,拮抗菌株比例分别达到8.3%和11.1%,对南瓜枯萎菌和番茄灰霉菌拮抗菌株比例次之,达到5.6%,对粉红聚端孢拮抗菌株比例较低,达到2.7%。抑菌圈直径>20 mm的菌株有5株,具体结果见表5。
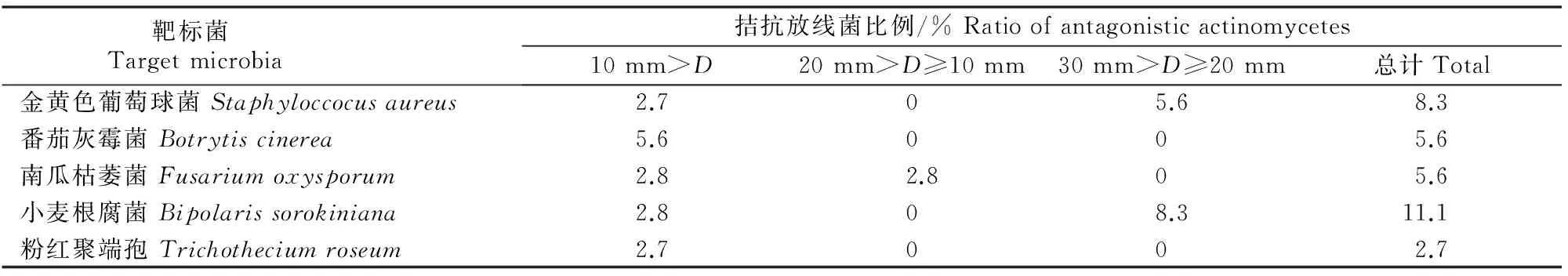
表 4 36株耐碱放线菌对不同靶标菌的拮抗能力
由表5可见,36株耐碱放线菌中有9株具有纤维素酶活性,占供试菌株的25.0%;3株具有淀粉酶活性,占供试菌株的8.3%;6株具有蛋白酶活性,占供试菌株的16.6%。抑菌活性试验结果表明:36株耐碱放线菌中有12株具有拮抗活性,占分离菌株数的33.3%,其中3株能抑制金黄色葡萄球菌生长,4株能抑制小麦根腐菌生长,2株能抑制番茄灰霉菌生长,2株能抑制南瓜枯萎菌生长,1株能抑制粉红聚端孢生长。可见,藏北高寒草原土壤中具有相对丰富的拮抗放线菌资源,可为新抗生素的开发提供广阔空间。
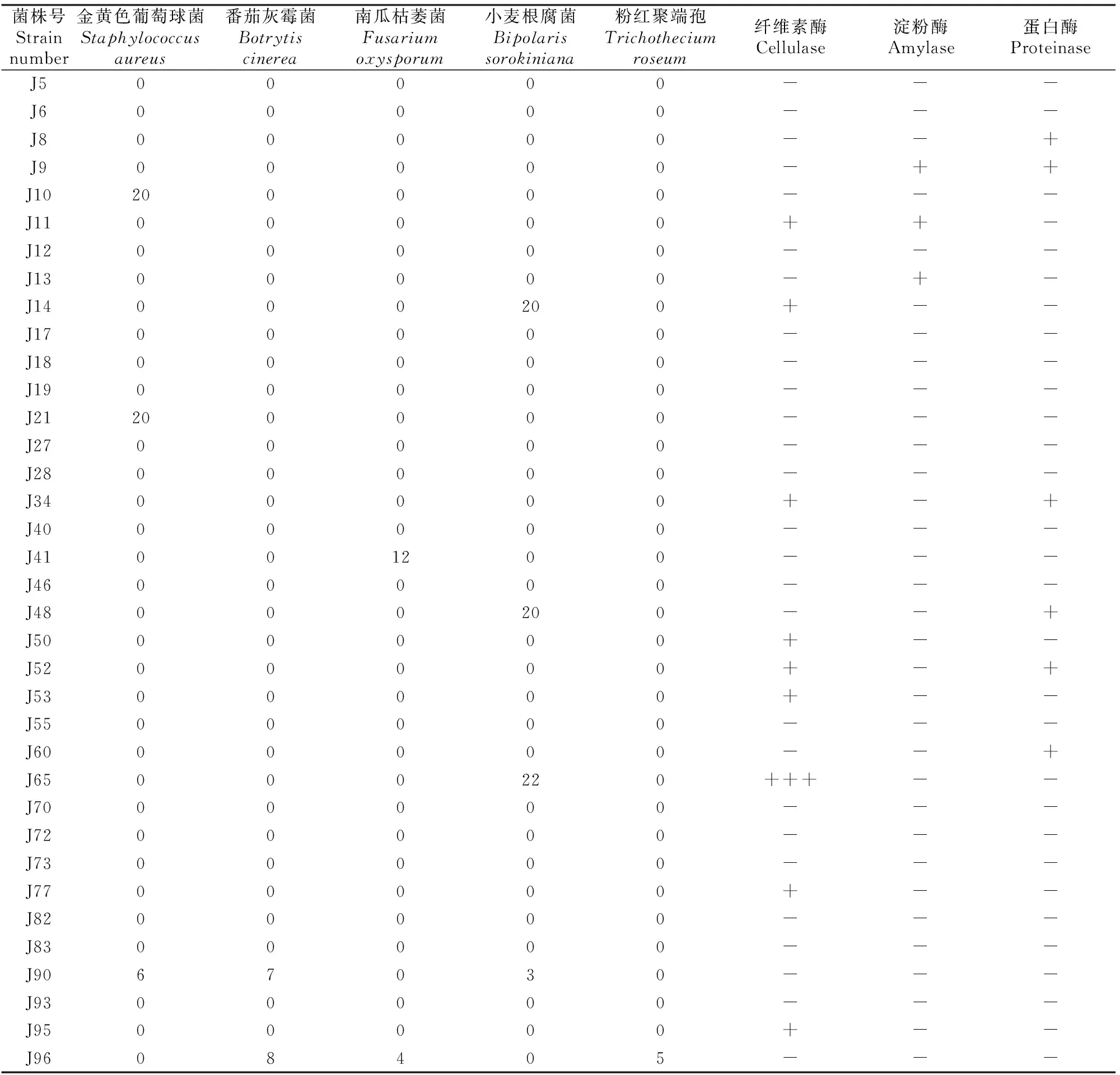
表 5 36株耐碱放线菌的拮抗能力及酶活
注:0~22 为抑菌圈直径(mm),0表示无拮抗活性;纤维素酶:-.阴性;+.阳性;+++.滤纸条降解≥2/3。蛋白酶/淀粉酶:-.阴性;+.阳性。
Note:“0” - “22” represent the diameters of inhibition zone (mm),“0” no antagonistic activity;Cellulase:“-”.Negative;“+”.Positive;“+++”.Degradation of the filter paper≥2/3.Amylase/proteinase:“-”,Negative;“+”.Positive.
3结论与讨论
从藏北高寒草原22份土样中分离得到了36株代表性耐碱放线菌,这36株菌分布于放线菌纲5个亚目5个科5个属内,藏北高寒草原土壤放线菌组成较简单,可能与藏北草原海拔高、低温缺氧、有机质分解缓慢、土壤干旱贫瘠等严酷的生态条件有关,本研究结果与颜霞等[18]对西藏亚高山草原土壤放线菌的研究结果一致。进一步研究发现,链霉菌属是藏北高寒草原环境的绝对优势菌种,这与Lee等[19]的研究结果相同,这也是土壤放线菌区系的一个显著特点。分离的36株耐碱放线菌中25.0%的菌株具有纤维素酶活性,8.3%的菌株具有淀粉酶活性、16.6%的菌株具有蛋白酶活性,少数菌株(如J65)具有较高的纤维素酶活性,个别菌株(如J9、J11、J34、J52)可以产生2种酶。分离的36株菌株中33.3%的有抑菌活性,其中菌株J10、J14、J21、J48和J65有高拮抗活性(抑菌圈直径D≥20 mm),菌株J90和J96株具有广谱拮抗活性,这些结果说明藏北高寒草原蕴藏丰富的耐碱放线菌资源,有待于进一步的发掘及开发。
[参考文献]
[1]Burggraf S,Larsen N,Woese C R,et al.An intron within the 16S ribosomal RNA gene of the archaeonPyrobaculumaerophilum[J].Proceedings of the National Academy of Sciences,1993,90(6):2547-2550.
[2]Woese C R.Bacterial evolution [J].Microbiological Reviews,1987,51(2):221.
[3]张永光,刘晴,王宏飞,等.新疆阜康盐碱地可培养兼性嗜碱放线菌多样性及其酶活筛选 [J].微生物学报,2014,54(2):183-190.
Zhang Y G,Liu Q, Wang H F,et al.Biodiversity and enzymes of culturable facultative-alkaliphilic actinobacteria in saline-alkaline soil in Fukang,Xinjiang [J].Microbiology,2014,54(2):183-190.(in Chinese)
[4]Tsujibo H,Sato T,Inui M,et al.Intracellular accumulation of phenazine antibiotics produces by an alkalophilic actinomycete:Ⅰ .Taxonomy,isolation and identification of the phenazine antibiotics [J].Agric Biol Chem,1988,52(2):301-306.
[5]Tsujibo H,Sakamoto T,Miyamoto K,et al.Isolation of cytotoxic substance,kalafungin from an alkalophilic actinomycete,Nocardiopsisdassonvilleisubsp.Prasina[J].Chem Pharm Bull (Tokyo),1990,38(8):2299-2300.
[6]Bahn Y S, Park J M,Bai D H,et al.A novel aldose reductase ingihitor isolated from alkalophilicCorynebacteriumsp YUA25:Ⅰ.Taxonomy,fermentation,isolation and characterization [J].J Antibiol,1998,51(10):902-907.
[7]彭岳林,蔡晓布,薛会英.退化高寒草原土壤微生物变化特性研究 [J].西北农业学报,2007,16(4):112-115.
Peng Y L,Cai X B,Xue H Y.Study on variation characteristics of soil microbial biomass in the degraded alpine steppes [J].Acta Agriculturae Boreali-occidentalis Sinica,2007,16(4):112-115.(in Chinese)
[8]蔡晓布,张永青,邵伟.藏北高寒草原草地退化及其驱动力分析 [J].土壤,2007,36(9):855-858.
Cai X B,Zhang Y Q,Shao W.Degredation and mechanism of grassland of North Tibet Alpine prairie [J].Soil,2007,36(9):855-858.(in Chinese)
[9]Li W J,Zhang Y G,Zhang Y Q,et al.Streptomycessodiiphilussp.nov.,a novel alkaliphilic actinomycete [J].International Journal of Systematic and Evolutionary Microbiololgy,2005,55(3):1329-1333.
[10]何幼鸾,谢芳,曾青兰,等.生物化学实验 [M].武汉:华中师范大学出版社,2006.
He Y L,Xie F,Zeng Q L,et al.Biochemistry experiment [M].Wuhan:Huazhong Normal University Press,2006.(in Chinese)
[11]徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组DNA [J].微生物学通报,2003,30(4):82-84.
Xu P,Li W J,Xu L H,et al.A microwave-based method for genomic DNA extraction from actinomycetes [J].Microbiology China,2003,30(4):82-84.(in Chinese)
[12]Thompson J D,Gibson T J,Plewniak F,et al.The Clustal X windows interface:Flexiblestrategies for multiple sequence alignment aided by qualityanalysis tools [J].Nucleic Acids Research,1997,25(24):4876-4882.
[13]Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis (MEGA)software version 4.0 [J].Molecular Biology and Evolution,2007,24(8):1596-1599.
[14]Saitou N,Nei M.The neighbor-joining method:A new method for reconstructing phylogenetic trees [J].Molecular Biology and Evolution,1987,4(4):406-425.
[15]徐丽华,李文均,刘志恒,等.放线菌系统学原理、方法及实践 [M].北京:科学出版社,2007.
Xu L H,Li W J,Liu Z H,et al.Actinomycetes systematic principle,methods and practices [M].Beijing:Science Press,2007.(in Chinese)
[16]马赛箭,安超,常帆,等.环青海湖地区可培养放线菌多样性及生物活性 [J].西北农业学报,2015,24(11):133-139.
Ma S J,An C,Chang F,et al.Diversity and bioactivity of culturable actinobacteria from region of around Qinghai lake [J].Acta Agriculturae Boreali-occidentalis Sinica,2015,24(11):133-139.(in Chinese)
[17]Kasai H,Tamura T,Harayama S.Intrageneric relationships amongMicromonosporaspecies deduced from gyrB-based phylogeny and DNA relatedness [J].International Journal of Systematic and Evolutionary Microbiology,2000,50(1):127-134.
[18]颜霞,朱铭莪,夏育军,等.西藏亚高山草原土放线菌研究 [J].西北农业学报,1999,8(2):102-106.
Yan X,Zhu M E,Xia Y J,et al.The investigation of actinomycetes in the sub-alpine steppe soil of Tibet [J].Acta Agriculturae Boreali-occidentalis Sinica,1999,8(2):102-106.(in Chinese)
[19]Lee J Y, Hwang B K.Diversity of antifungal actinomycetes in various vegetative soils of Korea [J].Canadian Journal of Microbiology,2002,48(5):407-417.
Biological activity and diversity of alkali tolerant actinomycetes in northern Tibet alpine grassland
YIN Ming-yuan,HE Jian-qing,ZHANG Ge-jie
(TibetAgriculturalandAnimalHusbandryCollege,Linzhi,Tibet860000,China)
Abstract:【Objective】 This study analyzed biodiversity,enzymes producing potential and antagonistic activity of alkali tolerant actinomycetes to provide reference for exploration of related resources.【Method】 A total of 22 soil samples were collected from saline-alkaline fields in northern Tibet Alpine grassland.Actinomycetes were isolated with plate dilution method.According to morphological characters,36 typical stains were selected.The alkali tolerant actinomycete strains were identified by sequence analysis of 16S rRNA.The antimicrobial activities of 36 strains were tested against plant pathogenic fungi and bacteria by measuring the mycelium growth rate.The activities of enzymes including amylase,proteinase and cellulase were also detected.【Result】 A total of 36 representative strains were separated from 22 samples and 16S rRNA sequence analysis showed that they were grouped into 5 genera (Streptomyces,Saccharothrix,Micromonospora,Promicromonospora,Kribbella)of 5 families belong to 5 orders of actinobacteria.Among the 36 strains,25.0% could produce cellulase,8.3% could produce amylase and 16.6% could produce proteinase. Among the obtained alkali tolerant actinomycetes,33.3% showed antibacterial activity and those with high activity (diameter of inhibition zone was ≥20 mm) were J10,J14,J21,J48,and J65.【Conclusion】 Diverse alkali tolerant actinomycetes with high enzyme producing activity and antagonistic activity against bacteria were discovered from saline-alkaline environments in northern Tibet grassland.
Key words:alkali torelant actinomycete;16S rRNA;biological activity;northern Tibet alpine grassland
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.020
[收稿日期]2015-07-02
[基金项目]国家自然科学基金项目(31260005);西藏大学农牧学院研究生创新计划项目(YJS2015-02)
[作者简介]尹明远(1991-),男,内蒙古赤峰人,硕士,主要从事极端环境放线菌研究。E-mail:397598979@qq.com[通信作者]何建清(1971-),女,四川南充人,教授,主要从事放线菌和生物防治研究。E-mail:hejianqingxz@163.com
[中图分类号]Q938
[文献标志码]A
[文章编号]1671-9387(2016)04-0142-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.040.html

